石枫团队代表性工作:多重手性元素呋喃-吲哚的设计与选择性合成
导语
在合成化学领域,催化不对称合成具有多重手性元素(即兼具轴手性和中心手性)的呋喃类化合物已经成为一个重要但是非常具有挑战性的科学问题。为了解决这一问题,近日,江苏师范大学/常州大学石枫、谭伟等人设计了一类新型的兼具轴手性和中心手性的五元-五元呋喃-吲哚骨架,并通过有机催化下非手性呋喃-吲哚与2,3-吲哚二甲醇发生具有反常区域选择性的不对称(2+4)环化反应,实现了该类具有多重手性元素呋喃-吲哚化合物的高区域选择性、非对映选择性和对映选择性合成。该类新型具有多重手性元素的呋喃化合物可以衍生为手性羧酸和手性三级膦,作为手性配体或有机小分子催化剂应用于不对称催化。此外,该工作结合理论计算,深入探究了反应机理、活化模式以及选择性产生的根源。该工作为合成具有多重手性元素的呋喃化合物提供了新策略,有望在不对称催化中发现更多的应用。相关论文发表于Angew. Chem. Int. Ed.。

阻转异构现象广泛存在于自然界中,阻转异构体具有独特的性质,在药物化学、材料科学、不对称催化等领域有着广泛的应用。因此,催化不对称合成阻转异构体,尤其是(杂)芳基阻转异构体,在合成化学和生物化学领域受到了强烈关注。轴手性呋喃骨架是一类五元杂芳基阻转异构体,构成了许多天然产物、生物活性分子和手性配体的核心单元(图1a)。因此,轴手性呋喃骨架的催化不对称构建对于发现生物活性分子和发展手性配体或有机小分子催化剂具有非常重要的意义。
然而,关于催化不对称构建轴手性呋喃骨架的方法却屈指可数。2017年,Rodriguez、Bonne及其合作者通过氧化中心手性转化为轴手性的策略,在有机催化下首次对映选择性地合成了呋喃类阻转异构体(J. Am. Chem. Soc., 2017, 139, 2140)。目前,已经构建的轴手性呋喃骨架主要包括3-芳基苯并呋喃、具有两个C-C轴的3-芳基苯并呋喃、兼具中心手性的3-芳基苯并呋喃、以及3-异吲唑基苯并呋喃(图1b)。值得注意的是,大多数合成的呋喃类阻转异构体都是基于五元-六元呋喃类骨架,目前仅有一例构建五元-五元呋喃类骨架的报道,即祝诗发课题组采用过渡金属催化下中心手性到轴手性转化的策略构建了3-异吲唑基苯并呋喃骨架(Chem. Sci. 2021, 12, 13730)。近年来,由于将中心手性引入阻转异构体中可以为轴手性分子提供新的特性,所以兼具轴手性和中心手性分子的催化不对称合成已成为一个新兴的研究领域(综述:Angew. Chem. Int. Ed. 2023, DOI: 10.1002/anie.202311053)。尽管如此,兼具轴手性和中心手性的呋喃类化合物的催化不对称合成却鲜有报道,仅赵宇课题组报道过一例,即通过有机催化的不对称串联反应构建了兼具中心手性和轴手性的3-芳基苯并呋喃骨架(J. Am. Chem. Soc. 2019, 141, 17062)。所以,该领域存在的挑战性问题主要包括:(1)设计新型兼具中心手性和轴手性的五元-五元呋喃类骨架;(2)发展催化不对称构建具有多重手性元素呋喃骨架的新策略;(3)探究反应机理以及具有多重手性元素呋喃骨架的应用。
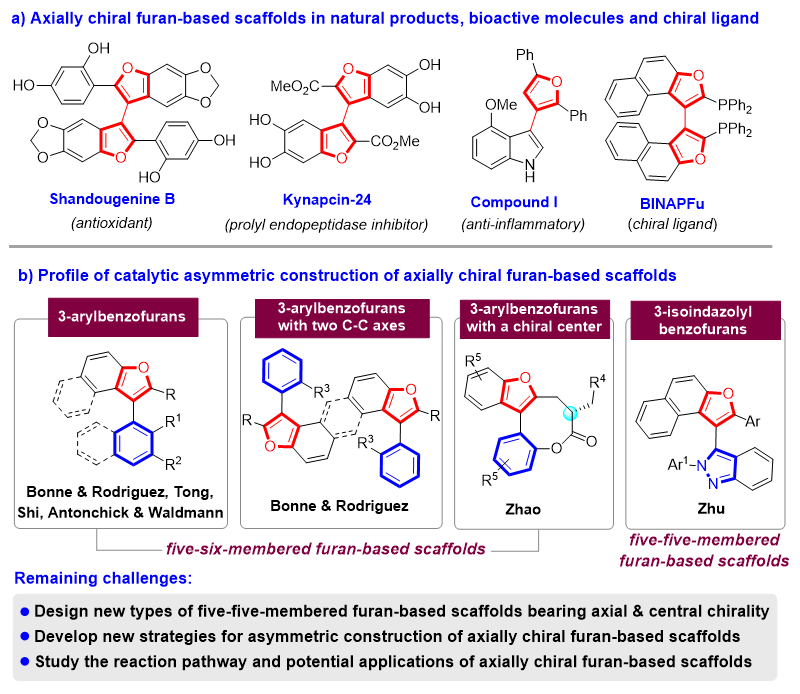
图1. 催化不对称构建轴手性呋喃骨架的概况和存在的挑战性问题
为了解决这些挑战性问题,石枫团队设计了一类新型的兼具中心手性和轴手性的五元-五元呋喃类骨架,并且实现了其催化不对称构建。由于手性吲哚衍生物的重要性,该团队基于对手性吲哚化学的理解(工作小结:Acc. Chem. Res. 2020, 53, 425; Acc. Chem. Res. 2022, 55, 2562),考虑将吲哚环引入轴手性呋喃骨架中。尽管近年来轴手性吲哚骨架的催化不对称构建发展非常迅速(图2a)(综述:Chem. Eur. J. 2020, 26, 15779),但是大多数构建的骨架都集中在五元-六元轴手性吲哚骨架上。相反,催化不对称构建五元-五元轴手性吲哚骨架的方法却非常有限,这归因于该类骨架固有的一些挑战,即轴两侧邻位取代基距离远、构型稳定性弱。因此,克服这些挑战以实现五元-五元轴手性吲哚骨架的催化不对称构建具有非常重要的意义。基于这些考虑,石枫团队通过将轴手性吲哚与呋喃骨架融合,并将中心手性引入到轴手性骨架中,设计了一类新型的兼具轴手性和中心手性的五元-五元呋喃-吲哚骨架(图2b)。

图2. 兼具轴手性和中心手性的五元-五元呋喃-吲哚骨架的设计
针对这一目标,石枫团队发展了可用于催化不对称(2+n)环化反应的呋喃-吲哚平台分子(图3a),通过对映异构体(当吲哚C2优先加成时)或非对映异构体(当吲哚N1优先加成时)的动态动力学拆分(DKR)策略,实现了兼具轴手性和中心手性的呋喃-吲哚骨架的构建。在非手性呋喃-吲哚平台分子的结构中,呋喃环上的R2和R3基团作为轴两侧的大位阻基团,可以在反应后使轴的旋转受阻。此外,吲哚环的C2位和NH基团作为反应位点和催化剂活化位点,使这类呋喃-吲哚平台分子可以作为1, 2-双亲核试剂。这些结构特征使该类非手性呋喃-吲哚平台分子能够在手性有机小分子催化剂(Organo-Cat.*)存在下,与双亲电试剂发生不对称(2+n)环化反应,通过动态动力学拆分的过程,合成兼具轴手性和中心手性的呋喃-吲哚化合物。
基于这一策略,作者设计在手性磷酸(CPA)催化下,非手性呋喃-吲哚与2, 3-吲哚二甲醇发生不对称(2+4)环化反应(图3b)。吲哚甲醇属于一类合成手性吲哚化合物的高效平台分子,石枫团队长期致力于发展新型的吲哚甲醇平台分子及其参与的催化不对称反应(综述:Chin. J. Org. Chem. 2022, 42, 3351;代表性工作:Angew. Chem. Int. Ed. 2017, 56, 116; Angew. Chem. Int. Ed. 2019, 58, 8703; Chin. J. Chem. 2020, 38, 543; Angew. Chem. Int. Ed. 2021, 60, 2355; Chin. J. Chem. 2022, 40, 2151; Angew. Chem. Int. Ed. 2023, 62, e202305450)。该团队基于对吲哚甲醇化学的探索与理解,认为2, 3-吲哚二甲醇可用作环化反应的四碳合成砌块,所以选择该类平台分子作为(2+4)环化反应的1, 4-双亲电试剂。选择CPA作为有效的手性有机小分子催化剂,归因于其可通过形成氢键或离子对来活化吲哚类底物,从而控制所设计的(2+4)环化反应的立体选择性。值得注意的是,在设计的反应中,除了需要控制非对映选择性和对映选择性之外,还存在控制(2+4)环化反应的区域选择性问题。具体而言,(2+4)环化有两种可能的区域选择性:一种可能性是吲哚C2位优先对碳正离子(由2,3-吲哚二甲醇通过脱水产生)进行加成(路径I);另一种可能性是吲哚N1位优先对碳正离子进行加成(路径II)。在以往的文献报道中,在布朗斯特酸催化下,吲哚C2位总是表现出比吲哚N1位更强的亲核性,导致吲哚C2位加成优先于吲哚N1位加成。因此,路径I属于吲哚反应物正常的区域选择性,而路径II属于吲哚反常的区域选择性。然而,作者在尝试该(2+4)环化反应后,发现得到的产物具有反常的区域选择性,最终通过理论计算解释了这种选择性产生的原因。
因此,该工作的意义在于不仅首次构建了兼具轴手性和中心手性的五元-五元呋喃类骨架,而且发展了非对映选择性和对映选择性合成轴手性呋喃类化合物的新策略。此外,该工作实现了非手性呋喃-吲哚与吲哚二甲醇的反常区域选择性(2+4)环化反应,并结合理论计算对反应途径、活化模式和选择性根源进行了深入研究。
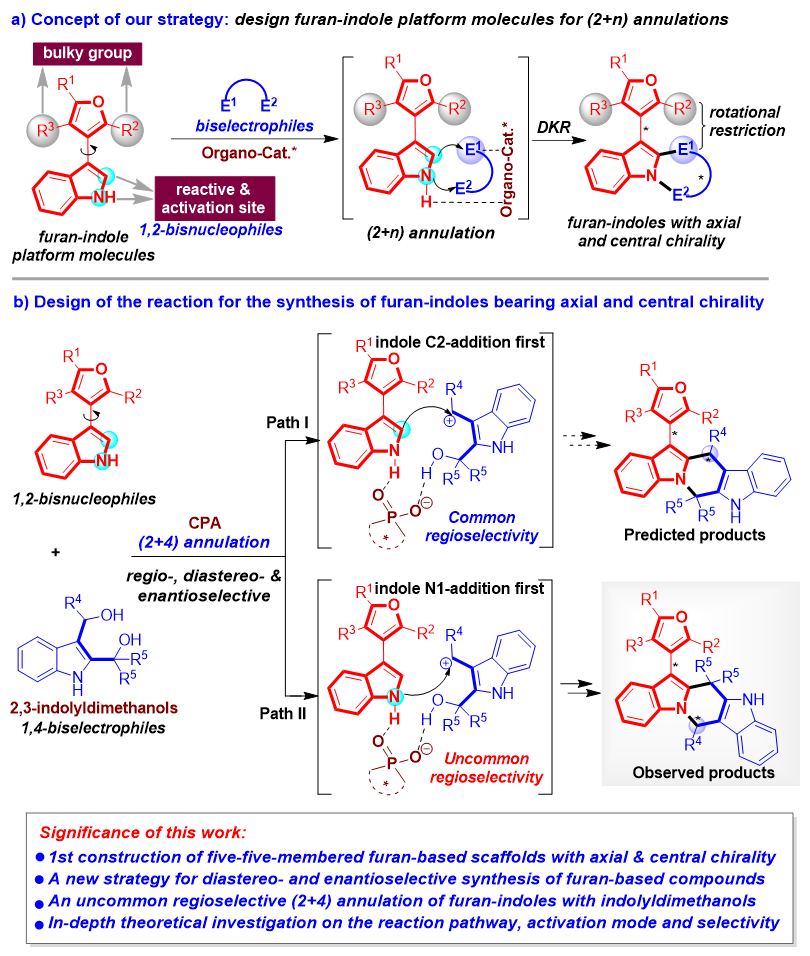
图3. 兼具轴手性和中心手性呋喃-吲哚的合成策略及反应设计
基于上述设计,石枫、谭伟等人成功地实现了2,3-吲哚二甲醇1与非手性呋喃-吲哚2的催化不对称(2+4)环化反应,高收率、高非对映选择性和对映选择性地合成了一系列兼具轴手性和中心手性的五元-五元呋喃类化合物3。该反应适用于具有各种R1/R2/R3基团的2, 3-吲哚二甲醇1a-1r,得到了结构多样性的呋喃-吲哚化合物3aa-3ra(表1)。值得注意的是,噻吩基作为2, 3-吲哚二甲醇的杂芳族R2/R3基团也能够在该反应中兼容,以优异的非对映选择性和对映选择性生成具有多重手性元素的产物3la。
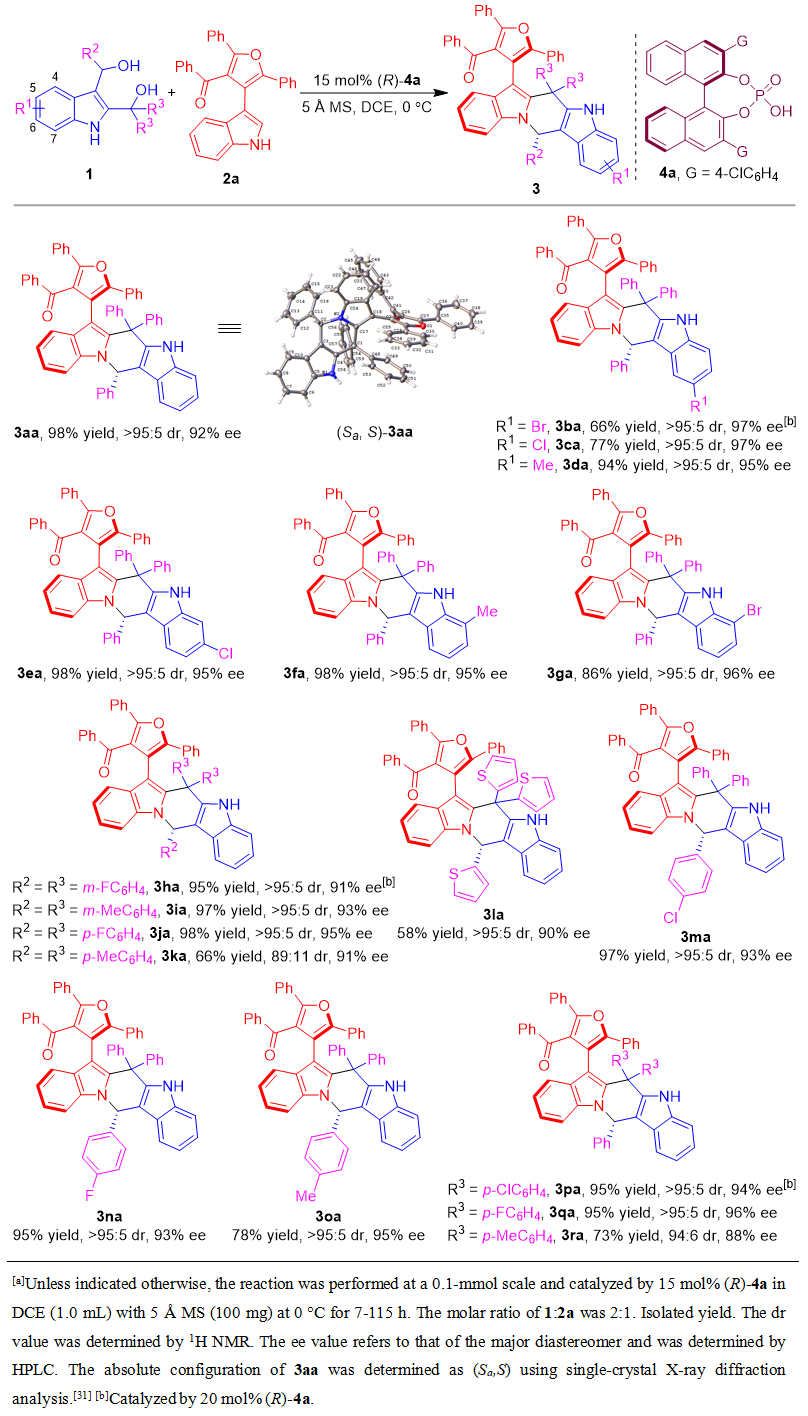
表1. 2,3-吲哚二甲醇的底物范围
此外,作者也研究了非手性呋喃-吲哚平台分子2作为底物的范围(表2)。一系列具有不同R1/R2/R3基团的非手性呋喃-吲哚(2b-2q)均适用于该反应,以良好的产率、高的对映选择性以及优异的非对映选择性生成相应的产物3ab-3aq。值得注意的是,环丙基也可作为合适的R2取代基,以优异的产率得到具有高立体选择性的产物3an。此外,底物2结构中的R3取代基不仅限于苯甲酰基,也可以是酯基或硫代甲基。

表2. 非手性呋喃-吲哚2的底物范围
为了探究这类兼具轴手性和中心手性的新型呋喃-吲哚化合物的性质,作者研究了产物3aa和3an的稳定性(图4a)。在80 °C的异丙醇或120 °C的甲苯中搅拌10小时后,能够以高产率回收呋喃-吲哚3aa和3an,并且相应化合物的非对映选择性和对映选择性能够保持不变。这些实验证明了这类手性呋喃-吲哚骨架的高热稳定性和构型稳定性。此外,通过理论计算,产物3aa和3an的旋转能垒分别为44.4和31.4 kcal•mol-1,远高于在室温下分离单个阻转异构体所需的旋转能垒(24 kcal•mol-1)。
为了证明催化不对称(2+4)环化反应和这类手性呋喃-吲哚化合物的实用性,作者进行了1 mmol规模的反应、合成转化以及在不对称催化中的应用(图4b-4d)。首先,1 mmol规模的反应(图4b)能以高产率和优异的立体选择性合成手性呋喃-吲哚产物3aa、3ao和3aq,表明该类反应可以进行放大。然后,将产物3ao重结晶到99% ee后,进行各种合成转化(图4c),得到了衍生物7-9以及手性三级膦11和13。需要指出的是,呋喃-吲哚衍生物9和11可分别用作不对称催化中的手性配体和有机小分子催化剂(图4d)。例如,呋喃-吲哚衍生物9是一种新型的手性羧酸,可作为手性配体应用于铑催化的不对称亚甲基C-H酰胺化反应,以中等的收率得到手性产物16。此外,呋喃-吲哚衍生的三级膦11可作为手性有机小分子催化剂,应用于茚满二酮衍生的烯烃与MBH酯的(4+2)环化反应,以良好的产率、优异的非对映选择性以及中等的对映选择性得到产物19。这些初步的结果表明,这类含有多重手性元素的新型呋喃-吲哚骨架在开发新型手性配体或有机小分子催化剂方面显示出较大的潜力,有望在不对称催化中得到进一步的应用。
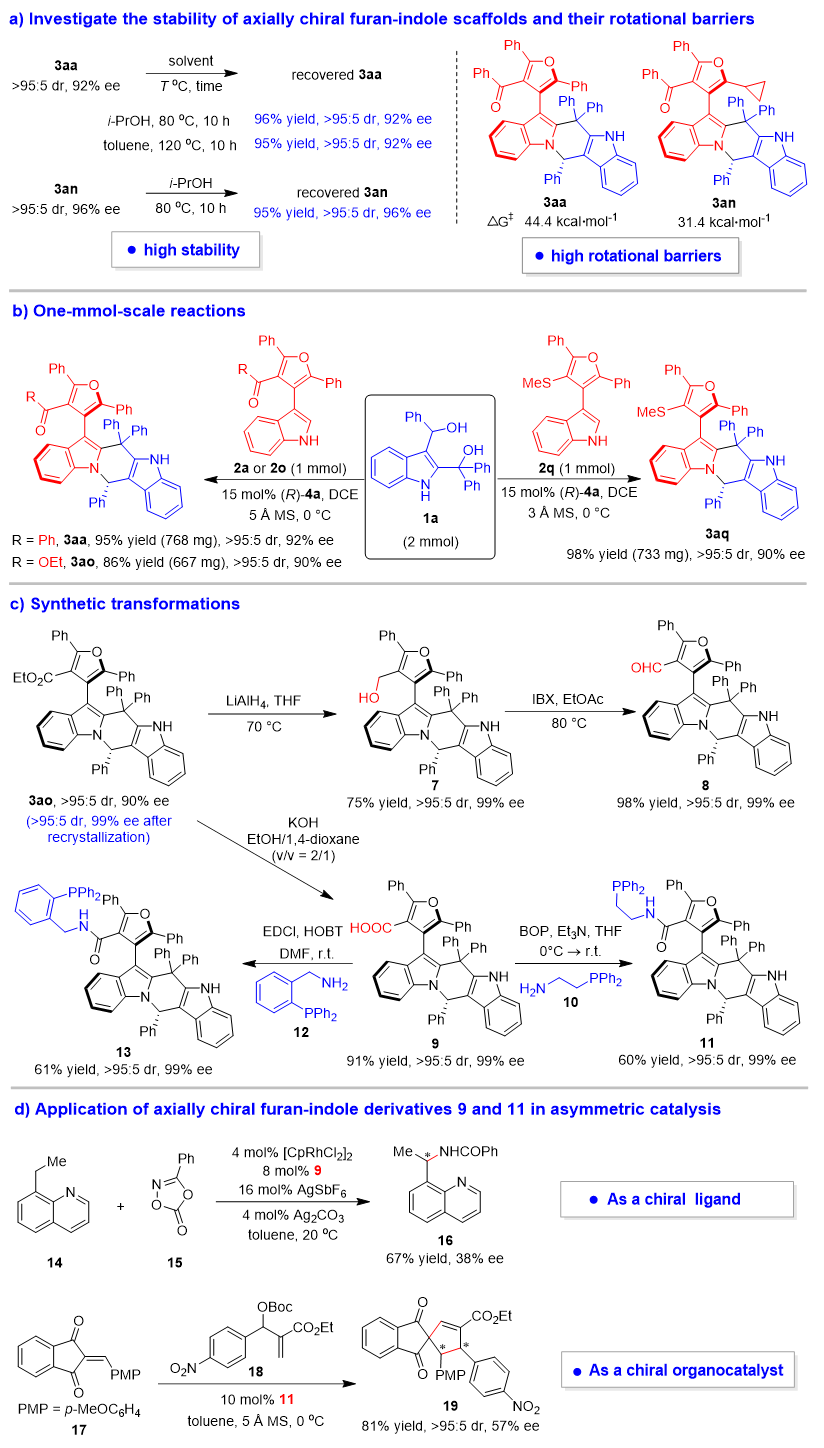
图4. 产物的稳定性、1 mmol规模反应、合成转化和应用研究
为了研究反应机理,作者开展了一系列控制实验(图5)。首先,在标准条件下,使用N-甲基保护的2,3-吲哚二甲醇1s作为底物与呋喃-吲哚2a反应(图5a)。结果发现,反应并没有发生,这表明2,3-吲哚二甲醇1中的NH基团在控制(2+4)环化的反应性方面起着至关重要的作用,可能是通过与CPA催化剂形成氢键作用。此外,还监测了2,3-吲哚二甲醇1a与底物2a的反应过程。当反应时间从19小时缩短到13小时,能够以42%的产率和94%的ee分离得到化合物20,以及以55%的产率和92%的ee分离得到产物3aa(图5b)。随后,在最佳条件下使用化合物20再继续反应3小时,以87%的收率得到了对映选择性保持的产物3aa(图5c)。这一结果不仅表明化合物20是该反应发生分子内环化过程中的关键中间体,而且证实了(2+4)环化反应的第一步是吲哚N1位优先对碳正离子(由2, 3-吲哚二甲醇通过脱水生成)进行加成。值得注意的是,中间体20的旋转能垒只有10.5 kcal•mol-1,这表明从20转化为3aa是通过非对映异构化产生稳定轴手性的DKR过程。为了研究轴手性的产生是由中心手性诱导的还是由手性催化剂控制的,作者在对甲苯磺酸(TsOH)作为非手性催化剂的作用下,对具有94% ee的中间体20进行了分子内环化反应,结果以86%的产率、92% ee的对映选择性以及>95:5 dr的非对映选择性得到了产物3aa(图5d)。该结果与在手性催化剂(R)-4a催化下获得的结果类似(图5c)。此外,在不存在TsOH或(R)-4a作为酸性催化剂的情况下(图5e),反应不能发生。因此,这些实验表明:(1)酸性催化剂对于中间体20转化为最终产物3aa是必要的;(2)产物3aa中的轴手性不是由手性催化剂控制产生的,而是由中间体20的中心手性诱导产生的。
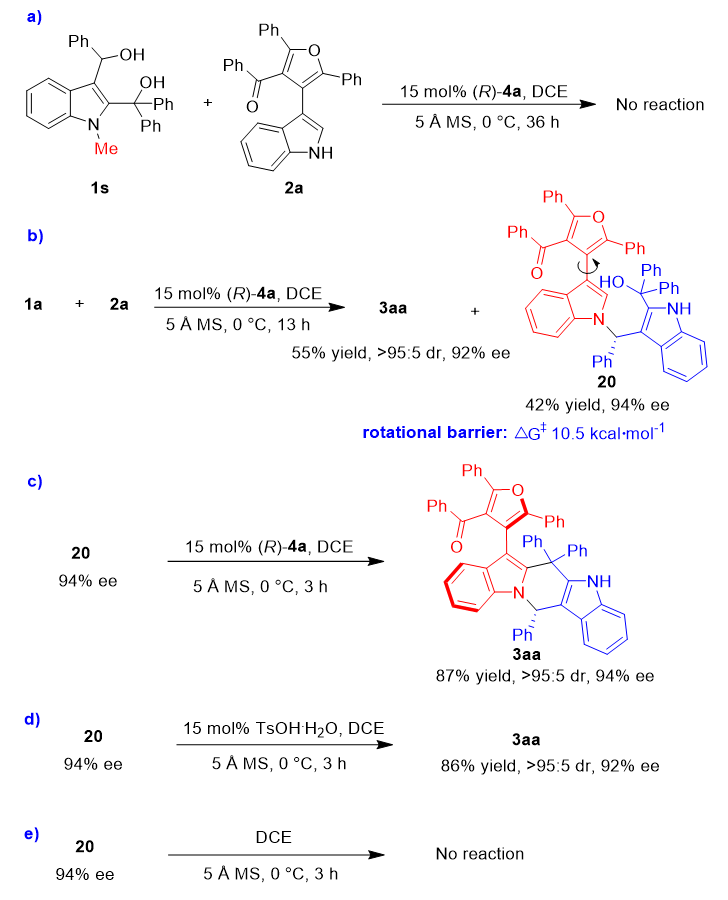
图5. 研究反应机理的控制实验
此外,为了深入理解有机催化不对称(2+4)环化的反应机理和活化模式,石枫团队与汕头大学倪绍飞课题组合作,对环化反应的历程和活化模式等进行了理论计算研究。如图6a所示,在CPA (R)-4a催化下,2, 3-吲哚二甲醇1a经历脱水过程,通过过渡态TS1,得到碳正离子中间体Int2。计算发现,在Int1、TS1和Int2的结构中,2, 3-吲哚二甲醇1a的N-H和O-H基团与CPA (R)-4a之间形成了多重氢键从而促进了脱水过程,很好地解释了图5a的控制实验,佐证了2, 3-吲哚二甲醇1a的吲哚NH基团在反应中起了重要的作用。然后,呋喃-吲哚底物2a与催化剂(R)-4a之间通过氢键作用形成Int3,进而导致2a的NH基团区域选择性地进攻碳正离子,经过过渡态TS2,发生对映选择性的亲核加成,得到手性中间体Int4。Int4的形成与图5b和5c的控制实验一致,表明化合物20是该(4+2)环化反应的关键中间体。随后,Int4转化为更稳定的Int5,其中CPA (R)-4a与2, 3-吲哚二甲醇结构中的N-H和O-H基团形成了两个氢键。在这种双氢键活化下,发生第二步脱水,通过过渡态TS3产生另一个碳正离子中间体Int6。最后,吲哚C2位与碳正离子发生分子内加成反应,通过过渡态TS4完成(2+4)环化,再通过TS5进行去质子化过程,得到产物3aa并再生催化剂 (R)-4a。整个过程的决速步是TS4,它需要23.6 kcal•mol-1的吉布斯自由能。
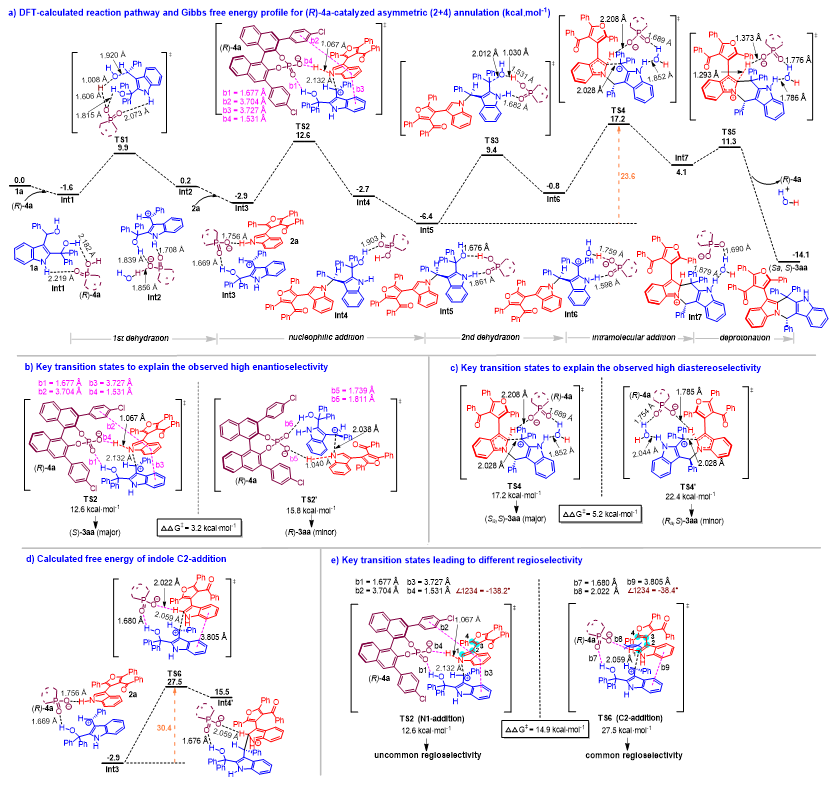
图6. 通过理论计算探究反应历程和选择性产生的根源
为了解释产物3aa的高对映选择性,作者比较了产生中心手性的关键过渡态TS2和TS2′,它们分别对应于(S)-3aa和(R)-3aa的生成。如图6b所示,TS2的吉布斯自由能为12.6 kcal•mol-1,而TS2′的吉布斯自由能为15.8 kcal•mol-1。前者比后者低3.2 kcal•mol-1,这与实验观察到产物3aa的高对映选择性(92%ee)一致。计算出的两种决定对映选择性的过渡态之间的能垒差可归因于底物与催化剂(R)-4a之间的不同相互作用。在TS2中,除了(R)-4a与两个底物之间形成两个强氢键(b1和b4)之外,(R)-4a和1a的苯环(b2)之间以及两个底物(b3)之间还存在着π-π相互作用。相反,在TS2′中,(R)-4a与两个底物(b5和b6)之间仅形成了两个氢键,并没有π-π相互作用。此外,为了解释产物3aa的高非对映选择性,作者还比较了产生轴手性的关键过渡态TS4和TS4′(图6c),它们分别对应于产生具有相反轴手性的两个非对映体(Sa, S)-3aa和(Ra, S)-3aa。结果发现,TS4′的吉布斯自由能比TS4高5.2 kcal•mol-1,这与实验观察到3aa的高非对映选择性(>95:5 dr)一致。同时,为了定量理解TS4和TS4’之间5.2 kcal•mol-1能垒差的来源,作者进行了Wheeler’s能量分析。结果发现,底物和催化剂的结构变形导致TS4和TS4’之间产生较大的能垒差,由此解释了产生轴手性过程中获得高的非对映选择性的原因。
为了解释催化不对称(2+4)环化反应中反常的区域选择性,作者计算了决定区域选择性的亲核加成这一步的吉布斯自由能。如图6d所示,TS6是吲哚C2位优先亲核加成到碳正离子中间体(由1a生成)的过渡态。TS6的吉布斯自由能为30.4 kcal•mol-1,比吲哚N1位优先亲核加成到碳正离子中间体的过渡态TS2高14.9 kcal•mol-1,解释了没有观察到正常区域选择性(吲哚C2优先加成)产物3aa′的原因。同时,作者还比较了TS2和TS6的结构(图6e)。结构分析表明,在TS2中,观察到催化剂与底物之间存在两个强氢键(b1和b4)和两个π-π相互作用(b2和b3)。相反,TS6中两个氢键(b7和b8)的键长比TS2中相应的键长(b1和b4)更长。此外,在TS6中,1a和2a(b9)之间仅观察到一种π-π相互作用,导致底物和催化剂之间的相互作用比较弱。TS6的这些立体效应和弱相互作用导致TS2和TS6之间产生大的能垒差,进一步解释了所观察到的催化不对称(2+4)环化反应中反常的区域选择性。
小结
江苏师范大学/常州大学石枫、谭伟等人通过有机催化不对称(2+4)环化反应的策略,首次实现了新型的兼具轴手性和中心手性的呋喃-吲哚骨架的设计及立体选择性构建,克服了催化不对称构建轴手性五元-五元呋喃类骨架中存在的挑战性问题,以优异的区域选择性、非对映选择性和对映选择性,高产率地合成了兼具轴手心和中心手性的呋喃-吲哚化合物。更重要的是,这种新型的具有多重手性元素的骨架具有很高的稳定性,可以衍生为新型的手性配体或有机小分子催化剂,应用于不对称催化。此外,结合理论计算,深化了对反应机理、活化模式和选择性产生根源的理解。该工作不仅首次构建了兼具轴手性和中心手性的五元-五元呋喃类骨架,而且为对映选择性和非对映选择性合成轴手性呋喃类化合物提供了一种新策略,为轴手性家族增添了新的成员。此外,该工作实现了吲哚二甲醇与呋喃-吲哚的反常区域选择性不对称(2+4)环化反应,丰富了手性吲哚化学和吲哚甲醇化学的研究内容。
上述研究成果发表在Angew. Chem. Int. Ed.,江苏师范大学硕士研究生王静怡(实验部分)、高聪慧(实验部分)以及汕头大学硕士研究生马程(理论计算部分)为共同第一作者,江苏师范大学/常州大学石枫教授、江苏师范大学谭伟副教授、汕头大学倪绍飞老师为共同通讯作者。该工作的实验部分由谭伟副教授和石枫教授共同指导完成,理论计算部分由倪绍飞老师指导并与石枫教授探讨完成。该项工作主要得到了国家自然科学基金和江苏省自然科学基金的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Design and Catalytic Asymmetric Synthesis of Furan-Indole Compounds Bearing both Axial and Central Chirality
Jing-Yi Wang, Cong-Hui Gao, Cheng Ma, Xin-Yue Wu, Shao-Fei Ni, Wei Tan, Feng Shi
Angew. Chem. Int. Ed., 2023, DOI: 10.1002/anie.202316454
通讯作者简介
石枫 教授

石枫,江苏师范大学教授、常州大学特聘教授。主要从事催化不对称合成手性杂环的研究,聚焦手性吲哚化学这一研究领域,为构建结构复杂多样的手性杂环骨架提供了高效、高选择性的方法。以通讯作者在《Acc. Chem. Res.》、《Angew. Chem. Int. Ed.》、《J. Am. Chem. Soc.》、《Fundam. Res.》、《Sci. China Chem.》、《Chin. J. Chem.》等业界公认的国际重要科技期刊发表学术论文130余篇,获得发明专利授权11项,入选Elsevier 2020-2022高被引学者。荣获江苏省第二届“十佳研究生导师”提名奖、江苏省研究生教育改革成果奖优秀奖、江苏省科学技术二等奖、教育部自然科学二等奖、Thieme Chemistry Journal Award、Asian Core Program Lectureship Award、新和成《中国化学》创新奖等奖项。担任《有机化学》、《Chem. Synth.》编委、《Eur. J. Org. Chem.》编委会主席团成员、《Org. Chem. Front.》、《J. Org. Chem.》和《Synthesis》国际编委。
石枫团队主页:
https://www.x-mol.com/groups/Shi_Feng
谭伟 副教授

谭伟,江苏师范大学化学与材料科学学院副教授,硕士生导师。2015年于江苏师范大学获得硕士学位(导师:石枫教授),2019年于华东师范大学获得博士学位(导师:姜雪峰教授),同年被引进到江苏师范大学。主要从事生物活性手性杂环分子的催化不对称合成、轴手性杂环骨架的催化不对称构建研究,近年来以通讯作者或第一作者在《Fundam. Res.》、《J. Am. Chem. Soc.》、《Angew. Chem. Int. Ed.》、《Sci. China Chem.》、《Chin. J. Chem.》、《Org. Lett.》、《Chem. Commun.》等业界公认的国际重要科技期刊发表学术论文20余篇。
倪绍飞 博士

倪绍飞博士2020年入职汕头大学化学化工学院。2019年于西班牙加泰罗尼亚化学研究所(ICIQ)获得博士学位(导师:Prof. Feliu Maseras),期间获欧盟Erasmus+奖学金项目资助,赴瑞典斯德哥尔摩大学学习(导师:Prof. Fahmi Himo)。2020年在德国哥廷根大学从事博士后研究工作(合作导师:Prof. Lutz Ackermann)。2023年加入日本京都大学iCeMs研究所任特聘研究员(合作导师:Prof. Shigeyoshi Sakaki)。主要从事计算化学,包括计算有机化学、金属有机化学、催化反应机理及发光材料的光激发电子跃迁机理等领域的研究,目前以通讯作者或第一作者在《Coord. Chem. Rev.》、《Angew. Chem. Int. Ed.》、《Nat. Commun.》、《CCS Chem.》、《Adv. Funct. Mater.》、《ACS Catal.》等国际知名期刊发表学术论文50余篇。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号