西南大学秦绪荣Sci. Adv.:钴催化非对映选择性氢化合成非天然芳基丙氨酸多肽
非天然芳基丙氨酸多肽在材料科学、化学生物学和药物化学等多个研究领域中应用广泛。尤其是近年来,科学家们对治疗肽的兴趣日益增长,已经有80多种多肽药物获得批准上市,170种多肽正在进行临床试验,500多种多肽则处于临床前研究阶段。与天然肽类药物相比,含非天然氨基酸残基的非天然肽类药物具有优异的蛋白水解稳定性、生物活性和药代动力学特性。因此,开发含有非天然芳基氨基酸残基的非天然肽具有重要的学术意义和临床应用价值。
目前,通过偶联试剂介导的非天然芳基丙氨酸脱水缩合是一种被广泛采用的多肽合成方法。然而,这种方法存在一些局限性,如非天然芳基丙氨酸的制备步骤繁琐、原子经济性差、副反应较多,以及偶联试剂对羧基的过度活化可能导致α-立体中心外消旋化。近年来,一些新的策略取得了一定的进展,包括过渡金属催化芳基卤化物和AlaM试剂的交叉偶联反应(图1A),Pd催化L-丙氨酸多肽衍生物的C-H芳基化反应(图1B)以及Rh催化多肽脱氢丙氨酸残基的加氢芳基化反应(图1C)。这些策略引入的非天然芳基丙氨酸残基的构型绝大部分为L构型,而对于构建高光学纯度的D构型非天然芳基丙氨酸多肽仍然面临巨大挑战。
值得一提的是,过渡金属催化以氢气为氢源的脱氢多肽不对称氢化策略虽有零星报道,但该策略需要使用高压危险的氢气,底物仅适用于二肽且非对应选择性较差(图1D)。最近,西南大学秦绪荣教授、任巧副教授课题组以廉价的过渡金属钴盐为催化剂,醋酸和甲醇为氢源,成功地以高产率和高非对映选择性构建了非天然芳基丙氨酸多肽分子库。该反应避免了危险高压氢气的使用,采用了极性反转策略,利用醋酸和甲醇作为氢源,省去了预先合成非天然芳基丙氨酸的冗长步骤。在反应过程中,产物不会发生外消旋化或差向异构化(图1E)。相关成果近期发表在Science Advances 上。

图1. 课题设计思路
获得最佳反应条件后,作者对脱氢多肽底物范围进行了拓展(图2-4),涵盖了芳基丙氨酸类型、氨基酸序列和肽链长度等方面。通过X-射线单晶衍射分析确定氢化产物2ab的绝对构型,证实引入的手性中心为R构型。
首先,作者对二肽底物进行了拓展(图2)。结果表明各种脱氢二肽都可以顺利氢化,以61%-94%的产率和最高97:3的e.r.值或98:2的dr值得到相应的氢化产物。底物芳环上含有供电子基团或吸电子基团(2q-2z)都不受影响;温和的反应条件对烷基、芳基、酯基、酰胺、甲氧基、三氟甲基、氟、硫甲基、羟基、氨基、Boc和Fmoc等基团都可以兼容。此外,在亲水侧链方面,丝氨酸和苏氨酸的羟基以及色氨酸的氨基在该体系中能够耐受;而天冬氨酸和谷氨酸的羧基、半胱氨酸的巯基、组氨酸的氨基、赖氨酸的氨基和酪氨酸的羟基需要预先保护才能够耐受。值得注意的是,当大位阻的脯氨酸被引入脱氢二肽中时,反应产率会显著下降。
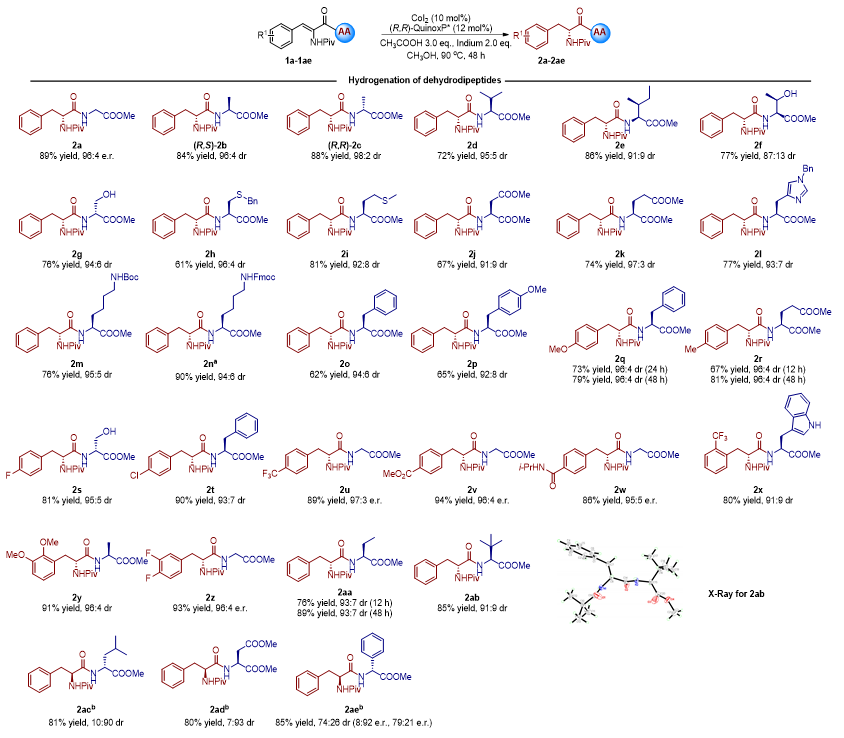
图2. 二肽底物拓展
其次,作者对三肽底物范围进行了拓展(图3)。首先考察了脱氢三肽3a,其氨基酸残基序列为dehydro-Phe-Gly-Gly。在最优条件下,3a能够被氢化,以69%的产率和93:7的e.r.值得到氢化产物4a。在此基础上,作者研究了脱氢三肽的氨基酸残基序列对氢化过程的影响。结果表明,将3a氨基酸残基的C端替换为Ala、Val、Ile、Asp、Met、Phe、Trp、Abu、D-Leu以及D-Phg不会影响氢化循环(4b-4l,4t);另外,将3a的第二个氨基酸残基替换为Ala、D-Ala、Ile以及D-Phe也不会产生显著影响,仍然以中等至优秀的产率和优秀的dr值得到相应的氢化产物(4m-4s,4u-4w)。除了N端为脱氢苯丙氨酸残基的三肽外,脱氢4-异丙基-苯丙氨酸残基(3l)、脱氢3-(1-萘基)-丙氨酸残基(3q)以及脱氢3-甲基-苯丙氨酸残基(3r)也适用于该氢化反应体系,显著拓展了底物的范围。Sevadicin是一种由蜜蜂病原菌幼虫类芽孢杆菌产生的新型非核糖体合成肽,对巨大芽孢杆菌具有抗菌活性。利用该不对称氢化策略,以87%的产率和95:5的dr值得到了Sevadicin的类似物4s;类似地,以优秀的产率和dr值得到了4s的三个非对映异构体,分别为4n(D-Phe-Ala-Trp)、4u(Phe-Ala-Trp)以及4v(Phe-D-Ala-Trp)。当脱氢氨基酸残基位于中间时,虽然可以获得氢化产物,但只能得到中等的e.r.值或dr值(4x-4y)。
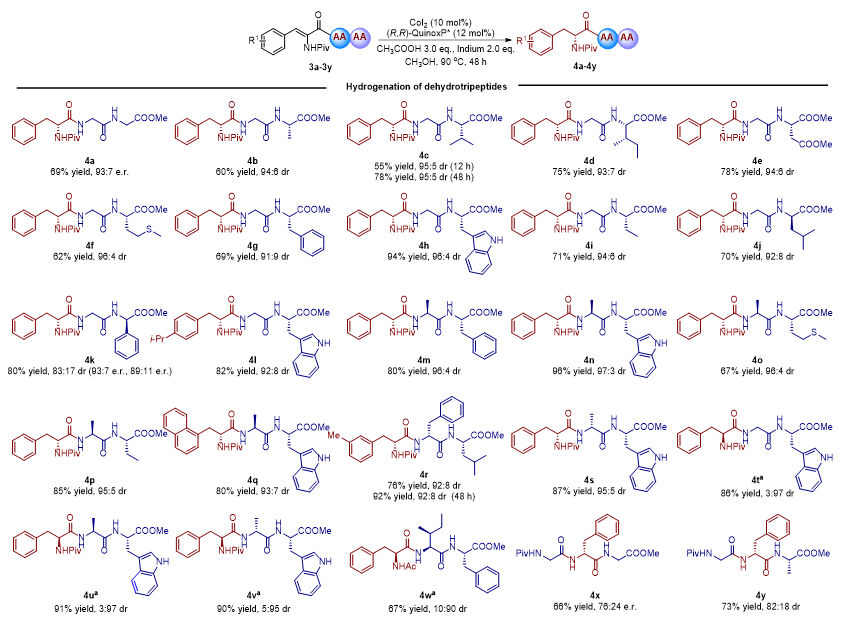
图3. 三肽底物拓展
最后,作者对拥有更长氨基酸残基序列的脱氢四肽和脱氢五肽进行了考察(图4)。更长的肽链意味着更复杂的二级结构及氢键网络、更多的活性官能团、更多的酰胺键以及更多的手性中心,对氢化反应来说无疑意味着更大的挑战;产物的大极性对分离纯化也是一个挑战。基于此,作者合成了8种脱氢四肽以及两种脱氢五肽。幸运的是,脱氢四肽可以顺利地进行不对称氢化以中等至优秀的产率和优秀的dr值得到相应的氢化产物。其中,5a含有大位阻的Pro残基,将其移到C端后对氢化循环不产生影响;5b、5c、5h中含有非天然氨基酸残基D-Leu或D-Ala,也不会影响氢化结果,说明长肽中的手性中心对氢化反应依然不产生显著影响。对于脱氢五肽5i和5j,提高催化剂和配体的载量可以显著提高它们的反应性,有利于底物的完全消耗和氢化产物的分离纯化。而且,该催化不对称氢化体系对脱氢五肽进行不对称氢化依然具有很高的非对映选择性。
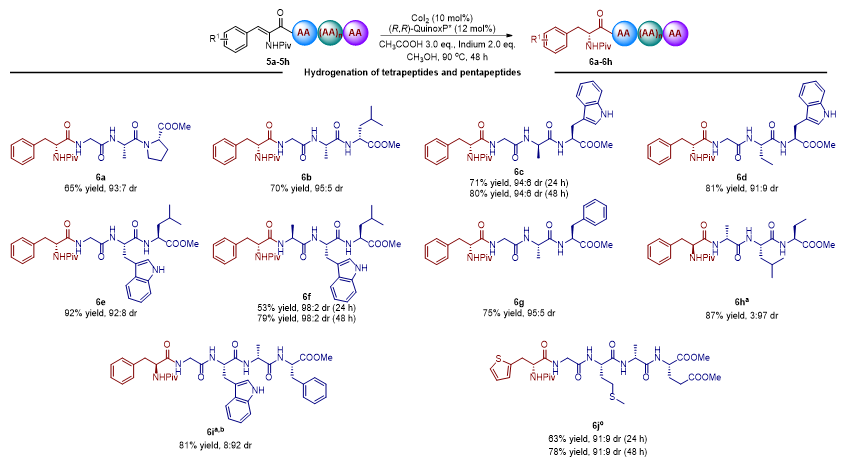
图4. 四肽和五肽底物拓展
在完成底物范围的拓展后,研究人员进一步探索了该策略在合成应用方面的潜力,包括对天然产物和药物分子的后期衍生化修饰、药物分子关键中间体的合成以及生物活性研究,从而进一步证明了其广泛的应用前景(图5-6)。
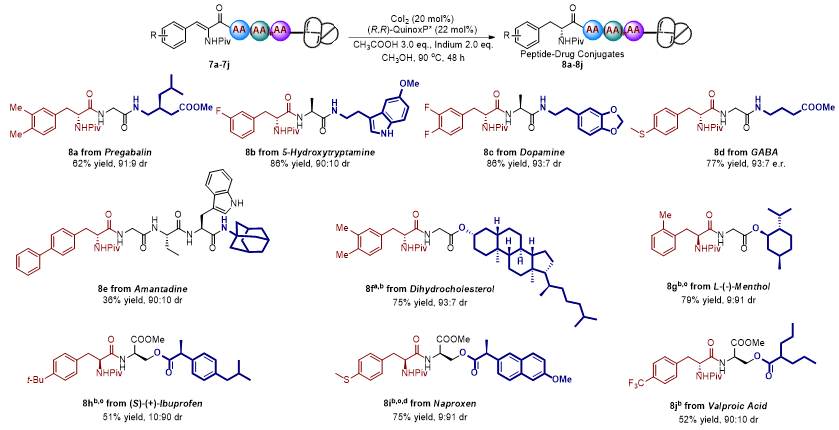
图5. 多肽-偶联药物合成
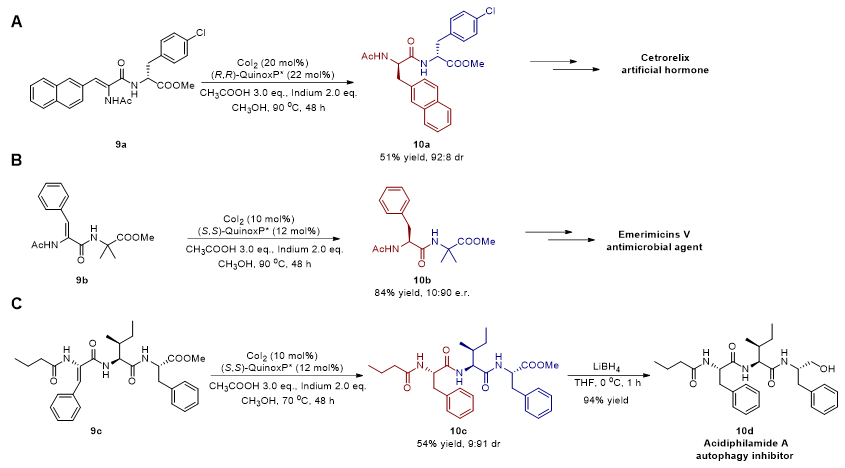
图6. 多肽药物关键中间体的合成
该研究能够简洁、高效地构筑含有普瑞巴林、5-羟色胺、多巴胺、γ-氨基丁酸、1-金刚烷胺、二氢胆固醇、薄荷醇、布洛芬、萘普生和丙戊酸等药物分子的多肽偶联药物(图5)。同时,利用该不对称氢化策略,成功合成了阻断促性腺激素释放激素药物西曲瑞克、具有抗菌活性的药物Emerimicins V、抑制Hela细胞自噬作用药物Acidiphilamide A的关键中间体(图6)。此外,对合成的非天然多肽进行了体外抗肿瘤活性研究,结果显示,4q针对非小细胞肺癌细胞株PC-9OR2具有较强的体外抗肿瘤活性,其IC50达到7.7 µM。
紧接着,作者进行了一系列机理探究实验。首先,为了研究催化剂和底物对氢化过程中新形成手性中心的诱导影响,作者进行了几组对照氢化实验(图7)。首先,合成了脱氢二肽1b(dehydro-Phe-L-Ala)和1c(dehydro-Phe-D-Ala),并分别采用(R,R)-QuinoxP*为手性配体进行不对称氢化。结果显示,1b和1c均高效地实现了转化,以高产率和高dr值分别得到了一对非对映异构体(R,S)-2b和(R,R)-2c;其次,对脱氢二肽1j(dehydro-Phe-Asp),分别使用(R,R)-QuinoxP*和(S,S)-QuinoxP*作为手性配体进行不对称氢化,分别得到了2j(D-Phe-Asp)和2ad(Phe-Asp);再次,利用不同序列的脱氢三肽与不同手性配体的配伍组合,都可以以优秀的产率和优秀的dr值得到了相应的氢化多肽,得到了Sevadicin的类似物4s(D-Phe-D-Ala-Trp)及其3种非对映异构体4n(D-Phe-Ala-Trp)、4u(Phe-Ala-Trp)以及4v(Phe-D-Ala-Trp)。这些结果表明:手性配体对于新形成手性中心的立体构型控制起到决定性作用;多肽侧链主要是第二个氨基酸残基由于位阻效应对手性配体的立体构型控制能力会产生小程度的影响;由于多肽骨架的灵活性以及与反应中心足够远的距离,更远端的氨基酸残基对氢化循环的进行几乎不产生影响,即便是大位阻的Pro残基也影响较小。
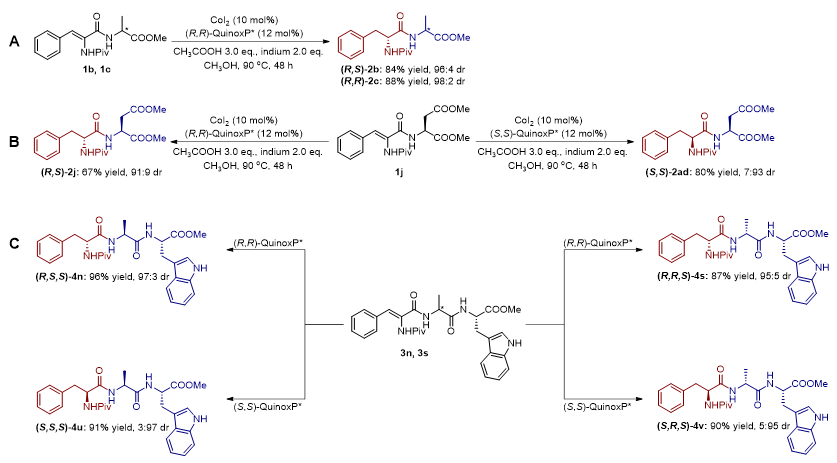
图7. 对照氢化实验
接下来,作者进行了取代基控制实验(图8A)。将1a的NHPiv换为NHAc(1af)后,可以顺利地得到氢化产物2af,但对映选择性有所降低;将1a的NHPiv换为NHBoc(1ai)后,产率显著降低且只能得到中等的e.r.值;将1a的NHPiv换为NHCbz,NHFmoc后只能监测到痕量的产物;将1a的NHPiv换为H,CN,NHCOCF3,NHTs和NBn2后未监测到产物生成;将1a的NHPiv换为NHNs后只能得到复杂的混合物,可能是因为硝基也发生了还原。这些结果表明N端的NHPiv基团与钴中心的配位对反应性和立体选择性的控制起着至关重要的作用。
接着,通过使用当量零价钴前体(R,R)-QuinoxP*Co0 (COD) 进行的控制实验未监测到氢化产物的生成(图8B),说明零价钴可能不是催化循环中的活性中间体。另外,通过UV-Vis实验(图8C),作者发现在反应过程中未监测到0价钴和2价钴信号的产生。然后,利用HRMS,作者监测到了1价钴中间体[(R,R)-QuinoxP*CoI]+ 和三价钴中间体[(R,R)-QuinoxP*CoIIIHOAc]+。这些结果都支持CoI/CoIII循环的催化反应机理。最后,利用氘标记试验,作者确定了醋酸和甲醇的质子氢共同构成了催化循环的氢源。加氢过程是一个顺式加氢的过程。
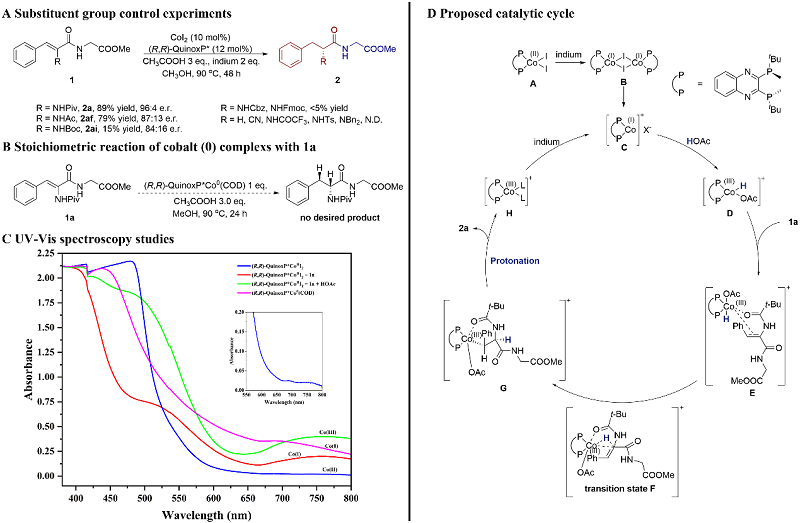
图8. 反应机理研究
基于实验结果和文献调研,作者提出了一种可能的CoI/CoIII催化循环机理(图9D)。循环初始,CoI2与双齿膦配体(R,R)-QuinoxP*配位后被In还原为I价钴前体B;I价钴化合物C被醋酸可逆地加成后得到III价钴氢化合物D;脱氢多肽1a与III价钴氢化合物D结合后激活双键得到中间体E;中间体E经过过渡态F得到α位单氢化的C-Co中间体G;C-Co中间体G发生原位质子化释放出氢化产物2a和中间体H;中间体H被In还原再生为I价钴前体B完成催化循环。
综上所述,作者利用廉价的过渡金属钴盐作为催化剂、醋酸和甲醇作为氢源,以高产率和高非对映选择性构建了非天然芳基丙氨酸多肽分子库。该反应避免了使用危险的高压氢气,而是采用了极性反转策略,利用醋酸和甲醇作为氢源。该方法省去了预先合成非天然芳基丙氨酸的冗长步骤,且在反应过程中产物不会发生外消旋化或差向异构化。此外,通过该反应在多种手性天然产物和药物骨架的后期功能化和合成关键中间体中展示了该反应的应用价值。通过进行氘标记实验、对照实验、HRMS鉴定和UV-Vis光谱研究等机理研究,作者提出了的CoI/CoIII催化循环。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Expedient and divergent synthesis of unnatural peptides through cobalt-catalyzed diastereoselective umpolung hydrogenation
Xinjian Song, Shuangyi Bai, Yuan Li, Tong Yi, Xinyu Long, Qinghua Pu, Ting Dang, Mengjie Ma, Qiao Ren*, Xurong Qin*
Sci. Adv., 2023, DOI: 10.1126/sciadv.adk4950
导师介绍
秦绪荣
https://www.x-mol.com/university/faculty/360129
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号