南大黄小强/梁勇/中科大田长麟团队合作Nature:光酶协同催化实现不对称自由基酰基化
作为当下中美大国竞争的焦点领域,生物制造是变革工业可持续发展最有希望的绿色技术之一。然而,生物制造的“芯片”——酶的催化功能相对有限、我国在核心酶方面的自主率低等问题,成为了限制生物制造未来的“卡脖子”问题。Arnold、Reetz等为代表的酶催化先驱,开发了定向进化、蛋白多样化、人工酶构建以及机器学习等多种策略,扩展了酶的催化功能 [1]。将酶催化和光催化结合的光酶催化,融合了可见光化学多样的反应性和酶的高选择性,成为开发新酶功能最前沿的策略 [2]。近年来,烟酰胺依赖酶、黄素依赖酶、非天然氨基酸插入的人工光酶以及磷酸吡哆醛依赖酶与可见光化学的结合,向人们展示了光酶催化生物合成的原始创新在于创制新酶元件、解决传统合成面临的问题。
南京大学黄小强课题组一直致力于将化学与生物学相融合,以实现新酶元件的创制和新分子生化体系的开发(前期工作:Nat Catal., 2023, 6, 996–1004, 点击阅读详细)。近日,黄小强课题组联合南京大学梁勇课题组、中国科学技术大学/中国科学院强磁场科学中心田长麟课题组开发了一种焦磷酸硫胺素(ThDP)依赖酶和有机光敏剂Eosin Y协同催化的体系(图1),将苯甲醛裂解酶“重塑”为光驱动的自由基酰基转移酶(RAT),进而实现了一例高对映选择性的自由基-自由基交叉偶联反应。
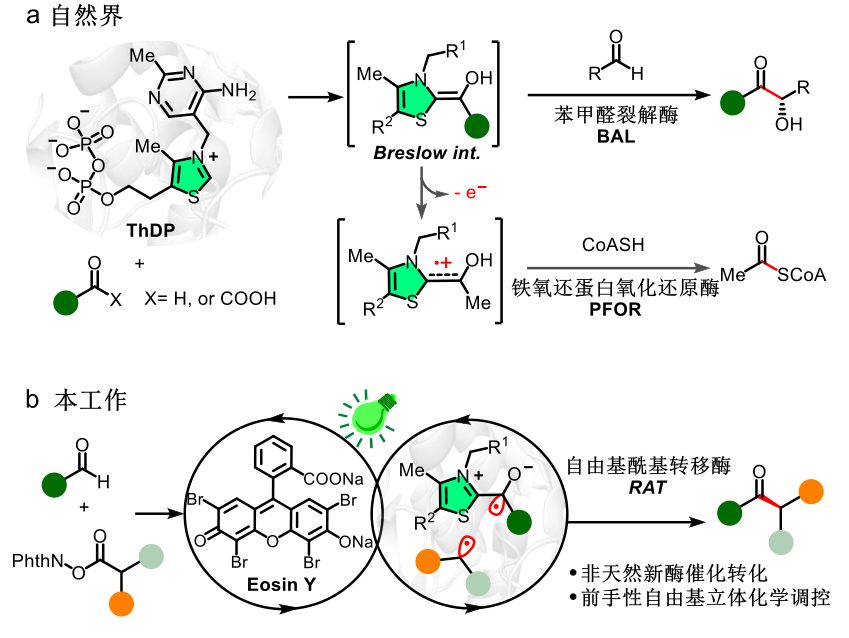
图1. 将裂解酶转化为自由基酰基转移酶的设计思路。图片来源:Nature
ThDP依赖酶广泛存在于生物体中,催化C-C、C-N、C-S、C-O键的形成和裂解。其中催化形成C-C键的裂解酶的研究最为广泛,其通常以苯甲醛、苯甲酰甲酸等为酰基供体,在酶口袋内与ThDP形成Breslow中间体,进而进攻另一分子的受体,生成具有高度立体选择性的α-羟基酮类产物(图1a)。此外,ThDP依赖的铁氧还蛋白氧化还原酶(PFOR)在厌氧条件下催化乙酰辅酶A的生物合成(图1a),后来科学家证明这一生物转化经历了单电子氧化的过程 [3]。但是,ThDP依赖酶催化的非天然不对称自由基转化尚未见报道。
自1958年Breslow提出NHC催化机制后 [4],合成化学家们开发了一系列仿生氮杂环卡宾(NHCs)配体和有机催化剂。近年来,随着自由基化学的发展,又打开了NHC催化的自由基化学新方向 [5]。然而,由于前手性自由基的立体化学控制非常具有挑战性,NHC催化的不对称自由基转化,仍然面临着催化剂负载量大和选择性不佳等问题。
黄小强课题组基于化学模拟(chemomimetic)的思路,融合化学中NHC催化的单电子过程和ThDP依赖酶催化,开发了光和ThDP依赖酶协同催化的不对称生物合成新模式,将酶的催化功能扩展至自由基-自由基交叉偶联的同时,利用定向进化改造ThDP依赖酶,实现了有机NHC不能达到的低催化剂负载量和高立体选择性。
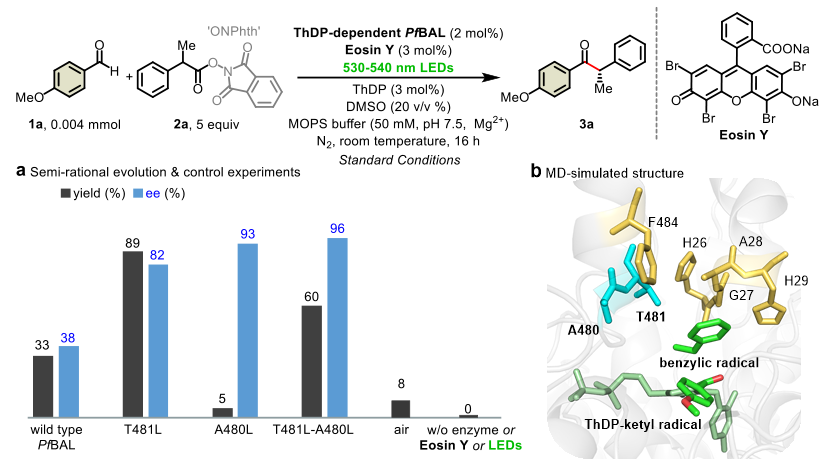
图2. 模板反应、控制实验及定向进化。图片来源:Nature
作者选取4-甲氧基苯甲醛1a和自由基前体氧化还原活性酯2a作为模板底物,在含有ThDP和Mg2+的MOPS缓冲液中,以Eosin Y为光敏剂在530-540 nm绿光照射下,测试了9种ThDP依赖酶,仅有来自荧光假单胞菌的苯甲醛裂解酶PfBAL给出33%的产率和38%的 (S) 构型选择性。为提高反应收率和立体选择性,作者通过分子动力学模拟,理性选择7个关键位点做后续突变(图2b)。基于聚焦理性迭代位点特异性突变(FRISM)策略将这7个位点分别突变为A/L/F或W等氨基酸。经历两轮迭代突变和反应条件的筛选,获得最佳突变体T481L_A480L,能以60%的收率和96%的ee值催化模板反应(图2a)。控制实验表明,PfBAL酶,光敏剂Eosin Y和光照都是该催化体系的必不可少的关键因素。
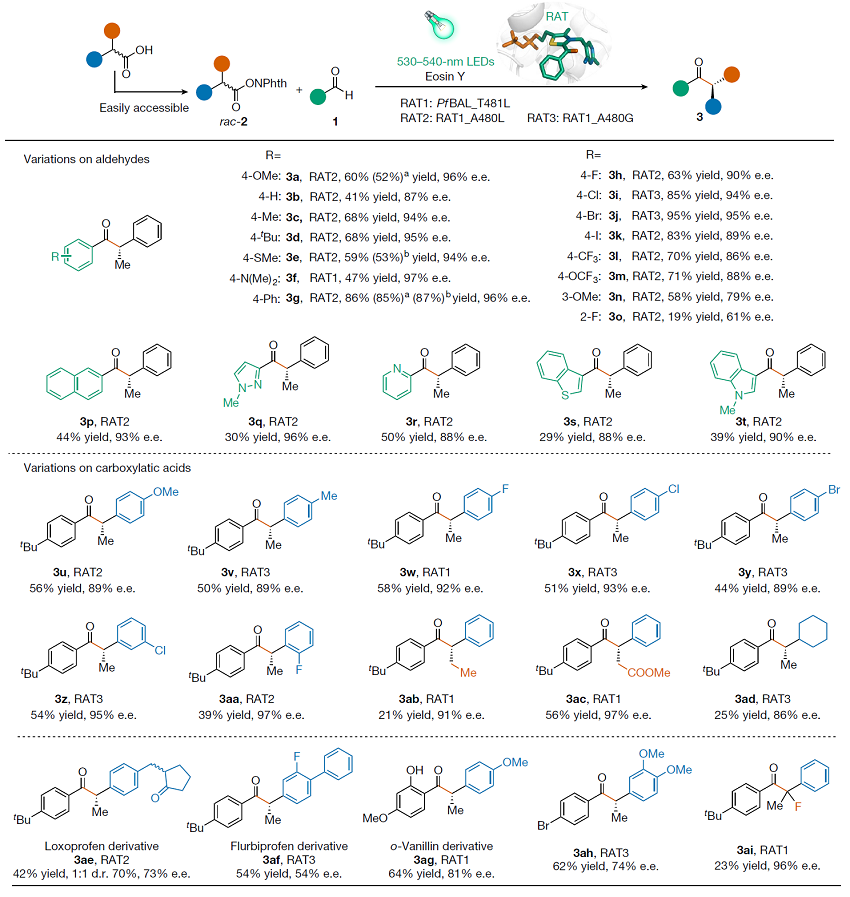
图3. 底物谱拓展。图片来源:Nature
在筛选到最佳的反应条件和最优的突变体后,作者对该双催化体系的底物耐受性进行了考察。结果表明,该催化体系具有良好的底物适用范围和官能团耐受性(图3)。带有给电子基和吸电子基的芳香醛、邻位和对位取代的芳香醛、杂环的芳香醛以及多种取代基的羧酸衍生物都能顺利发生反应(35例,最高达97% ee)。同时,该反应可以以相似的效率和相同的对映选择性放大到1 mmol级别。经过X-射线单晶衍射确定自由基酰基转移酶RAT催化的产物的绝对构型为S构型。
随后,作者对该双催化体系提出以下的机理假设(图4a):首先底物醛与ThDP在苯甲醛裂解酶PfBAL口袋中形成Breslow中间体(Int. A),被激发态的有机光敏剂Eosin Y*选择性单电子氧化为ketyl自由基(Int. B),自身被还原成Eosin Y•–,还原态的光敏剂Eosin Y•– 将氧化还原活性酯的自由基前体单电子还原形成前手性自由基(Int. C),还原态的Eosin Y•–重新回到基态。Int. B和Int. C在蛋白口袋内通过自由基交叉偶联实现一系列手性酮类产物的高效合成。
随后,作者设计了一系列的机理实验来探究该催化体系的机理,包括:(1)TEMPO捕获实验支持反应体系中自由基中间体Int. B和Int. C的形成(图4b);(2)分别以 (R) 和 (S) 构型的萘普生衍生物作为自由基前体,使用相同酶,均能以相似的收率和相似的ee值得到同一构型的产物,支持了该催化过程中经历了自由基过程(图4c);(3)低温电子顺磁共振(EPR)实验和EPR自旋捕获实验证实了该反应体系中自由基中间体Int. B和Int. C的形成,以及形成自由基中间体的必要条件(图4d-e)。
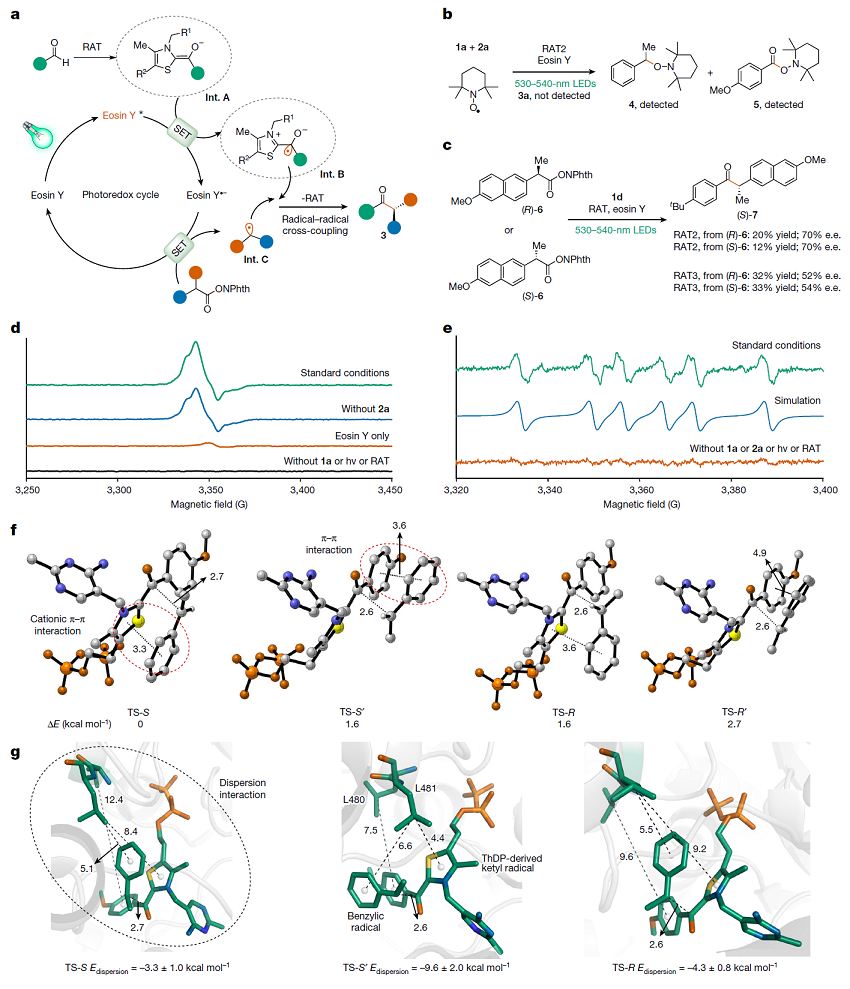
图4. 机理推测与机理探究。图片来源:Nature
为更好地解释该催化过程的立体选择性,作者借助了密度泛函理论(DFT)和分子动力学模拟(MD)等方法。DFT计算结果表明,Int. B和Int. C的交叉偶联有四种不同的过渡态构象(TS-R、TS-R'、TS-S 和 TS-S')(图4f)。在这四种过渡态构象中,既有阳离子π-π相互作用,也有π-π相互作用。与 TS-R 和 TS-R' 相比,过渡态 (S) 构型的能量略低,这意味着在蛋白口袋中 (S) 产物的形成会更有利。在MD模拟中,作者发现TS-R'在酶口袋中并不稳定,会最终转化为较稳定的TS-R。因此,作者只分析了突变后的氨基酸残基(L480 和 L481)与三种过渡态 TS-S、TS-S' 和 TS-R 之间的距离(图4g)。尽管L481与苄基很近,但是只有TS-S'最接近Int. B的阳离子噻唑环(4.4 Å vs 8.4和9.2 Å)。此外,在 TS-S'中,L480 与Int. B中4-甲氧基苯甲醛的苯环之间的距离最短。这表明过渡态 TS-S' 和突变的氨基酸之间存在最强的色散相互作用(- 9.6 kcal/mol)。作者使用DFT和MD模拟等方法,解释了该催化过程中为什么会有S构型选择性。
小结
作者开发了一种结合ThDP依赖酶催化和有机光敏剂Eosin Y催化的双催化体系。该双催化体系是一种全新的光酶催化模式,在该催化体系中天然的苯甲醛裂解酶变身为光驱动的自由基酰基转移酶,突破了天然酶的催化功能、实现了手性氮杂环卡宾难以实现的前手性自由基的优异立体化学控制。
相关论文发表于Nature。论文的理论计算部分由南京大学梁勇课题组完成,电子顺磁共振实验部分由中国科学技术大学/中国科学院强磁场科学中心田长麟课题组完成,其余部分由南京大学黄小强课题组完成。南京大学化学化工学院博士研究生许园园、南京大学化学化工学院特任副研究员陈红威和中国科学院强磁场科学中心于璐副研究员为论文的共同第一作者。黄小强特聘研究员、梁勇教授和田长麟教授为论文的共同通讯作者。该工作得到了南京大学启动经费、科技部重点研发计划(2022YFA0913000, 2019YFA0405600)、国家自然科学基金(21825703, 21927814, 22277053)、江苏省自然科学基金(BK20220760, BK20230018)等项目的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A light-driven enzymatic enantioselective radical acylation
Yuanyuan Xu, Hongwei Chen, Lu Yu, Xichao Peng, Jiawei Zhang, Zhongqiu Xing, Yuyan Bao, Aokun Liu, Yue Zhao, Changlin Tian, Yong Liang & Xiaoqiang Huang
Nature, 2023, DOI: 10.1038/s41586-023-06822-x
参考文献:
[1] Chen, K. & Arnold, F. H. Engineering new catalytic activities in enzymes. Nat. Catal. 3, 203-213 (2020).
[2] (a) Emmanuel, M. A. et al. Photobiocatalytic strategies for organic synthesis. Chem. Rev. 123, 5459-5520 (2023). (b) 明阳, 陈彬 & 黄小强. 光酶催化合成进展. 合成生物学 4, 651-675, (2023).
[3] Chabrière, E. et al. Crystal Structure of the free radical intermediate of pyruvate:ferredoxin oxidoreductase. Science 294, 2559-2563 (2001).
[4] Breslow, R. On the mechanism of thiamine action. IV.1 Evidence from studies on model systems. J. Am. Chem. Soc. 80, 3719-3726 (1958).
[5] Liu, K., Schwenzer, M. & Studer, A. Radical NHC catalysis. ACS Catal. 12, 11984-11999 (2022).
通讯作者简介
黄小强博士,南京大学化学化工学院特聘研究员、国家青年人才(海外)、重点研发计划青年首席;已在Nature (2), Nat. Catal. (3), Nat. Commun., JACS (3), ACIE (2), Acc. Chem. Res. (2)等杂志发表一作/通讯论文多篇。实验室正在招聘生物合成和化学合成方向的博士后、博士研究生,详见课题组主页:https://www.x-mol.com/groups/huang_xiaoqiang
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号