西安交大BEBC李菲课题组Chem. Sci.:细胞外基质刚度依赖的小胶质细胞对炎症信号激活响应的原位表征
小胶质细胞在神经免疫调节和维持中枢神经系统稳定性方面发挥重要作用。近些年,脑部海马区病变备受关注,其病变过程不仅产生大量炎症因子,并伴随细胞外基质刚度的变化,从而从多方面激活小胶质细胞。例如,在阿尔兹海默症、多发性硬化等神经退行性疾病发生发展过程中,细胞微环境中的力学和炎症因素发生显著变化,影响小胶质细胞的免疫调节功能。但目前有关力学和炎症微环境如何联合影响小胶质细胞激活的机制仍不清楚。另外,小胶质细胞的激活常伴随炎症因子释放、氧化还原平衡、呼吸活性和迁移能力等的快速变化。因此,建立模拟正常生理和病理条件下大脑海马区小胶质细胞的力学-炎症微环境模型,原位监测微环境中小胶质细胞状态及早期激活过程中的氧化还原状态、呼吸活性及迁移行为的动态变化,对发现小胶质细胞激活相关神经系统疾病机制具有重要意义。近日,西安交通大学生命科学与技术学院仿生工程与生物力学研究所(BEBC)李菲课题组和徐峰课题组合作开展了针对力学-炎症微环境模型中小胶质细胞的氧化应激水平、呼吸活性、迁移特性等的研究(图1)。相关工作发表在Chemical Science 上。
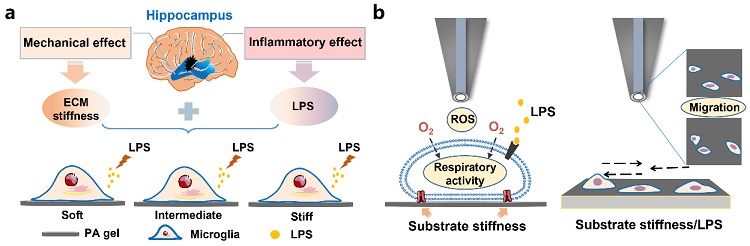
图1.(a)小胶质细胞的力学-炎症微环境模型;(b)应用SECM原位表征力学-炎症微环境下小胶质细胞的氧化状态、呼吸活性及迁移过程的示意图
该工作首先在不同刚度聚丙烯酰胺水凝胶上培养了小鼠的小胶质BV2细胞,构建了模拟正常生理和神经退行性病变等病理条件下海马区基质刚度的小胶质细胞力学微环境模型,并研究了不同基质刚度上小胶质细胞的形态、增殖能力和氧化还原水平。结果发现,伴随基质刚度的增加,小胶质细胞形态的极化程度增强,增殖能力和活性氧物质(ROS)水平升高,证实了硬基质刚度对小胶质细胞迁移、吞噬功能和氧化应激水平的影响。结合免疫荧光和Western blot实验结果,证实基质刚度激活PIEZO1-Ca2+-RAC1-NOX-ROS的炎症通路,引起细胞内氧化还原水平的变化。随后,向小胶质细胞力学微环境模型中进一步加入了脂多糖(LPS),构建了模拟海马区力学-炎症耦合的小胶质细胞微环境模型。结果发现,伴随基质刚度增加和LPS的加入,细胞的NOX2蛋白表达和ROS水平增加,并且TNF-α等炎症因子的表达水平升高,证实在硬基质刚度和LPS的协同作用下小胶质细胞的炎症因子表达最高,表现为过度激活状态(图2)。
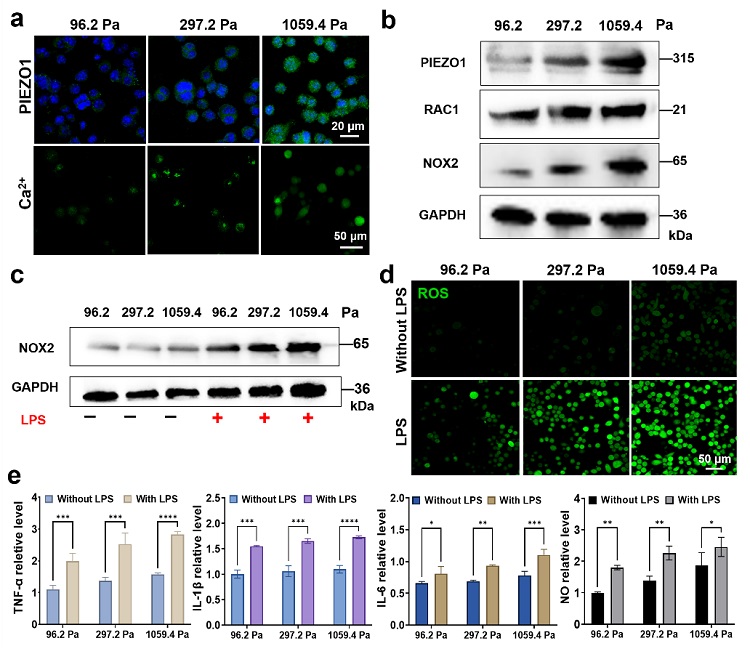
图2. 在不同基质刚度聚丙烯酰胺水凝胶上的小胶质细胞的(a)PIEZO1免疫荧光图和Ca2+水平荧光图;(b)PIEZO1、RAC1、NOX2蛋白表达的Western blot图;基质刚度和LPS协同作用下BV2细胞的(c)NOX2表达的Western blot表征结果、(d)细胞内ROS水平的荧光图、(e)TNF-α、IL-1β、IL-6和NO水平变化结果图。
为探究硬基质上小胶质细胞ROS水平上调的原因,应用荧光标记法联合扫描电化学显微镜(SECM)技术研究了硬基质刚度上小胶质细胞ROS水平的变化。结果表明,使用荧光标记法未能标记到细胞内的ROS信号,但在位于小胶质细胞表面的SECM探针上检测到了H2O2的氧化电流信号,证实小胶质细胞ROS水平上调是由细胞外H2O2水平升高引起。随后,应用SECM表征了不同刚度胶上和LPS处理不同时间后的小胶质细胞H2O2水平的变化,发现硬基质刚度不仅使小胶质细胞外的H2O2水平升高,并对LPS刺激响应最为敏感,加剧了细胞H2O2的产生和自身氧化应激状态的变化(图3)。
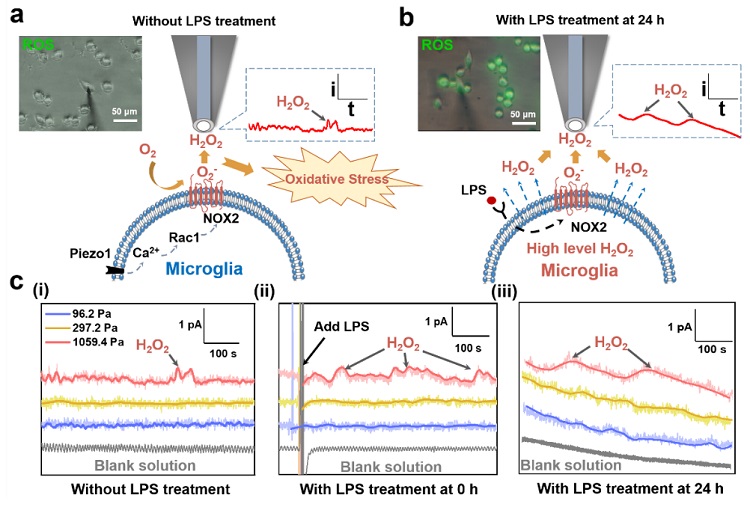
图3. 荧光标记法联合SECM研究硬基质刚度聚丙烯酰胺水凝胶上小胶质细胞在(a)未加入LPS和(b)加入LPS后ROS水平变化的原理示意图;(c)SECM记录不同基质刚度聚丙烯酰胺水凝胶上未加入和加入LPS不同时间的BV2细胞H2O2水平变化的氧化电流-时间曲线。
之后,他们进一步应用SECM原位表征了小胶质细胞呼吸活性的变化。由SECM实验渐远曲线与COMSOL理论模型曲线拟合得到了小胶质细胞表面的氧气浓度数据,发现小胶质细胞周围氧气浓度随基质刚度的增加和LPS的加入而降低,说明硬基质刚度和LPS都可提高小胶质细胞的呼吸活性,并且在硬基质上小胶质细胞受到LPS影响的呼吸活性变化最为明显。最后,考虑激活的小胶质细胞比其静息态具有较强的迁移能力,在清除细胞碎片中积极发挥吞噬作用,应用SECM表征了小胶质细胞在硬基质上的迁移能力,发现硬基质可增强小胶质细胞的迁移能力,迁移距离增加,而LPS的加入提高了小胶质细胞在软底物和中等硬度基底上随机迁移的系数,因此提高了小胶质细胞监测微环境变化的能力(图4)。
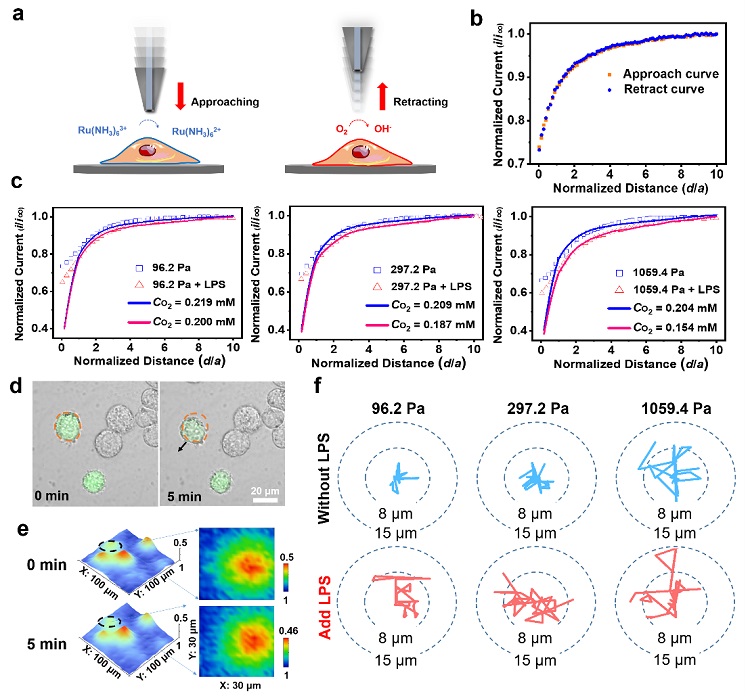
图4. 应用SECM原位监测不同基质刚度聚丙烯酰胺水凝胶上和LPS对BV2细胞呼吸活性和迁移特性的影响。(a)SECM检测原理示意图;(b)SECM渐近曲线和渐远曲线图;不同基质刚度聚丙烯酰胺水凝胶上BV2细胞在加入LPS后的(c)SECM渐远曲线与理论模拟曲线拟合图;硬基质刚度胶上BV2细胞迁移的(d)ROS荧光标记图、(e)SECM实验表征图;(f)在不同基质刚度胶上BV2细胞在加入LPS前后的细胞迁移轨迹风玫瑰图。
该工作首次应用SECM技术实现了力-炎症微环境诱导下小胶质细胞激活过程中的氧化还原状态、呼吸活性和迁移特性的原位表征,并证实了硬细胞外基质上的小胶质细胞通过PIEZO1-Ca2+-RAC1-NOX2 -ROS通路上调了ROS水平,转变为早期激活状态。而早期激活状态的小胶质细胞对LPS更敏感,更易受到炎症微环境的影响而改变其激活状态,产生更多的ROS和炎症因子。并且,小胶质细胞的呼吸活性和迁移能力也随着基质刚度的增加和LPS的加入而增强,证实细胞外基质刚度和LPS对小胶质细胞的激活具有协同作用(图5)。该结有助于理解微环境中小胶质细胞早期激活和过度激活机制,可为临床治疗小胶质细胞激活相关的神经系统疾病提供原位细胞表征数据参考。
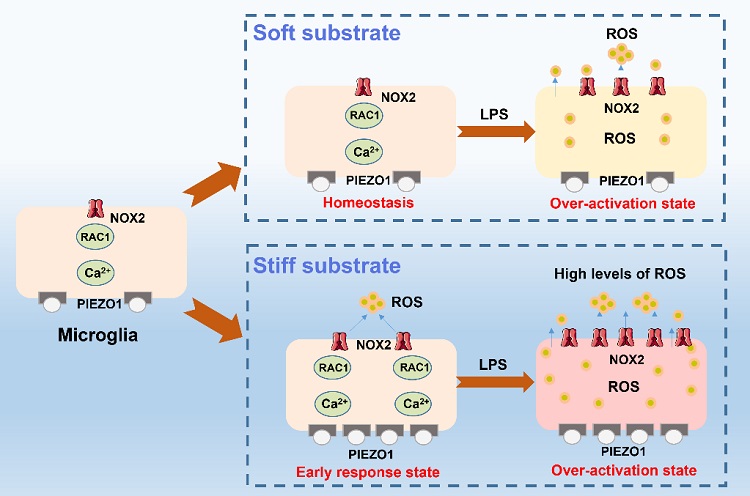
图5. 力学-炎症微环境协同作用对小胶质细胞激活的机制示意图
该工作发表在英国皇家化学会期刊Chemical Science 上,通讯作者为西安交通大学生命科学与技术学院的李菲教授和徐峰教授,文章第一作者是西安交通大学博士研究生刘禹霖,其他作者还包括西安交通大学博士研究生张俊杰、李亚北、赵宇翔,硕士研究生曙阿克•库尔曼巴依、西安交通大学机械学院庄健教授和西安交通大学第一附属医院神经外科张华主任等。该工作也得到美国哈佛仪器公司Frank Wang博士在SECM仪器方面的帮助及国家自然科学基金、陕西省自然科学基金等项目的资助。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Matrix stiffness-dependent microglia activation in response to inflammatory cues: in situ investigation by scanning electrochemical microscopy
Yulin Liu, Junjie Zhang, Yabei Li, Yuxiang Zhao, Shuake Kuermanbayi, Jian Zhuang, Hua Zhang, Feng Xu*, Fei Li*
Chem. Sci., 2023, DOI: 10.1039/D3SC03504B
李菲课题组介绍
李菲教授课题组遵循“生命科学基础问题-电化学扫描探针显微镜平台研制-细胞原位电化学成像与表征”的学术思路,立足于电分析化学方法与技术,结合组织工程学、生物力学、生物学和临床医学等学科,开展疾病相关细胞物理微环境对细胞生化特性的原位电化学成像和细胞界面过程动力学研究,探究细胞微环境与细胞病理学的关系。该工作是李菲教授课题组自心脏和癌症等疾病相关力学微环境对心肌细胞和癌细胞特性影响的研究工作后(J Cell. Phys., 2018, 233(2), 1414; Nano Lett., 2019, 19(9), 5949; Anal. Chem., 2020, 92(7), 4771; Anal. Chem., 2021, 93(14), 5797; Chem. Sci., 2022, 13, 10349; Antioxidants, 2023, 12, 679),将研究体系进一步拓展到神经退行性疾病相关力学微环境对神经细胞功能影响的最新研究成果,可为力医学(mechanical medicine)领域研究提供了细胞原位表征数据和影响机制参考。
李菲课题组主页链接:
http://gr.xjtu.edu.cn/web/feili
https://www.x-mol.com/university/faculty/13704
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号