南京林业大学夏兵Adv. Mater.:锰金属白蛋白激活TLR4信号通路
肿瘤相关巨噬细胞(tumor-associated macrophages, TAMs)具有极高的可塑性,是肿瘤微环境中含量最丰富的免疫细胞,占比高达~50%。肿瘤微环境中细胞因子、趋化因子以及外泌体等可将髓源单核细胞招募到肿瘤组织内,并将其诱导成促肿瘤状态(M2样),进而构成了适宜肿瘤生长和转移的免疫抑制性微环境。因此,深入研究TAMs抗肿瘤极化(M1样)的调控机制,有助于逆转肿瘤免疫抑制性微环境,及改善免疫治疗效果。
南京林业大学夏兵教授领衔的纳米细胞工程研究团队近年来聚焦于纳米免疫调控研究方向,并取得了一系列科研进展。在仿生纳米疫苗(Adv. Mater., 2022, 34, 2108012)和固有免疫调控(ACS Nano, 2023, 17, 1036)等已有工作基础上,该团队近期联合南京大学附属鼓楼医院尹震宇教授以及荷兰格罗宁根大学生物医学工程系Hélder A. Santos教授团队发现:(1)Mn2+离子结合白蛋白分子(Mn@BSA),不再激活传统cGAS-STING,而是启动TLR4相关信号通路。通过激活下游NF-κB、IRF7等转录因子,促进IFN-β、IL-6、TNF-α等细胞因子分泌,实现了实体肿瘤免疫抑制性微环境的有效逆转。(2)Mn@BSA还可通过谷胱甘肽还原组装成纳米线结构,通过巨噬细胞吞噬途径,进一步放大和延长其免疫刺激效应,包括IFN-β、IL-6、TNF-α等细胞因子分泌,以及CD64、CD80、CD86等表达。
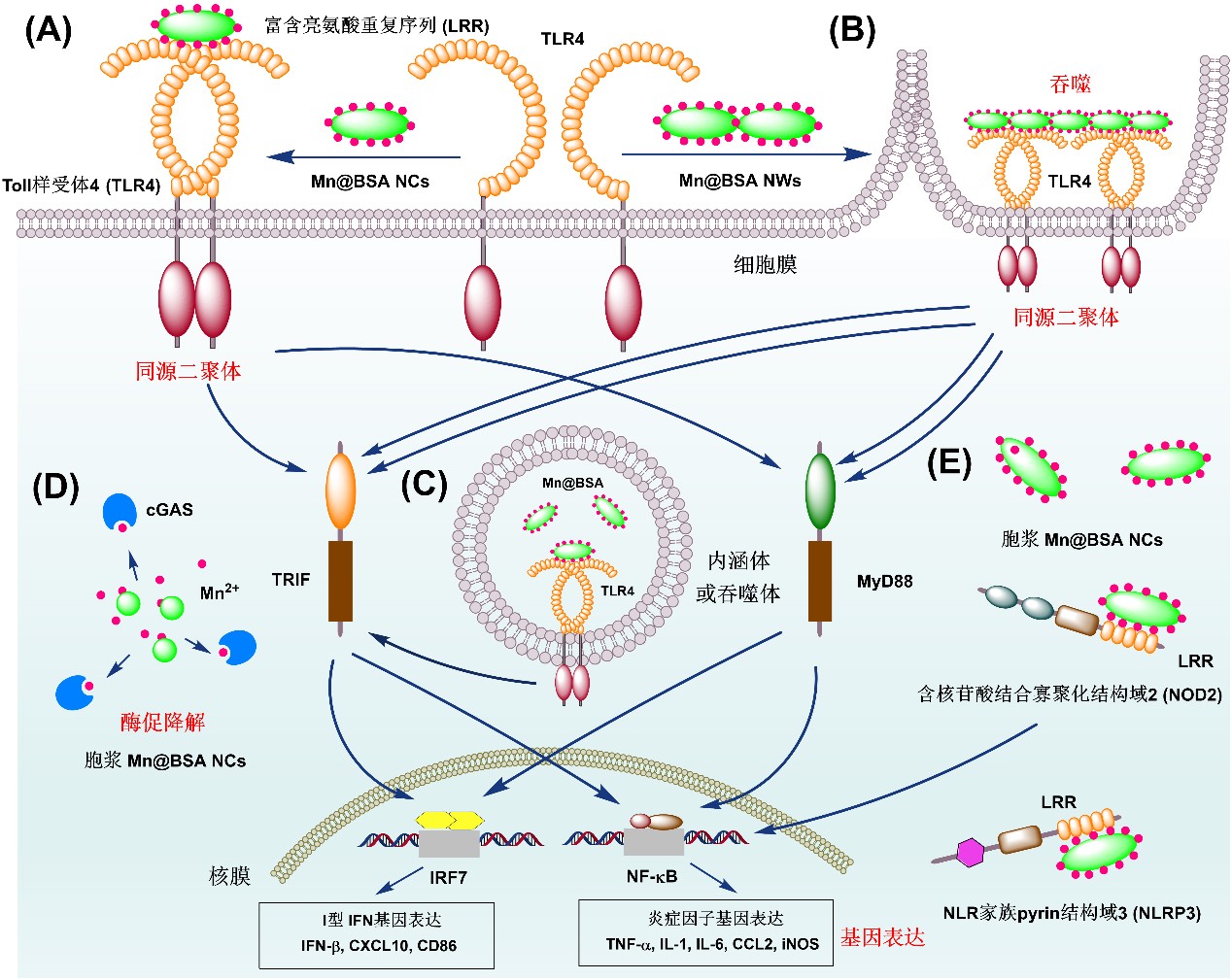
这些结果突出了免疫佐剂的纳米结构在激活机体固有免疫力的重要性,同时为深入理解锰离子免疫调控机制提供了新视角。考虑到合成路线简单、原料价格低廉等特点,因此Mn@BSA等可作为TLR4免疫激动剂具有重要的临床应用价值。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Manganese@Albumin Nanocomplex and Its Assembled Nanowire Activate TLR4-Dependent Signaling Cascades of Macrophages
Shuodan Huang, Yan Gao, Huiying Li, Ruoran Wang, Xiaomei Zhang, Xiaoyu Wang, Di Huang, Linxuan Zhang, Hélder A. Santos, Zhenyu Yin, Bing Xia
Adv. Mater., 2023, DOI: 10.1002/adma.202310979
导师介绍
夏兵
https://www.x-mol.com/university/faculty/175078
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



































 京公网安备 11010802027423号
京公网安备 11010802027423号