中山大学李旸课题组Nat Commun:胶原三螺旋中类肽残基的顺反变构
蛋白质是生命的物质基础,也是生命活动的主要承担者。蛋白质中连接氨基酸残基的结构单元——肽键有两种构型:顺式(cis)和反式(trans)。天然蛋白质中顺式肽键占比极低。倾向顺式肽键的残基通常被认为会破坏蛋白的稳定性。然而,它们对蛋白折叠的影响目前仍未得到充分研究。近日,Nature Communications 发表了中山大学李旸研究员课题组的工作,探究了倾向顺式肽键的模块单元对蛋白质折叠的影响与应用。
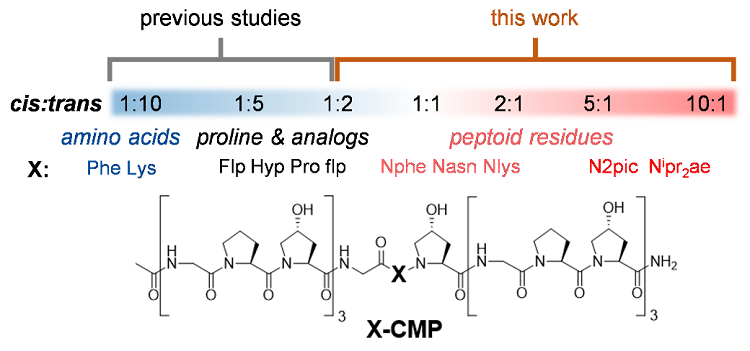
图1. 探究类肽残基的肽键顺反倾向性对胶原三螺旋结构的影响。
他们的研究以细胞外基质的主要成分——胶原蛋白为模型范例。30年来,研究者探究肽键顺反异构化对蛋白质结构的影响主要基于氨基酸和脯氨酸衍生物,但它们都是倾向反式肽键的(见图1蓝色区域),无法揭示真正倾向顺式残基的折叠规律。通过用倾向顺式肽键的类肽(peptoid)残基(即N-取代甘氨酸,N-gly)替换脯氨酸,该团队将肽键顺反倾向性对蛋白折叠的研究扩展了一个数量级(见图1红色区域)。
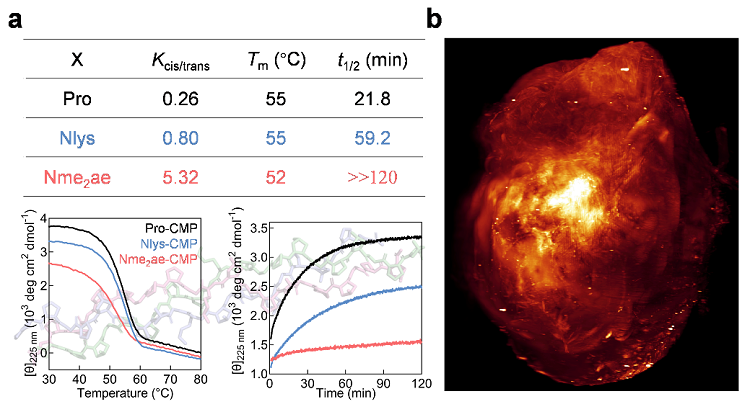
图2. (a) 不同肽键顺反倾向的类肽残基对胶原三螺旋稳定性和折叠速率的影响。(b) 以顺式倾向类肽残基构建的CMP胶原杂交探针可以活体靶向心肌梗死的纤维化病灶。
该研究团队利用不同顺反倾向性的类肽残基替代胶原蛋白模拟肽(CMP)序列中间的脯氨酸后,发现比脯氨酸更倾向顺式的类肽残基也可以稳定胶原三螺旋,但是强烈倾向顺式的类肽残基会大大降低胶原三螺旋的折叠速率(图2a)。圆二色谱、差示扫描量热法和分子动力学模拟研究表明,即便是强烈倾向顺式的类肽残基,也可以促进单链多肽预折叠成多聚脯氨酸II型螺旋结构,降低折叠过程中的熵损耗,从而形成稳定的三螺旋,这说明肽键的顺反异构在胶原三螺旋结构稳定性中并不一定起到主导作用。此外,该团队设计了一种含有强烈倾向顺式类肽残基的CMP探针,它的三螺旋折叠可以通过肽类残基的顺反异构化来控制,并且无需加热解旋成单链就可以活体靶向心肌梗死的纤维化病灶(图2b)。
该研究不仅加深了我们对蛋白折叠中肽键顺反异构化的理解,还为构建具有特定结构和功能的多肽模拟物拓宽了思路。另外,研究人员设计合成的CMP探针为心肌梗死等纤维化疾病提供了新的成像和靶向手段。总之,这项研究为蛋白质工程和药物研发提供了新的策略和方法。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Cis-trans isomerization of peptoid residues in the collagen triple-helix
Rongmao Qiu, Xiaojing Li, Kui Huang, Weizhe Bai, Daoning Zhou, Gang Li, Zhao Qin & Yang Li
Nat. Commun., 2023, 14, 7571. DOI: 10.1038/s41467-023-43469-8
李旸课题组网站:
https://www.x-mol.com/groups/ChemBioCollagen
微信公众号与Bilibili:“胶原三螺旋”
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号