盘点 |FDA 8月批准新药及仿制药
本文获得“药事纵横”授权转载

据FDA官方网站显示,2017年8月FDA共批准了16个新药申请(NDA),2个生物制剂申请(BLA),其中包括4个新分子单体(NME),;55个仿制药申请(ANDA)。以下是批准详情。
一、BLA

BESPONSA(INOTUZUMAB OZOGAMICIN)
2017年8月17日,辉瑞公司(NYSE: PFE)宣布,美国食品药品监督管理局(FDA)批准将BESPONSA®(奥英妥珠单抗)用于治疗成人复发或难治性前体B细胞急性淋巴细胞白血病(ALL)。BESPONSA此前获得美国食品药品监督管理局(FDA)的突破性疗法认证和优先审批资格。
BESPONSA是一种抗体-药物偶联物(ADC),由靶向CD22的单克隆抗体(mAb)与细胞毒制剂偶联。CD22是一种在几乎所有B-ALL患者的癌细胞上表达的细胞表面抗原。当BESPONSA与恶性B细胞的CD22抗原结合时,BESPONSA 内化进入细胞,在此释放细胞毒制剂刺胞霉素杀死癌细胞。BESPONSA 以一小时静脉输注的方式给药,可以在门诊完成对适合患者的给药。
此次批准基于一项3期INO-VATE ALL试验的结果,这是一项随机、开放标签、国际、多中心研究,纳入326例成人复发或难治性B细胞ALL患者,比较了BESPONSA与标准化疗的疗效与安全性。对于采用BESPONSA 治疗的患者,其完全缓解/不完全血象恢复下的完全缓解率为81%,而采用化疗的患者完全缓解率只有29%。同时,接受BESPONSA 治疗的患者其总生存期(OS) 中位数为7.7个月,而接受化疗的患者的这一数字为6.2 个月。
辉瑞肿瘤事业部全球总裁Liz Barrett认为,“BESPONSA的获批对于罹患复发或难治性急性B细胞淋巴细胞白血病的成人患者而言是重要的进步,该病是一种罕见疾病,如不加以治疗可以在短短几个月内致患者死亡。”

CYLTEZO(ADALIMUMAB-ADBM)
8月29日,勃林格殷格翰制药公司宣布其修美乐®生物类似药Cyltezo获得美国食品药品监督管理局批准。该预充针剂型将用于以下多项慢性炎症疾病的治疗:
●中至重度活动期类风湿关节炎
●中至重度多关节型幼年特发性关节炎**
●活动期银屑病关节炎
●活动期强直性脊柱炎(影响脊柱的关节炎)
●中至重度活动期成人克罗恩病
●中至重度活动期溃疡性结肠炎
●中至重度斑块型银屑病
Cyltezo通过皮下注射(40mg / 0.8mL)施用。这是FDA批准的第二个与Humira相似的生物。 Humira是全球第一个上市的抗TNF-α药物,自2002年首次获得FDA批准上市以来,已经累计创造了近1000亿美元的销售收入,而且直到今天还以每年两位数的增幅刷新单只药品的年度销售记录。Humira在2016年的全球销售额是160.78亿美元,今年上半年的销售额是88.34亿美元,预计2017年可以达到180亿美元。
二、NDA
IDHIFA(ENASIDENIB)
2017年8月1日,Idhifa(恩西地平)宣布获FDA批准,用于治疗带有IDH2突变的成人复发性/难治性急性髓性白血病(AML)。而作为首个获批治疗这一特定疾病的新药,Idhifa在获批上市前曾收获了美国FDA颁发的优先审评资格和孤儿药认定。
Idhifa是一种IDH2(异柠檬酸脱氢酶)抑制剂,也是第一个上市的致癌代谢物合成抑制剂,它有别于癌症治疗中的化疗、免疫疗法,属于代谢疗法,即通过降低致癌代谢产物,阻断促进细胞生长的几种酶,从而起到间接抑制肿瘤生长的作用。
在一项开放、单臂、多中心的临床试验中,研究人员招募了199名被诊断为带有IDH2突变的复发性/难治性AML患者。数据表明,Idhifa为这类患者群体带来完全缓解(CR)和部分血液学改善的完全缓解率(CRh)为23%,中位数的缓解持续时间为8.2个月。另外,Idhifa的安全性同样在临床试验中得到了评估。基于它彰显的疗效与安全性,美国FDA比预定日期提早了近1个月批准其上市。
MAVYRET(GLECAPREVIR;PIBRENTASVIR)
FDA于8月3日批准艾伯维旗下 Mavyret(glecaprevir,pibrentasvir)用于治疗没有肝硬化(肝脏疾病)或有轻微肝硬化的慢性丙型肝炎病毒(HCV)基因型 1-6 成年患者,包括有中重度肾病的患者及透析患者。
Mavyret 的安全性及有效性在临床试验期间得到评价,约2300 名无肝硬化或有轻微肝硬化的基因型 1、2、3、5 或 6 HCV 感染成年患者参与研究。试验结果证明,92%-100% 治疗 8 周、12 周或 16 周的患者在完成治疗后的 12 周内其血液中已检测不到病毒,这表明患者的感染已得到治愈。
BENZNIDAZOLE(BENZNIDAZOLE)
FDA加速批准了应用苄硝唑(benznidazole)用于治疗2至12岁患有查加斯病(Chagasdisease)的儿童患者。这是在美国批准的首个治疗查加斯病的药物。 查加斯病,又称美洲锥虫病(Americantrypanosomiasis),是一种由克氏锥虫(Trypanosoma cruzi)引起的寄生虫感染,能够通过不同门路流传。其中包含接触某些昆虫粪便、输血或母婴传布。最新调查显示,在美国大约有30万人患有查加斯病。
苄硝唑是一种硝基咪唑类抗寄生虫药,拥有良好的抗克氏锥虫急性沾染效果。与其余硝基咪唑类化合物一样,苄硝唑的主要作用机制是发生能损坏寄生虫DNA或细胞机制的自由基。在此之前,FDA为苄硝唑颁发了优先审评资格和孤儿药资格。
在与安慰剂对照的两项临床试验中,苄硝唑在6-12岁儿童中的安全性和有效性得到了验证。服用苄硝唑的儿童抗体测试从阳性转为阴性比例为60%,安慰剂组该比例为14%。第二项试验的成果也相似,大约55%服用苄硝唑的儿童抗体测试转为阴性,而安慰剂组只有5%。
VABOMERE(MEROPENEM; VABORBACTAM)
新型抗菌药Vabomere在8月29日获得美国FDA批准,用于治疗患有复杂性尿路感染(cUTI)的患者,其中包括由特定细菌感染引起的肾盂肾炎患者。
Vabomere是一种含有美罗培南(meropenem)和vaborbactam的抗菌药物,其中美罗培南是一种青霉烯抗菌药物,可以抑制细胞壁合成,从而产生杀菌作用;也能渗透大多数革兰氏阳性和革兰氏阴性细菌的细胞壁,以结合青霉素结合蛋白(PBP)靶标。另一种组分vaborbactam是一种β-内酰胺酶抑制剂,它本身没有任何抗菌活性,但是可以保护美罗培南不受某些丝氨酸β-内酰胺酶的降解,比如肺炎克雷伯杆菌碳青霉烯酶(KPC),同时不会降低美罗培南的活性。
FDA基于一项多中心、随机、双盲3期研究结果,做出了批准Vabomere上市的决定。该试验招募了550名成年患者,按1:1的比例随机分成两组,分别接受为期10天的Vabomere静脉注射治疗或标准疗法治疗。试验结果在临床方面(治愈或改善)和微生物根除方面(基线细菌病原体降低至<104 CFU / ml)都是总体上成功的。常见的不良反应包括头痛,注射部位反应和腹泻。

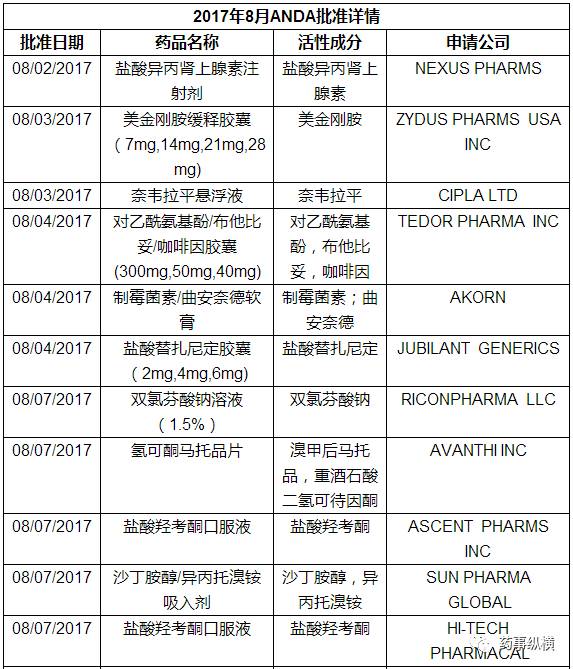
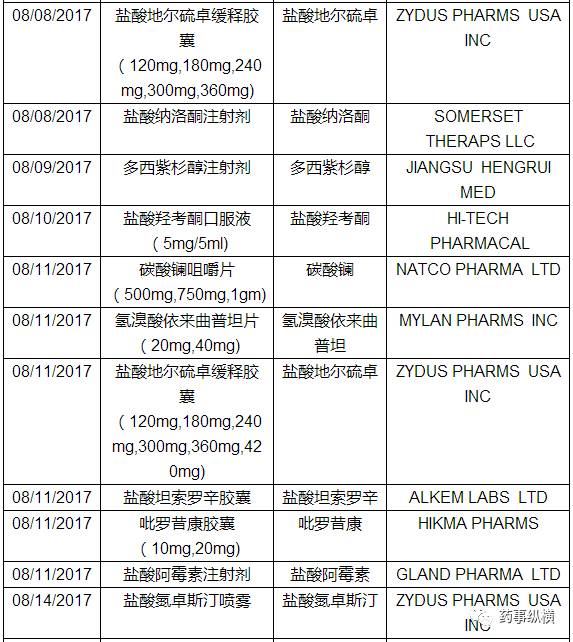
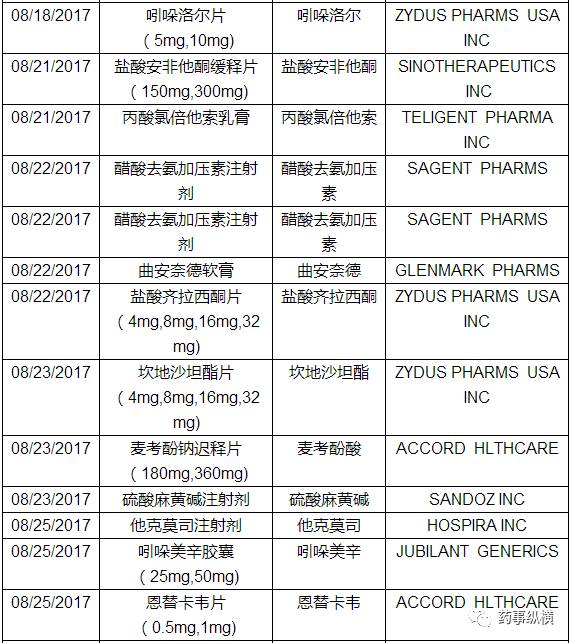
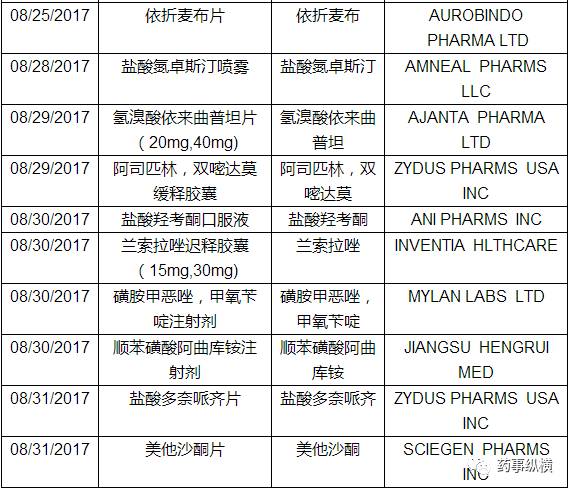
三、仿制药ANDA
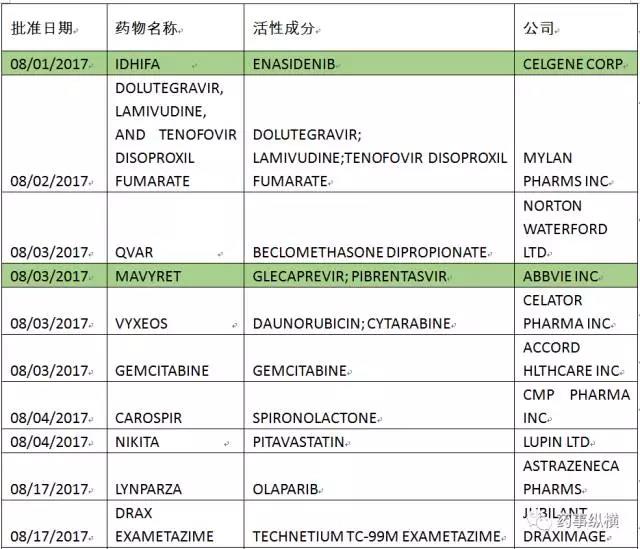
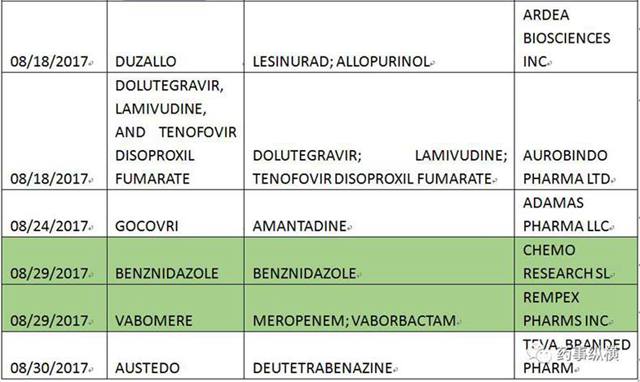
本月FDA共批准了55个仿制药申请(ANDA),以下是ANDA批准列表。

如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号