苏州大学刘庄、上海交大杨宇/韩达:共价LYTAC介导的免疫检查点降解(ICD)疗法
众所周知,肿瘤细胞可以通过利用免疫检查点途径来逃避免疫监视。因此,通过抑制这些检查点蛋白的免疫检查点阻断(ICB)疗法已在癌症免疫疗法中取得了显著的成功。例如,PD-1抗体和PD-L1抗体目前广泛用于诊所治疗不同类型的癌症。然而,目前ICB疗法的客观响应率普遍偏低,只有少数患者(约20%)可以从这种疗法中受益,同时在ICB疗法期间可能会发生不希望的免疫相关副作用(irAEs)。
近年来,科学家揭示了PD-L1的跨膜结构对于促进肿瘤细胞免疫逃逸和生长的重要性。简洁来说,PD-L1的胞外结构域主要具有免疫检查点相关功能,可抑制T细胞对肿瘤细胞的杀伤,而其胞内部分则广泛涉及到与肿瘤细胞增殖等非免疫检查点相关信号通路。因此,下调肿瘤细胞PD-L1,进而抑制其参与的多维度生命活动,可能是比单纯地阻断细胞表面PD-L1 更科学的一个免疫治疗思路。
近年来,蛋白酶体靶向嵌合体(PROTACs)技术已经成为直接敲除细胞质内现有蛋白质的有希望的替代方法。理论上,它们可以标记任何感兴趣的蛋白质(POI)来诱导泛素化级联反应,然后通过蛋白酶体机制降解POI。为了进一步实现对细胞膜及胞外分泌蛋白的特异性降解,Bertozzi小组在2020年首次建立了溶酶体靶向嵌合体(LYTACs)平台,通过将靶向POI的抗体与糖多肽链结合,以结合溶酶体转运受体并将POI运送到溶酶体进行降解。从此,LYTAC领域开始获得关注。目前该领域主要聚焦于新型分子工具的开发和细胞层面的应用,其在生物体内引起的生物学效应和在实际转化中应用前景,仍有待探究。从实际应用角度而言,开发化学制备相对简单、分子识别性能优越、在生物体内稳定性较好且成本相对较低的LYTAC 工具具有重要科学意义。
核酸适体被誉为“化学家的抗体”,相较于蛋白质抗体,其具有序列可编程、化学合成和修饰、化学稳定性好、免疫原性低、靶标广泛和使用成本较低等诸多优点。为了使实现核酸适体在生物体内实现良好且稳定的分子识别性能,在该工作中,苏州大学刘庄教授、上海交通大学杨宇教授和韩达教授等研究者构建了一个高特异性的共价LYTAC用于实现体内高效的PD-L1降解。简洁来说,该共价LYTAC一端可靶向不依赖阳离子的甘露糖6-磷酸受体(CI-M6PR),另一端靶向PD-L1(经叠氮标记);且其PD-L1识别区域修饰的DBCO基团可实现由核酸适体-PDL1相互作用介导的点击反应,即“先识别后反应”的作用顺序,从而实现核酸适体在PDL1上的特异性共价偶联。借由CI-M6PR的高效溶酶体穿梭活性,PD-L1蛋白可被高效且特异性地降解(图1)。研究表明,共价LYTAC介导的PD-L1高效降解不仅能阻断PD-1/PD-L1信号轴,恢复T细胞对肿瘤细胞的杀伤能力,还能直接导致肿瘤细胞的免疫原性凋亡,引起肿瘤特异性免疫反应。作者首次将该治疗策略命名为免疫检查点降解疗法(immune checkpoint degradation therapy, ICD therapy)。相较于ICB抗体疗法,ICD疗法不仅表现出更显著的抑瘤效果,还显示出更低的免疫相关副作用风险,兼具疗效和安全性。此外,共价LYTAC还可以作为一个通用平台,用于特异性降解其他膜蛋白,使其成为未来应用的有前途的工具。该研究提供了一个肿瘤治疗新策略,也提供了一类在复杂环境中有效应用LYTAC的新分子工具,为推动基于DNA的LYTAC药物向应用领域迈进提供了参考。
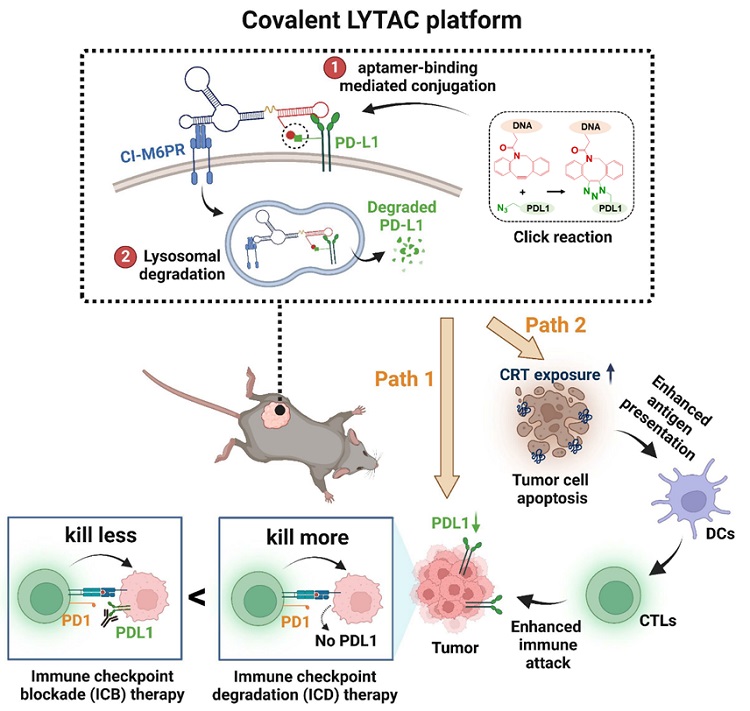
图1. 基于共价LYTAC的免疫检查点降解疗法(ICD therapy)示意图。高效降解肿瘤细胞PD-L1,不仅能阻断PD-1/PD-L1信号轴,还能直接导致肿瘤细胞的免疫原性凋亡,引起肿瘤特异性免疫反应。
简要来说,作者首先在B16F10细胞层面,验证了由DBCO-核酸适体介导的N3-PDL1识别和共价偶联(通过点击反应)。共价LYTAC中CI-M6PR核酸适体的引入,使得PD-L1可被溶酶体高效降解。Western blot数据显示,肿瘤细胞中约62%PD-L1可被共价LYTAC所敲减;相比之下,非共价LYTAC仅下调29%。蛋白质组学分析研究显示,PD-L1降解具有显著的特异性,且基于生物正交反应的共价偶联策略具有生物安全性,不会影响整体蛋白(图2)。此外,他们也通过加入溶酶体抑制剂和使用溶酶体共定位技术,证明了该分子工具降解PD-L1的溶酶体途径。
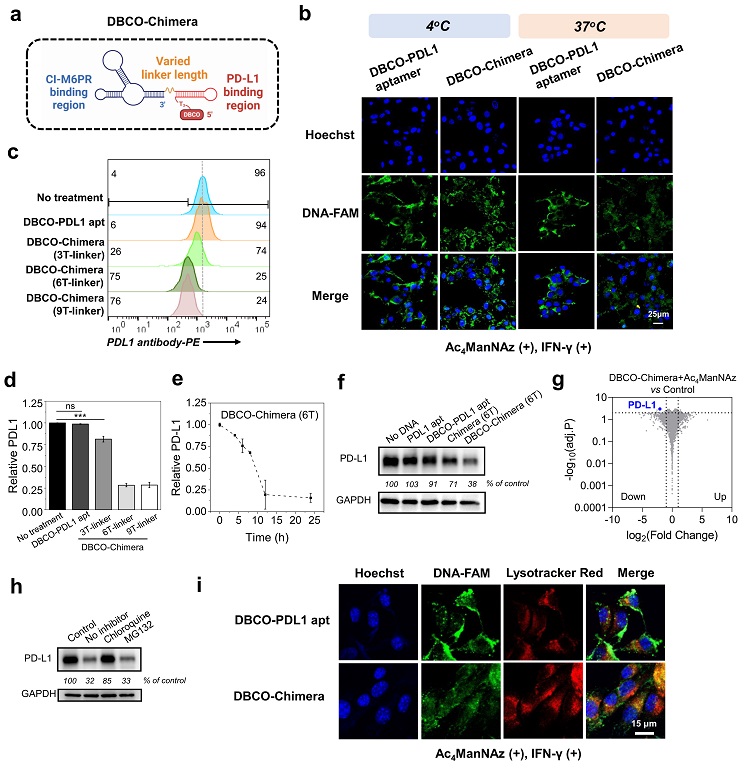
图2. 共价LYTAC的设计及其介导的PD-L1高特异性、高效降解。
另外,作者还通过Annexin v/PI染色,发现PD-L1降解后会引起肿瘤细胞免疫原性凋亡,并促使肿瘤细胞免疫原性升高,如表面盖网蛋白量增加,HMGB1和ATP分泌增加,有利于诱导产生特异性的抗肿瘤免疫应答。在体外将共价LYTAC处理过的B16F10肿瘤细胞与小鼠骨髓来源树突状细胞(BMDC)共培养,能刺激BMDC成熟,说明了该方法在增效免疫应答方面的可能性(图3)。
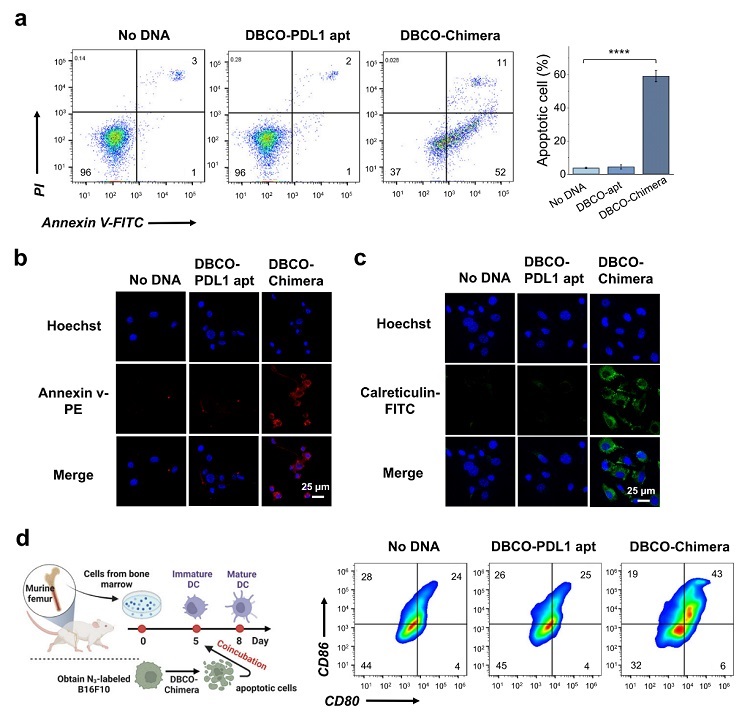
图3. 共价LYTAC通过高效降解PD-L1可引起肿瘤细胞免疫原性凋亡
作者通过系统性的小鼠体内实验,验证了共价LYTAC比非共价对照药物具有更显著的抑瘤能力和延长小鼠生存的效果。相较于基于PD-L1单抗的免疫检查点阻断(ICB)疗法,基于共价LYTAC免疫检查点降解(ICD)疗法可在有效阻断PD-1/PD-L1信号轴的基础上,进一步通过降解PD-L1诱导肿瘤细胞免疫原性凋亡来放大其免疫原性,促进免疫细胞在肿瘤组织中的浸润,CD8+T细胞分泌IFN-γ、Ki67、Graz B等抗肿瘤因子,实现单一治疗策略及联合治疗效果。共价LYTAC在B16F10、4T1、CT26肿瘤中均显示出比PD-L1单抗更好的抑瘤效果(图4)。
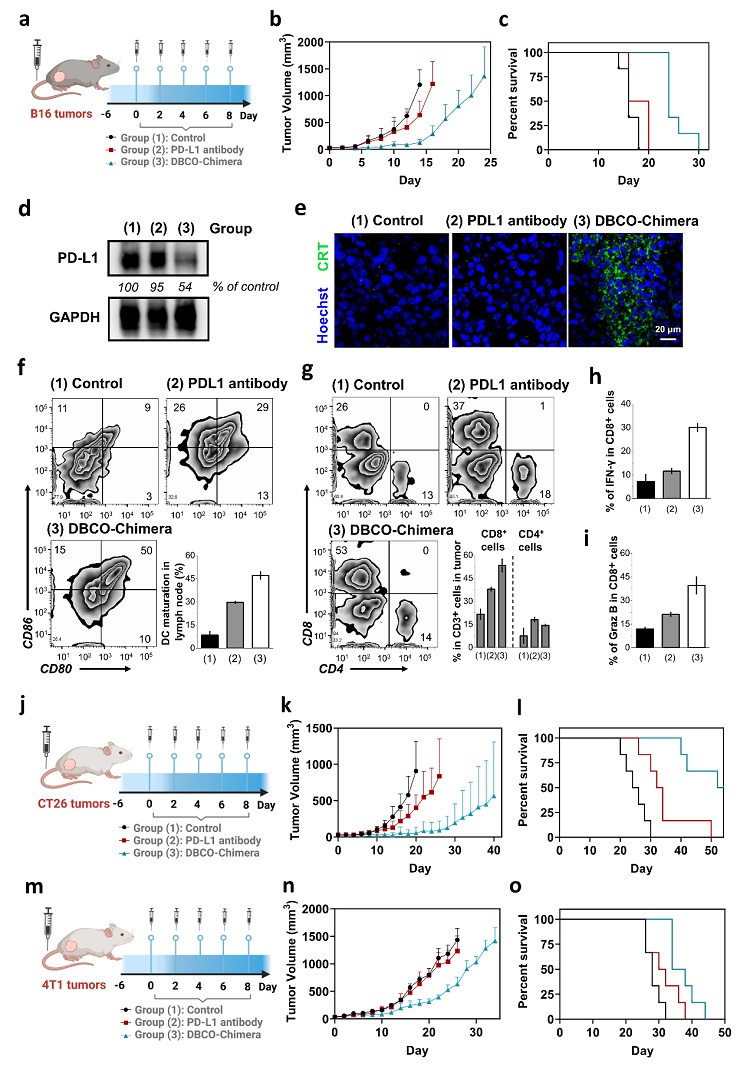
图4. 基于PD-L1单抗的免疫检查点阻断(ICB)疗法与基于共价LYTAC的免疫检查点降解(ICD)疗法的疗效对比
进一步地,为了合理对比、评估ICB疗法和ICD疗法的安全性,作者基于计量爬坡实验显示的结果,60 μg PD-L1单抗与15 μg 共价LYTAC具有的同等治疗效果(近似),开展了系统性的安全性实验研究。他们发现该剂量条件下,共价LYTAC与PBS对照组相比,基本不影响小鼠的体重增长、主要脏器健康状况和血生化血常规检测结果,但是单抗药物显示出了强烈的副作用,可能导致小鼠体重增长变缓,血液中促炎因子如IL-6、IL-1β和TNF-α急剧升高,发生结肠炎、主要脏器受损和贫血风险(图5)。以上实验综合表明,ICD疗法比ICB疗法具有更好的安全性。
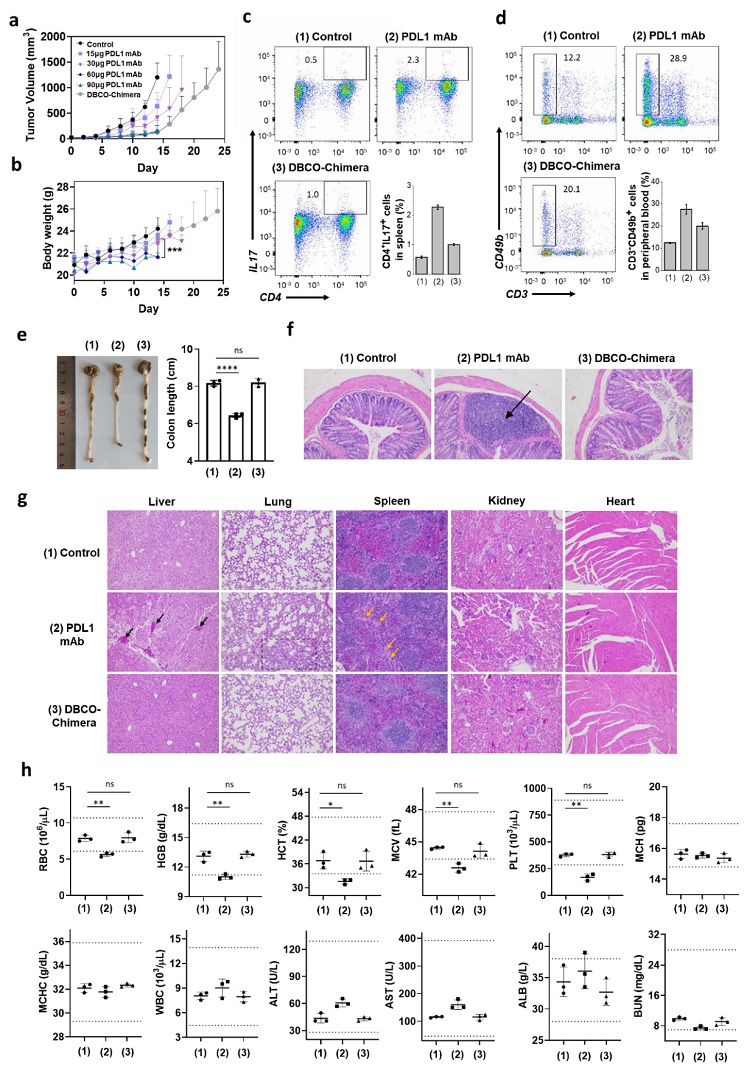
图5. 基于PD-L1单抗的免疫检查点阻断(ICB)疗法与基于共价LYTAC的免疫检查点降解(ICD)疗法的安全性对比
苏州大学刘庄教授、上海交通大学杨宇教授和韩达教授为论文的共同通讯作者,苏州大学为第一通讯单位。基金致谢:本研究得到了中国国家重点研发计划、中国国家自然科学基金等等的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Covalent LYTAC Enabled by DNA Aptamers for Immune Checkpoint Degradation Therapy
Yuqing Li, Xueliang Liu, Lu Yu, Xin Huang, Xuan Wang, Da Han*, Yu Yang*, and Zhuang Liu*
J. Am. Chem. Soc., 2023, DOI: 10.1021/jacs.3c03899
导师介绍
刘庄
https://www.x-mol.com/university/faculty/18393
韩达
https://www.x-mol.com/groups/hanlab
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


















































 京公网安备 11010802027423号
京公网安备 11010802027423号