Science加Nature,Levin团队分子骨架编辑的连环“大招”
副标题:氮杂芳烃的碳-氮单原子替换反应
通常情况下,分子骨架中单个原子的改变会对其性能(如:氢键、极性、代谢稳定性、靶点特异性、溶解度等)产生巨大影响,例如:氮原子取代芳香碳原子后可以有效调节此类分子的药化性质(图1a)。很显然,直接将母体分子骨架中的碳原子替换为氮原子的化学策略会对分子优化活动产生巨大影响。尽管碳-氮替换原则上仅涉及单个原子,但是实践中却需要断裂较强的C-C键,并且以兼容复杂结构的方式引入氮原子,挑战不小。杂芳环的骨架编辑就要面对更多难题。例如,在氮杂芳环构效关系研究中需要迭代、重新合成每个候选物来确定必要的氮原子。此外,随着氮含量的增加,其化合物的合成更具挑战性。目前,化学家发展了两种潜在策略来实现碳-氮替换(图1b):1)先删除碳原子生成较小的(杂)环,然后再插入氮原子;2)先将氮原子插入芳香体系,然后再删除碳原子。然而,两个关键的缺陷限制了现有方法(图1c):首先,插入的氮原子必须与离去的碳原子具有同样的选择性,否则会发生骨架旋转;其次,许多插入和删除策略同时会向起始原料骨架中引入额外的附加物,进而阻止了对必要氮效应的直接访问。
美国芝加哥大学的Mark D. Levin教授团队近年来在分子骨架编辑方面接连获得重大突破。2021年,他们开发了一种异头酰胺试剂,可直接“删除”仲胺中的氮原子,释放出N2并生成分子内C-C键偶联产物(Nature, 2021, 593, 223, 点击阅读详细)。2022年,他们利用光化学转化进行氮杂芳环上的“碳删除”策略,成功地将喹啉骨架转变为吲哚骨架(Science, 2022, 376, 527-532, 点击阅读详细)。大约一个月之前,他们又报道了一种可定点的芳环碳-氮替换反应,通过氮宾内化(nitrene internalization)过程获得多种吡啶异构体(Science, 2023, 381, 1474, 点击阅读详细)。近日,Levin教授团队和美国默克公司(Merck & Co.)的Alec H. Christian博士合作,报道了一种将氮杂芳烃碳原子直接转化为氮原子的碳-氮单原子替换反应(图1d),一步将喹啉转化为相应的喹唑啉衍生物。其具体过程如下:首先,氮杂芳烃4被氧化为相应的N-氧化物1,后者在光照的作用下生成benzoxazepine,接着通过氧化裂解原位生成带有两个羰基的中间体3,其可作为“sticky ends”进行后续转化,即活化C3作为羧酸酯离去基团,同时通过活化C2促进氨的缩合并最终得到产物2a。相关成果于近日发表在Nature 上。
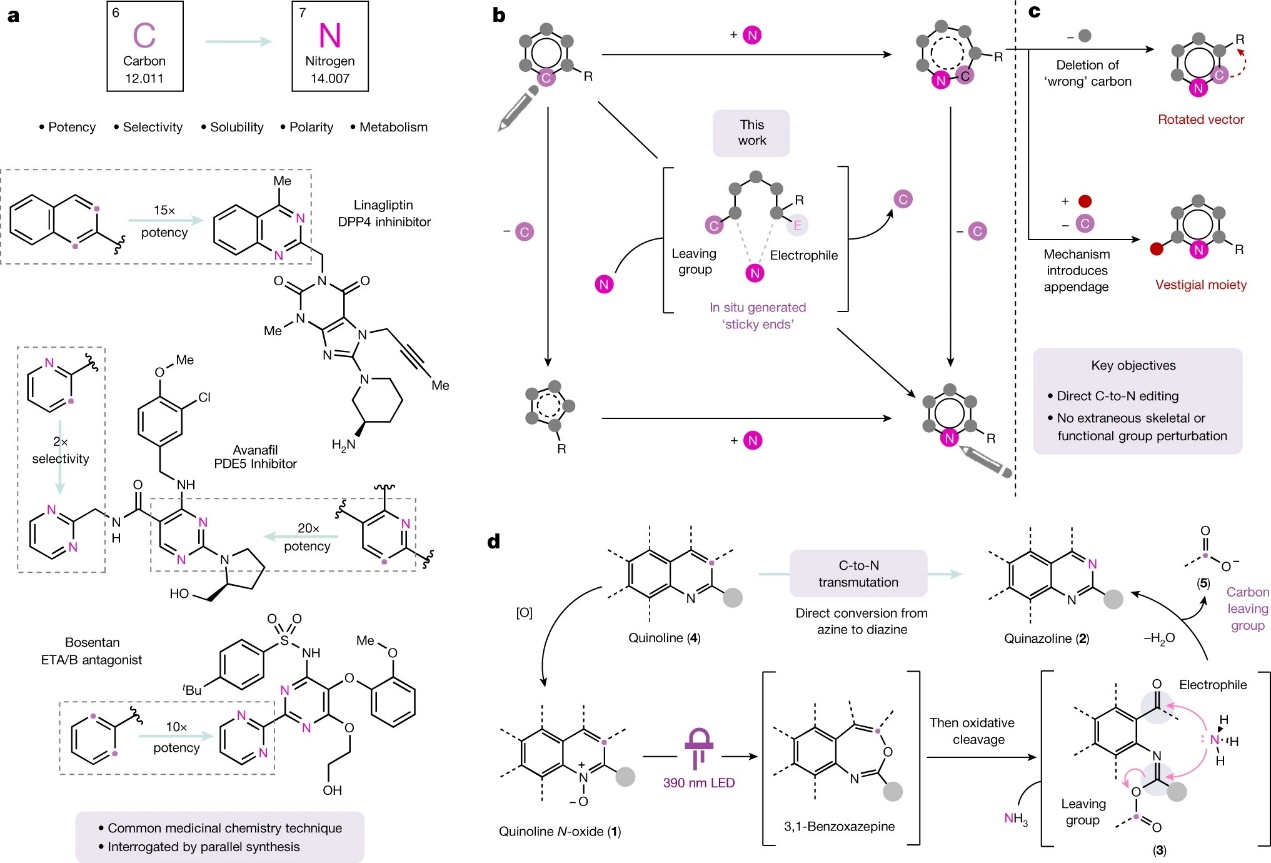
图1. 背景介绍及本文思路。图片来源:Nature
首先,作者研究了许多潜在的氧化裂解条件,最终发现臭氧分解可以提高产率。然而,由于imidic anhydride的水解存在问题,因此作者试图通过一锅法来避免分离操作,即在臭氧分解前添加氨亲核试剂(以氨基甲酸铵的形式)。事实上,先用390 nm LED照射2-苯基喹啉-1-氮氧化物生成benzoxazepine,随后向其中加入氨基甲酸铵和吡啶并于-78 ℃下进行臭氧分解,接着将上述混合物加热至90 ℃,最终以68%的分离产率获得喹唑啉2a。此外,该反应也可以从2-苯基喹啉出发,在氯仿中经过酸氧化、甲苯稀释以及上述一锅法方案,以55%的产率(1.0 mmol规模)获得喹唑啉2a。在最优条件下,作者对底物范围进行了考察(图2),结果显示该反应能以良好的产率制备多种C2-芳基(2b-2d)、C2-杂芳基(2e-2g)、C2-酯基(2j)和C2-烷基(2k-2n)取代的喹唑啉,特别是N,N'-二氧化物(1a)可以经历两次C→N替换并生成相应的联喹唑啉(2h)。此外,该反应还可以在切除的C3位耐受不同的取代基,例如:烷基(1b、1c)、苯基(1d)、呋喃(1e)、酯基(1f)、苯甲酰基(1g)、氰基(1h)、磺酰基(1j)、氯原子(1i)、甲氧基(1k)和邻苯二甲酰亚胺基(1l);同时在喹啉骨架上也可以耐受多种基团(如:二噁烷基(2t)、三氟甲基(2u)、2-氧乙酸乙酯(2z)、甲氧基(2y)、氨基甲酸酯(2w)、溴原子(2aa)、膦酸盐(2x)),其中C4取代的底物(2s-2u)产生酮而非醛末端的“sticky end”中间体,进而需要在乙醇中进行更强的氨解。鉴于N-氧化物可以导向过渡金属催化的喹啉C8-H键官能团化,因此作者将C-H键碘化和该方案相结合以获得含碘喹唑啉(2r),进而突出外围修饰和骨骼编辑之间的潜在协同作用。值得一提的是,当C2和C3并有八元环(1r)时,此环可以被“打开”以形成相应的喹唑啉(2ad),同时保留原来的C3位作为侧链官能团,作者推测反应中间体羧酸盐被过量的氨转化为相应的酰胺。
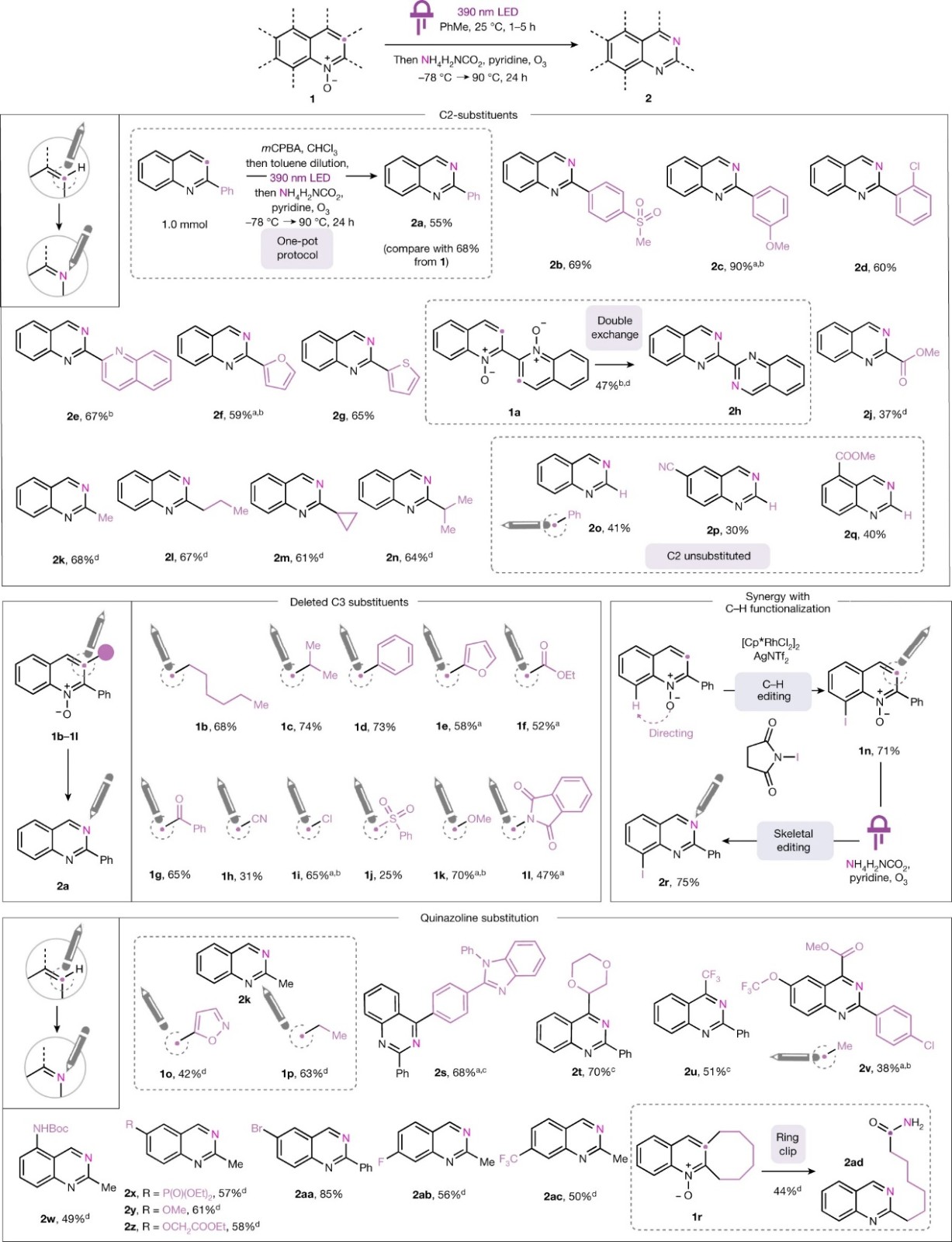
图2. 氮杂芳烃碳-氮单原子替换的底物拓展。图片来源:Nature
接下来,作者通过一系列衍生化来证明该策略具有潜在的合成价值,具体而言:1)从3-(喹啉-2-基)苯酚出发,经两步转化获得喹啉前体4b,后者经N-氧化和C→N替换以1.3 g规模合成了喹唑啉中间体2ae,最后经两步C-H键胺化便可实现慢性移植物抗宿主病新药贝舒地尔(6)的合成(图3a);2)[1,n]-萘啶通过此方法合成了先前难以合成的[1,3,n]-三氮杂萘(图3b)。然而,当几个氮原子存在于同一个核心骨架时,就需要选择性氧化“喹啉型”而非“异喹啉型”氮原子。对于1,4-和1,8-萘啶,就可以使用对称结构(2af)或2-取代底物(2ak)使得N-氧化具有选择性。对于1,5-和1,6-萘啶,作者通过甲氧基(2ah、2ai)或氯原子(2ag、2aj)取代来减弱“异喹啉型”氮原子的亲核性;3)TACR3受体拮抗剂他奈坦衍生物和DHODH抑制剂布喹那衍生物也能实现这一转化,并以中等产率获得相应的喹唑啉2an和2am(图3c);4)利用Parasram和Leonori同时开发的光化学硝基芳烃促进的替代氧化裂解方案,成功地实现了C→N替换(图3d),即在-30 ℃的乙腈中将硝基芳烃7加入到LED光解生成的benzoxazepine中并用相同的LED继续光解,然后加入氨基甲酸铵和三氟乙酸,以63%的产率获得产物2a。基于先前的报道,作者推测氧化裂解是通过1,3,2-dioxazolidine 8进行的,但是随后的分解和氨解可能比臭氧分解方案更复杂。总的来说,研究发现硝基芳烃方案的底物范围比本文发展的方法更局限。
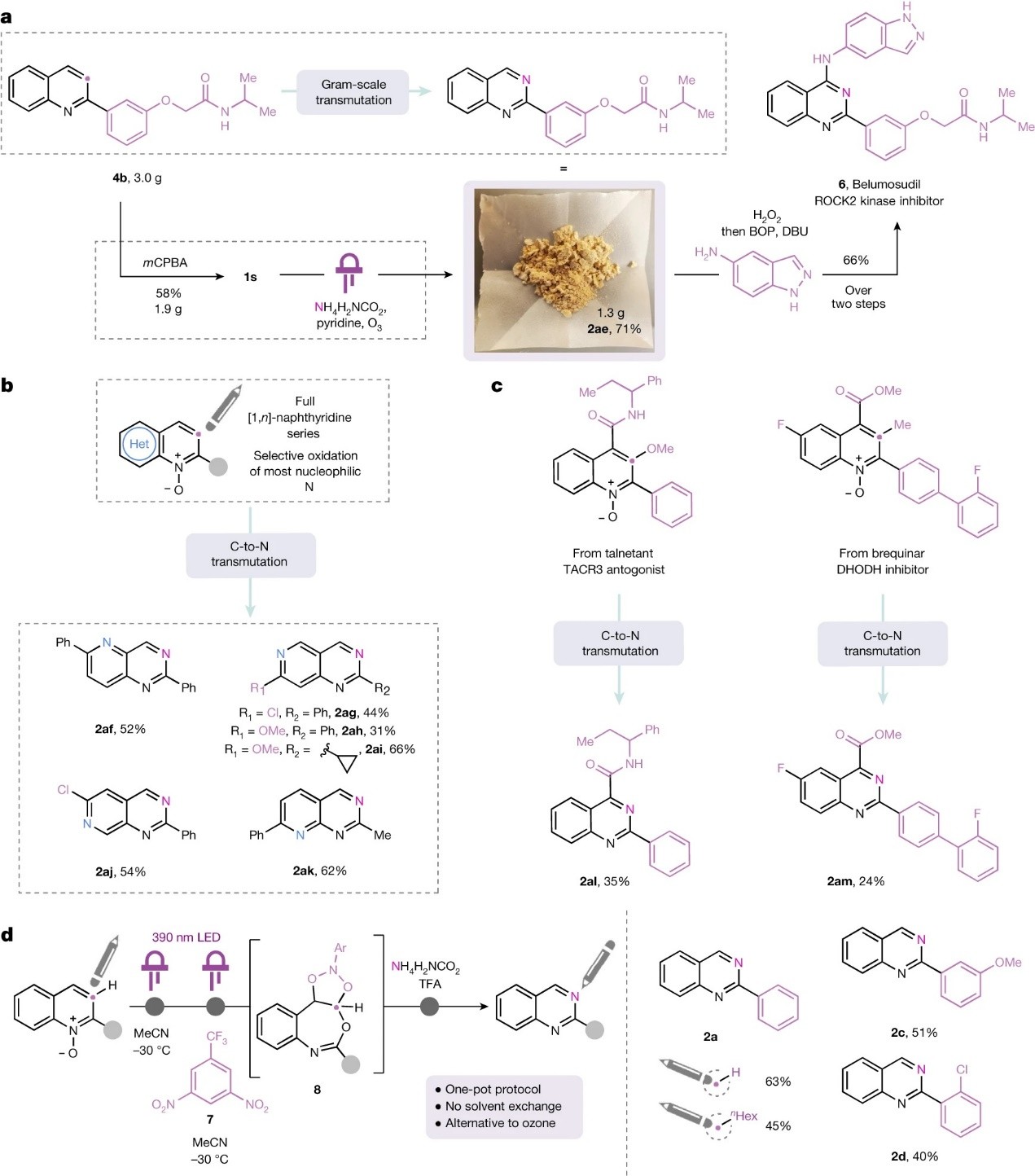
图3. 合成应用。图片来源:Nature
为了进一步探究反应机理,作者制备了13C标记的喹啉N-氧化物1u并通过13C NMR光谱监测反应(图4a),结果显示1u(122.70 ppm)在光照下会重排为中间体9(145.01 ppm)。若没有吡啶的情况下进行臭氧分解,则会形成复杂的混合物,并且119.04 ppm的新共振归属于二级臭氧化物11;而在吡啶的存在下该物种被明显抑制,取而代之的是163.36 ppm处观察到一个主峰,这与imidic anhydride(3a)的甲酰基碳相一致。另外,当在氨基甲酸铵存在的情况下进行臭氧分解时也可以观察到该物种,随后将该混合物加热到90 ℃导致喹唑啉2a的形成,而且热解后的粗有机层不含任何明显的13C标记产物,但是溶解在D2O/DMSO-d6中却可以识别出甲酸铵5a(167.48 ppm)和甲酰胺5b(171.79 pm),并且对照实验表明5a在加热时可以转化为5b。由于在分离3的过程中总是伴随着水解生成的2-酰胺基苯甲醛产物10,因此作者进行了对照实验,结果表明10a或10b在标准条件下(包括向反应混合物中添加额外的甲酸或甲酰胺)进行反应时均不能获得相应的喹唑啉(图4b)。尽管作者观察到甲酰胺和甲酸的加入确实诱导了10部分转化为喹唑啉,但在相同时间尺度上要比酸酐中间体3的转化率低。总的来说,这些实验结果强调了“sticky end”中间体3的关键作用——它不仅活化C3作为羧酸酯离去基团,而且通过活化C2促进氨的缩合。

图4. 机理研究。图片来源:Nature
总结
Mark D. Levin教授等研究者报道了一种将氮杂芳烃碳原子直接转化为氮原子的C→N替换反应,一步将不同位置、不同基团取代的喹啉转化为相应的喹唑啉衍生物。机理研究表明该反应的关键在于原位生成带有两个羰基的中间体,其可作为“sticky ends”进行后续转化,即活化C3作为羧酸酯离去基团,同时通过活化C2促进氨的缩合并最终得到产物。毫无疑问,该方案为利用喹啉合成喹唑啉提供了新思路。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Carbon-to-nitrogen single-atom transmutation of azaarenes
Jisoo Woo, Colin Stein, Alec H. Christian, Mark D. Levin
Nature, 2023, 623, 77-82. DOI: 10.1038/s41586-023-06613-4
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号