Science:分子骨架编辑“大招”—芳环碳氮定点替换
在药物化学中,配体与靶点之间的形状互补性强烈影响着二者之间的结合,因此保留分子三维轮廓的等径原子替换在药物发现中占据重要地位,例如:用氮原子取代芳环碳原子后可以获得相应的吡啶(或高级的氮杂芳烃),通过物理化学性质的调节、氢键受体的引入和氧化代谢来赋予分子关键的类药性质,药物化学家将这种效应称为“必需氮效应(necessary nitrogen effect)”。然而,识别这类“必需氮效应”通常需要筛选每种异构体,此做法在药物发现化学中称为“氮扫描”(图1A)。尽管“氮扫描”的概念听起来比较简单,但因缺乏通用且简便易行的原子替换方法,化学家需要自下而上地构建每个氮异构体,合成过程费时费力,代价不菲。因此开发可实现碳-氮直接替换的合成方法引起了众多科学家的广泛关注。目前也报道了一些相关方法,例如:1)利用化学计量的钛alkylidynes实现了吡啶到苯的逆反应,并且在脂肪族体系中也证明了其它原子交换方法(如:O→N);2)基于光化学转化进行氮杂芳环上的“碳删除”,由喹啉骨架变为吲哚骨架,从而直接实现骨架跃迁,但是该方法目前仅限于特定的杂环骨架,并且只能提供单个C-to-N异构体。
1966年,Doering首次利用芳基叠氮化物(1)和质子亲核试剂合成了2-氨基-3H-azepines(图1C)。随后,Sundberg发现其在空气存在下光解会得到吡啶产物的混合物,这表明azepines的氧化可能是一种潜在的合成策略。最近,Burns发现单线态氧作用于3H-azepines时可以诱导“间位”碳删除。然而,上述方法在选择性、底物兼容性以及产物分离等方面都存在严重的限制。在此基础上,美国芝加哥大学的Mark D. Levin教授(点击查看介绍)课题组发展了一种可定点的芳环C-to-N替换反应,通过氮宾内化(nitrene internalization)过程获得多种吡啶异构体。其具体过程如下:在两步、一锅法中,芳基叠氮化物首先在光催化下转化为3H-azepines,后者通过螺环azanorcaradiene中间体进行氧化并触发C2选择性螯变碳释放,从而获得所需的吡啶产物。此外,由于芳基氮宾的ipso-碳被删除,保证了反应的高区域选择性,并且不干扰底物的其余部分。相关成果于近日发表在Science 上。
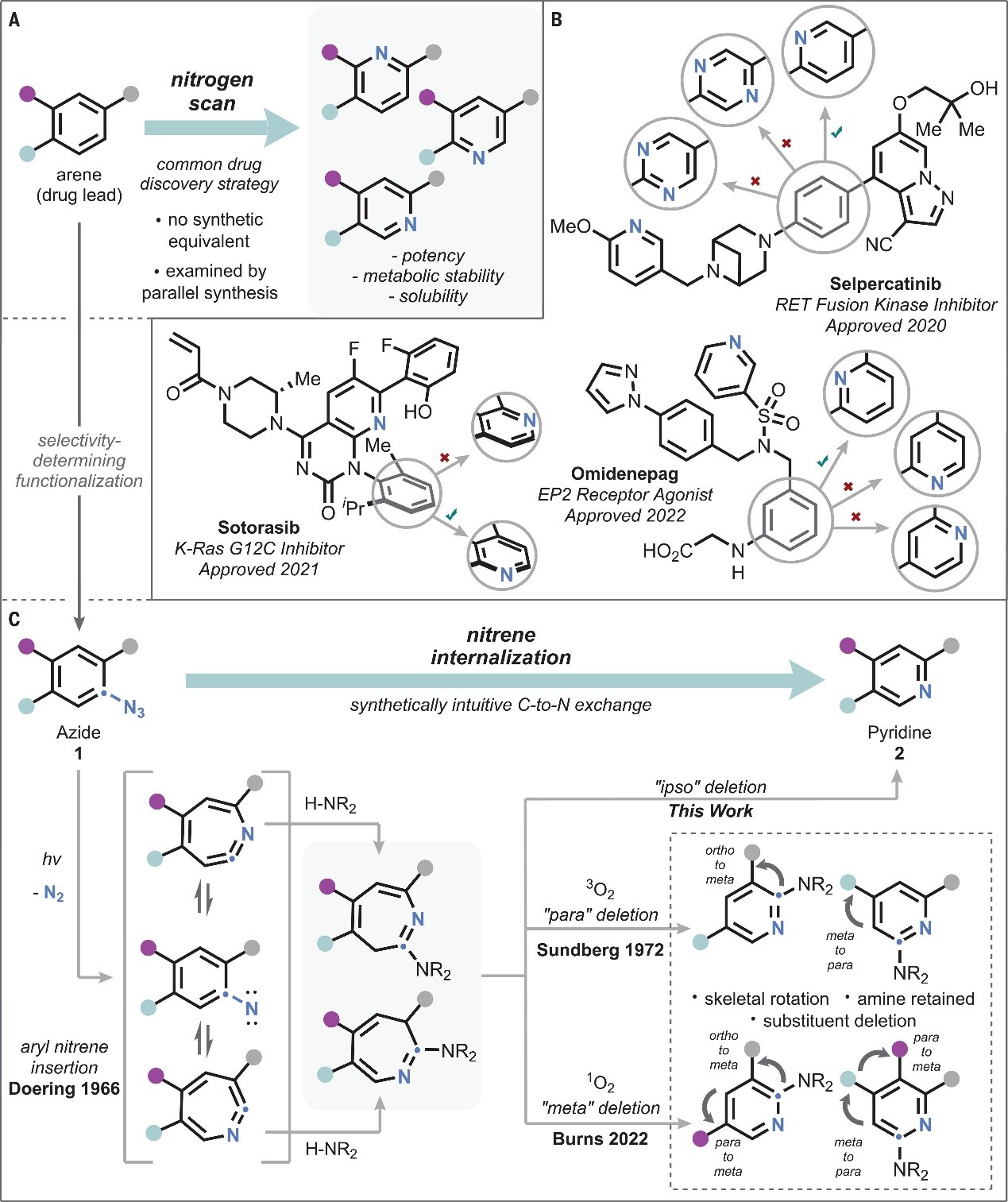
图1. 背景介绍及本文工作。图片来源:Science
首先,作者假设azepine氧化会产生氮杂环庚三烯物种(I),后者互变异构为azanorcaradiene异构体(II)便可实现ipso碳的螯变释放(图2A)。另外,先前的研究表明环庚三烯酮的脱碳需要超过400 ℃的高温,而螺环二氨基缩醛胺衍生物却能在室温下进行脱碳(图2B),其反应性的差异可归因于不同杂化方式azanorcaradiene中间体的角张力变化。基于此,作者试图在胺亲核试剂引入第二个侧链供体以使螺旋化成为可能,进而通过类似的角张力减少来促进卡宾的消除。具体而言:作者选择氨基醇取代的azepine衍生物(3a)为模板底物并将其置于有机碱和N-溴代琥珀酰亚胺下进行反应,但是仅生成琥珀酰亚胺捕获的氧化产物4a(图2C)。值得一提的是,当使用N-溴己内酰胺进行反应时却观察到所需的螺环N,O-缩酮5a,同时将其加热至80 ℃可以13%的产率获得相应的吡啶产物2a,但4a的热解只导致非特异性分解。此外,随着反应的进行,5a的进一步氧化开始与3a竞争,而在80 ℃缓慢加入氧化剂进行氧化反应则可以更高的产率(72%)获得吡啶2a。尽管无法检测到卡宾副产物6,但可以通过NMR和质谱分析观察到其氧化产物N-乙基恶唑烷酮。另一方面,缺乏侧链醇官能团(7a)或醇被甲硅烷基化(8a)的azepine衍生物进行反应时没有检测到吡啶,进而支持螺环化在碳删除过程中的关键作用。如图2D所示,作者的密度泛函理论(DFT)计算分析与实验观察结果(THF)大致相符,即通过两性离子中间体(INT2)逐步释放卡宾,并且其总能垒为 21.5 kcal/mol。
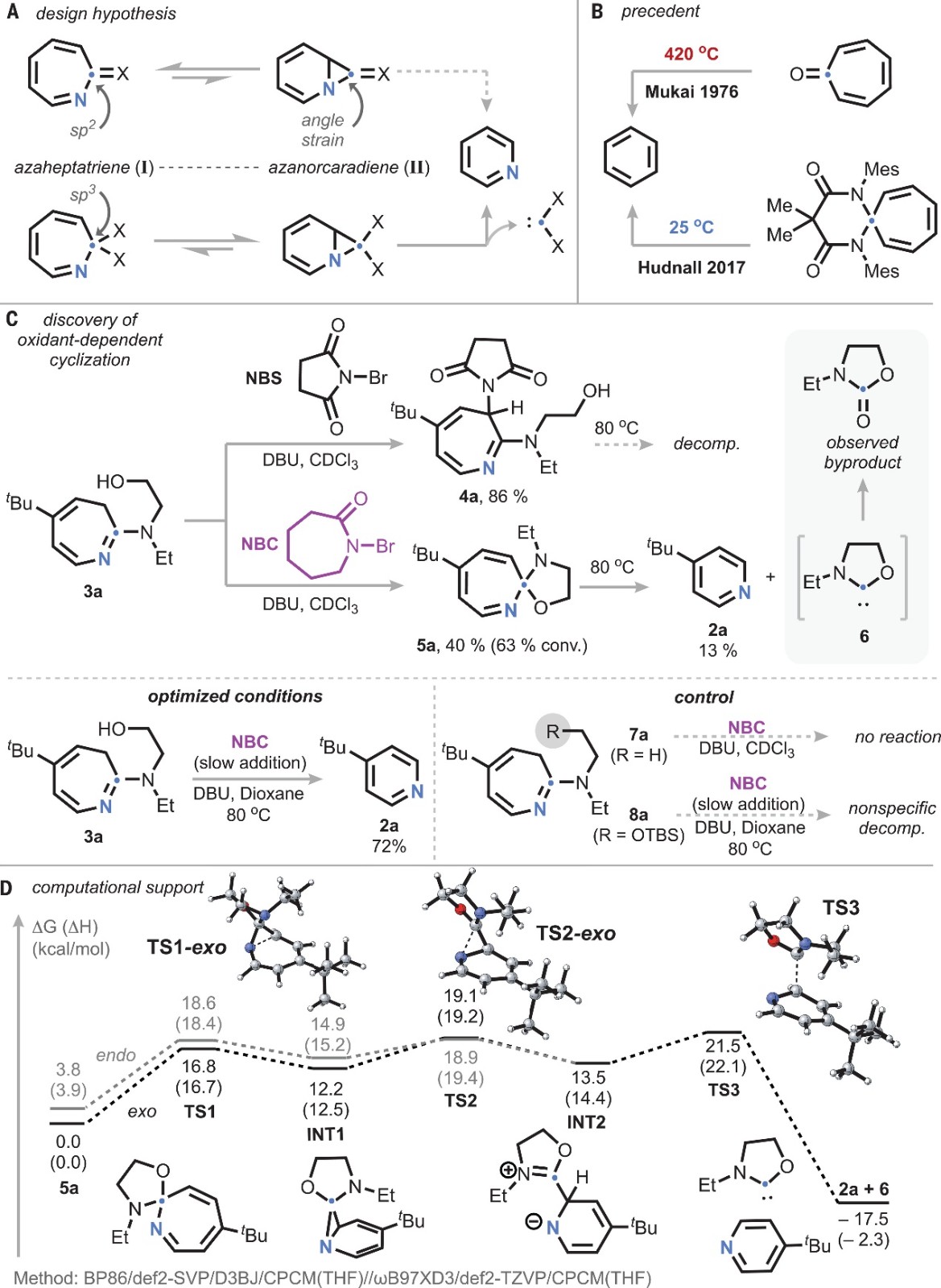
图2. 反应设计和机理研究。图片来源:Science
接下来,作者利用两步、一锅法策略(即芳基叠氮化物先转化为azepine衍生物,后者无需纯化直接用于碳删除反应)对底物范围进行了考察(图3A),结果显示各种烷基(2a-2c)、芳基(2j、2k)和杂芳基(2n、2o)取代的底物均能兼容该反应,特别是富电子芳烃(2b、2j、2r)以及含有共振受体(2d-2f、2l、2m)和诱导受体(2h)的底物也能顺利地实现这一转化。此外,该反应还能耐受保护的胺(2p和2s),同时能将氨鲁米特转化为罗谷亚胺和醇(2g-2i),甚至张力环和稠合环底物也能以良好的产率转化为相应产物(2p和2r)。其次,该方案的特别之处在于光解过程中可生成两种不同的azepine异构体,但两者进行后续反应均可生成同一产物。如图3B所示,底物1t在光解过程中以1:1的比例生成两种azepine异构体(3ta和3tb),将其混合或分离后处理均获得了唯一的吡啶产物2t,并且没有检测到其它吡啶异构体的形成。尽管3ta和3tb均能产生吡啶,但其产率不同,这表明azepine的特定立体构型会影响氧化效率。然而,该反应的两个步骤均存在局限性,具体而言:1)在光解过程中,邻位官能团与光解生成的氮宾存在竞争性反应(如:Cadogan环化);2)某些底物固有的光物理性质限制,例如:4-叠氮基联苯相对于扩环而言更容易发生系间窜越,因此产生大量的三线态氮宾产物(如:偶氮联苯和 4-苯基苯胺);3)芳环邻位和对位的共振供体(如:烷氧基和胺取代基)有利于在氮宾生成时形成醌式共振形式,进而不能有效地生成azepines衍生物;4)即使存在过量碱,游离醇和胺也不能与 N-溴己内酰胺有效反应,因此必需对其进行保护;5)在某些情况下,中间体azepine的过度氧化会生成主要的副产物——溴吡啶或联吡啶,并且作者发现芳烃对位带有大位阻基团的底物可以避免这些副反应(如:2l vs 2m;2a vs 2t)。
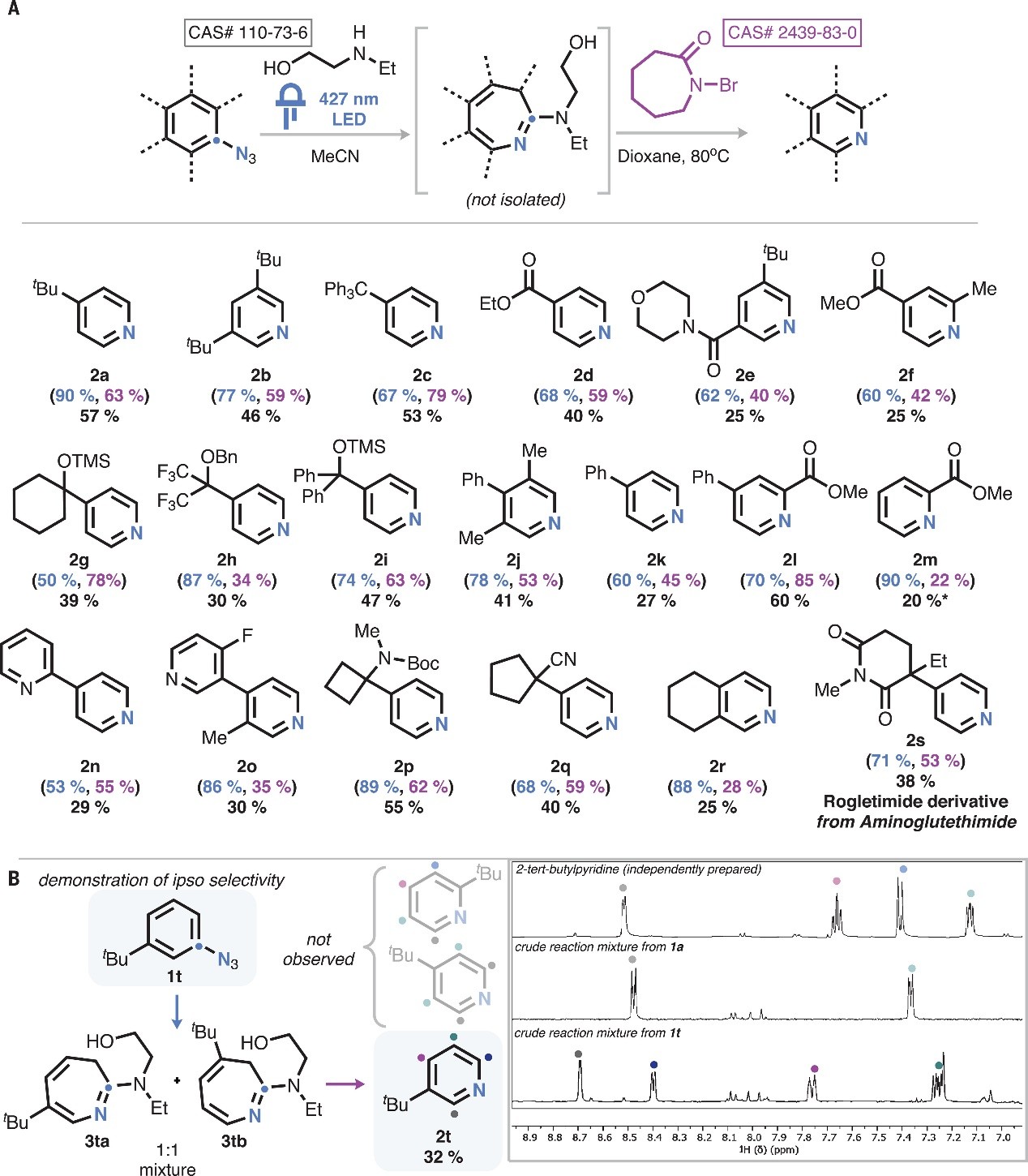
图3. 底物拓展。图片来源:Science
最后,作者通过一系列研究证实该策略具有潜在的合成价值。例如:1)从雌酮出发,经三步转化得到相应的叠氮化物,随后应用该策略便可以10%的总产率获得相应的吡啶类似物2u(图4A),极大地简化了先前的合成路线(11步,总收率<1%);2)对简单的模型芳烃进行了直接氮扫描(图4B),即利用非选择性铱催化不对称1,2-二取代苯的C-H键硼化反应和Chan-Lam叠氮化反应获得两个可分离的芳基叠氮化物异构体,再通过本文发展的策略便可获得两种吡啶异构体(2v和 2w),同时没有其它吡啶异构体的生成。
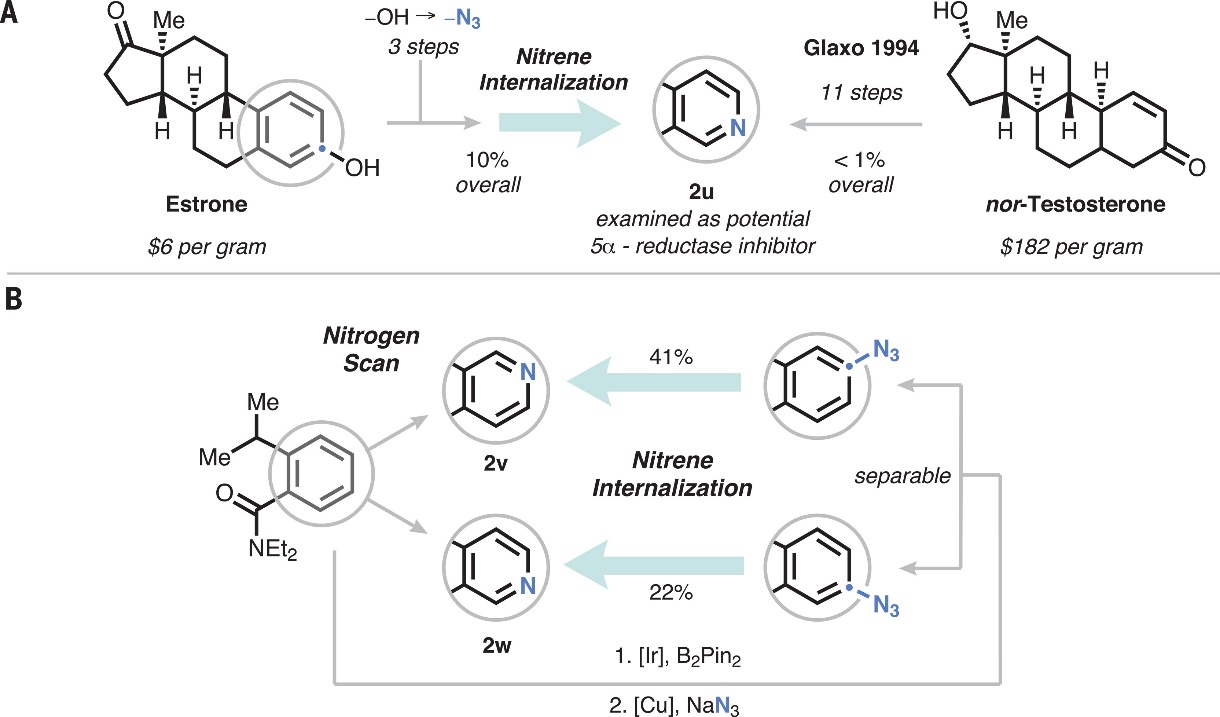
图4. 合成应用。图片来源:Science
总结
Mark D. Levin教授团队发展了一种可定点芳环C-to-N替换反应,通过氮宾内化过程获得多种吡啶异构体。这种分子骨架编辑方法可以极大的方便化学家获得所需的吡啶产物,对于药物发现、有机合成、新材料研发来说都有重要的实际意义。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Aromatic nitrogen scanning by ipso-selective nitrene internalization
Tyler J. Pearson, Ryoma Shimazumi, Julia L. Driscoll, Balu D. Dherange, Dong-Il Park, Mark D. Levin
Science, 2023, 381, 1474-1479. DOI: 10.1126/science.adj5331
导师介绍
Mark D. Levin
https://www.x-mol.com/university/faculty/311435
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号