华东理工大学包春燕教授JACS:全合成跨膜人工信号转导受体
细胞膜上信号的转导与许多生命活动息息相关,负责信号转导的跨膜受体责任重大,它们功能的异常或缺失会引发许多疾病。信号转导蛋白并不直接传输信号分子,而是通过与胞外信号分子识别、发生跨膜结构变换、激活并引发胞内下游反应等系列过程完成信号跨膜转导,典型的如酪氨酸激酶偶联受体(RTKs)和G蛋白偶联受体(GPCRs)。近年来,相关研究人员开始尝试合成人工受体来模拟这些过程,并且在细胞合成、生物催化、药物传递和生物传感等领域开展相关的应用探索。
近日,受天然信号转导蛋白工作机制启发,华东理工大学包春燕教授在Journal of the American Chemical Society 上发表研究论文,报道了利用折叠体的构象改变来实现信号跨膜转导的研究工作。这项工作借助简单的金属络合与解络合来调控跨膜折叠体构象的改变,进而调控跨膜信号的转导,为发展新型人工跨膜信号转导体系提供了新的分子范式。
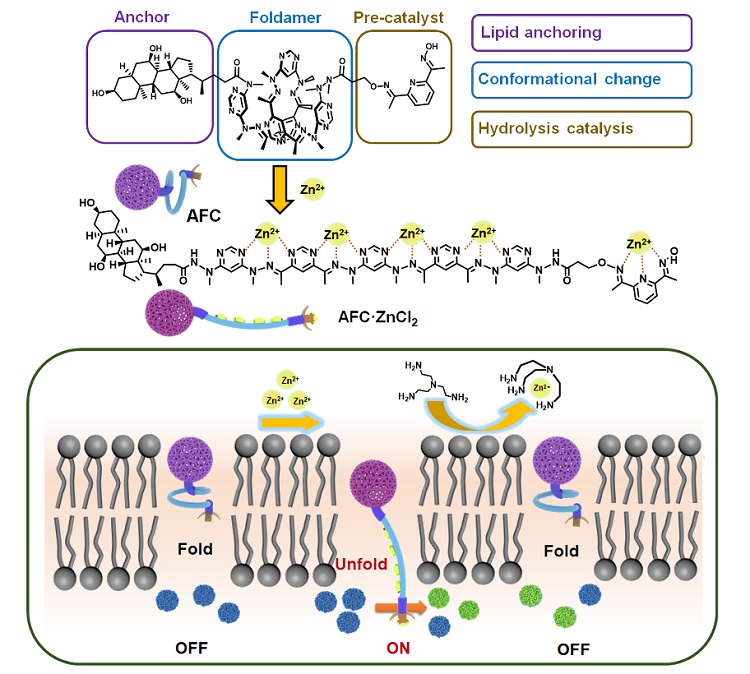
图1. AFC分子结构以及在磷脂膜上实现可控跨膜信号转导的工作示意图
作者设计的人工受体分子AFC包含三个功能基团,即脂膜锚定基团、折叠体基团和预催化基团。其中,选取胆酸基团为膜锚定基团,它的存在有利于AFC插入磷脂膜中并使其定位于接近磷脂膜的亲水区域。受到Lehn等人工作的启发,选取嘧啶-腙-嘧啶(pym-hyz-pym)重复单元为折叠体基团,它可以通过金属离子诱导的解折叠实现构象的改变。为了模拟自然界中受体蛋白通过信号转导催化胞内释放二级信号的过程,选取经典的吡啶肟基作为预催化基团,它可以通过与过渡金属的络合催化酯的水解反应(图1a)。为了验证AFC的设计合理性,作者通过量子力学计算了AFC在络合金属离子前后的分子长度,并利用分子动力学模拟了受体分子在磷脂膜中的结构状态。结果与所预想的基本相符,即在折叠状态下,受体分子因长度不足限制其尾基进入脂质体内腔;加入锌离子后,解折叠的分子因长度的增加促使络合的催化尾基进入脂质体内腔,开启催化任务引发酯的水解,实现跨膜信号转导(图1b)。最后,通过加入竞争配体,受体分子恢复折叠状态,进而停止信号转导,实现ON/OFF的可逆调控。
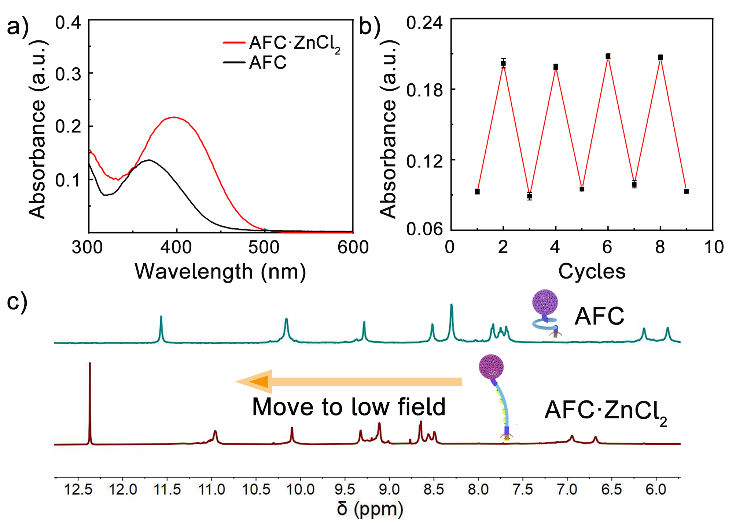
图2. a) AFC在络合锌离子前后的UV-vis吸收变化;b) 交替加入ZnCl2和TAEA后,AFC在410 nm处的吸光度变化。c) AFC在络合锌离子前后的1H NMR波谱比较。
UV-vis和1H NMR波谱分析证明AFC可以与锌离子发生可逆的络合和解络合(图2)。DLS和DPX膜漏实验证明,AFC的插入不会对脂质体的磷脂膜产生大的干扰和破膜作用。得益于胆酸的存在,AFC在络合锌离子前后都呈现了良好的上膜率。这些结果为AFC分子在磷脂膜上通过锌离子诱导构象改变实现信号跨膜转导提供可能。利用LUVs⊃APTS实验(图3a-c),作者研究了AFC的信号跨膜转导活性。通过与控制分子AC(缺少折叠体单元)和AF(缺少尾部肟基)的比较,验证了锌离子诱导的解折叠和催化基团的生成是AFC实现跨膜信号转导的关键。基于APTS水解会产生荧光HPTS的特性,作者进一步利用GUVs的荧光共聚焦实验对AFC的跨膜信号转导过程进行了实时追踪(图3d)。

图3. a) 用于检测信号转导活性的LUVs⊃APTS模型示意图; b) AFC、AC和AF的信号转导活性比较; c) 不同浓度AFC的信号转导活性比较;d) AFC在GUVs膜上实现信号转导的可视化。
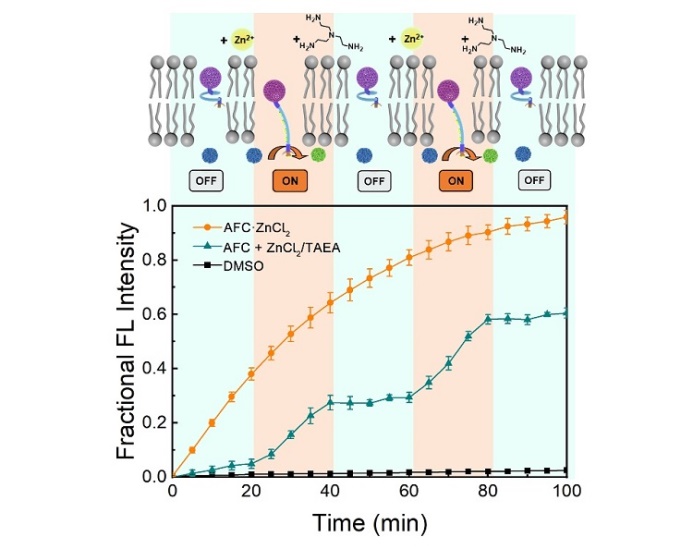
图4.通过交替添加ZnCl2和TAEA实现AFC的ON/OFF信号转导。
另外,在自然界中,受体蛋白的跨膜信号转导可以在ON和OFF状态之间可逆切换,从而使胞内生化过程可以应细胞外信号分子刺激实现调控。基于竞争性络合机制,作者可以通过加入TAEA (Zn2+的强螯合剂)实现AFC信号转导的可逆关闭。如图4所示,AFC的加入不会触发信号转导,而随后Zn2+的加入会促使AFC解折叠,络合的吡啶肟可以进入囊泡内部,开启催化水解反应;加入TAEA后,与Zn2+络合竞争会促使AFC恢复到折叠状态,从而停止囊泡内水解反应,关闭信号转导过程。最终,可以通过交替加入不同信号分子实现AFC跨膜信号转导的可逆开启与关闭。
综上所述,该人工受体分子作用机制仿生GPCR信号转导过程,通过与信号分子的结合引发膜上受体分子构象发生改变,促使囊泡内包封物质的水解。进一步通过信号分子的竞争结合引发受体分子构象恢复,关闭催化水解功能。最终,通过简单控制这些结合事件实现受体分子跨膜信号转导的开启与关闭。
该论文由华东理工大学博士研究生庞施浩在包春燕教授的指导下完成,文中理论计算模拟部分由吉林大学赵莉副教授所在团队完成。该研究成果得到了国家自然科学基金、上海市科技重大项目以及上海市细胞代谢光遗传学技术前沿科学研究基地等资金的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Folding and Unfolding of a Fully Synthetic Transmembrane Receptor for ON/OFF Signal Transduction
Shihao Pang, Jiawei Liu, Tianlong Li, Kai Ye, Zexin Yan, Li Zhao*, and Chunyan Bao*
J. Am. Chem. Soc., 2023, DOI: 10.1021/jacs.3c07814
导师介绍
包春燕,华东理工大学教授、博士生导师。2006年6月于吉林大学化学学院获得理学博士学位。2006年9月至2008年8月在法国波尔多第一大学欧洲化学与生物研究所(IECB)从事博士后研究工作。2008年9月起就职于华东理工大学。主要从事智能生物医用材料的研究,针对材料与细胞表界面的关键科学问题,开展调控水凝胶生物材料表界面和仿生细胞膜表界面功能化的研究。迄今,已在Science、Adv. Mater.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Chem. Sci.等国内外有影响的刊物上发表SCI论文100余篇,引用次数4000余次,H因子为37。截止目前,主持了国家基金委青年和面上项目、上海市科委面上项目、上海市教委和科委人才项目等。
https://chem.ecust.edu.cn/2014/1113/c6655a50247/page.htm
https://www.x-mol.com/university/faculty/10484
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号