小分子药物?生物制剂?
多年以来,治疗人类疾病的主力一直都是小分子药物。小分子种类非常多样,它们治疗疾病的作用机制也非常多样,可以是有效的酶抑制剂和变构修饰剂,也可以靶向胞质溶胶、细胞核和中枢神经系统中的胞外蛋白或胞内受体。尽管小分子药物也存在一些这样那样的局限性,时至今日仍然是药物开发的主力。不过,小分子的药物市场份额正在不断被新兴的生物制剂夺走,这也是不争的事实和难以逆转的趋势。随着生物技术的进步,在微生物和其他活细胞中合成某些生物分子(主要是蛋白质、多肽)变得越来越高效且适合工业化生产。这些进步以及随后的创新,帮助生物制剂将“势力”扩展到很多小分子药物无能为力的疾病治疗领域。除了多肽(也有一些标准将某些短肽归类于小分子药物)和抗体等治疗性蛋白质外,生物制剂主要还包括:基于核酸的疗法(例如:RNAi、基因疗法、基因编辑)、血液成分、细胞和组织疗法(例如:CAR T细胞疗法、同种异体移植)等等。
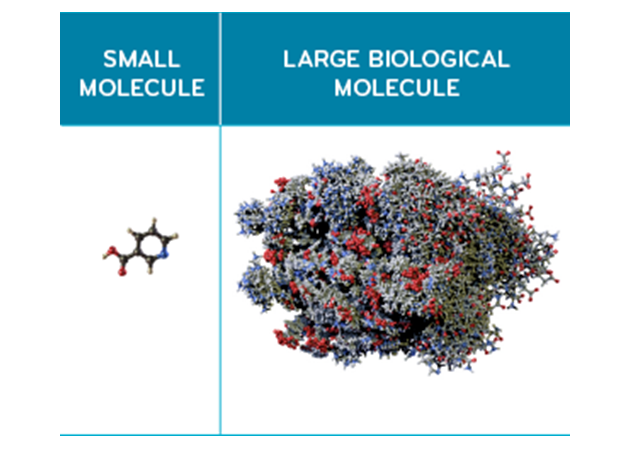
小分子与生物大分子。图片来源:Prime Therapeutics

面对一种适应症,应该选择小分子药物还是开发生物制剂,这是很多制药公司如今在药物开发项目中所要回答的第一个问题。小分子和生物制剂之间的选择取决于所治疗的疾病、预期的作用机制、给药途径和其他实际考虑因素。例如,小分子通常用于治疗高血压或糖尿病等疾病,首选口服给药,而生物制剂通常用于治疗癌症或自身免疫性疾病等疾病,其中特定分子的精确靶向至关重要。在许多情况下,决策也可能涉及小分子和生物制剂的结合以优化治疗。
物理化学性质的区别
小分子药物和蛋白质在多种性质上有很大不同,根源在于它们不同的理化性质,不仅影响药物的药理学方面(如作用机制、药效学、药代动力学),还影响安全性和有效性,甚至影响产品制造和关键质量特征(critical quality attribute, CQA)。
与生物制剂相比,小分子药物是相对简单的化合物,通常通过化学合成的手段进行工业生产。这些化合物通常由 20 到 100 个原子组成,分子量通常小于 1000 g/mol。小分子的药理活性、稳定性和渗透性在很大程度上取决于化学而不是结构相互作用。由于它们的特性,包括药代动力学特性,小分子药物可以通过多种途径给药,包括口服。它们的口服生物利用度要明显优于生物制剂(包括治疗性蛋白质、多肽、再到更大的蛋白质,如单克隆抗体)。即使这些生物制剂分子中最小的分子也比大多数小分子药物大,它们通常每个分子包含 5,000 到 50,000个原子。蛋白质大分子可以折叠成独特的三级结构甚至四级结构,这些结构是其生物活性不可或缺的一部分。
治疗性蛋白质通常呈极性,对热敏感,不可渗透细胞膜,并且容易被酶降解,单克隆抗体往往相对更稳定。与许多小分子药物不同,治疗性蛋白质一般没有口服活性,因此需要全身给药途径(例如注射)。在开发治疗中枢神经系统疾病的疗法时,考虑分子的理化特性尤为重要。由于大部分药理学靶标处于血脑屏障之外,因此这些靶标可能无法被较大的极性分子接近。尤其是血脑屏障的存在,阻止大分子量化合物的通过。这种限制为需要通过血脑屏障给药的药物开发造成了极大的挑战,限制了绝大多数的小分子药物和几乎全部的生物制剂。因此,在药物开发的最初阶段,必须仔细考虑产品设计,否者很可能造成缘木求鱼的关键错误。
药效学的区别
小分子药物和生物制剂之间的另一个主要区别在于这些药物与其靶标相互作用的方式及其对身体的影响,也就是药效学(pharmacodynamics)。治疗性蛋白质药物往往比小分子药物表现出更高的选择性和特异性,脱靶效应较低。这个区别对于药物的药效学来说非常关键,因为特异性将直接影响药物的安全性。
小分子药物旨在与全身细胞外或细胞内区域的各种靶标,包括G 蛋白偶联受体、配体门控离子通道(Ligand-gated ion channel, LGIC,亦称离子受体)和受体酪氨酸激酶等结合。此外,小分子可以通过单纯的物理相互作用干预生物过程。然而,由于小分子药物缺乏许多生物制剂的高特异性,小分子与受体之间缺乏特异性的结合,有可能引起脱靶效应。这意味着小分子药物可以以意想不到的、尤其是人们不期望的方式与组织、细胞和细胞成分相互作用。尽管有时脱靶效应可能相对无害,但通常会导致不良影响。这也解释了为什么小分子药物的损失率(attrition rate)较高的原因。很多小分子药物无法通过I期临床试验,就是因为它们的安全性相对较低。
虽然治疗性蛋白质的化学部分本身通常不会引起不良反应,但这些分子并非没有风险。它们也可能会阻碍重要的生理功能,并导致与免疫原性、细胞因子释放综合征、脑病等相关的罕见但却危及生命的不良事件。
药代动力学的区别
无论给药途径如何,一旦药物进入体内,它的命运(包括能否顺利抵达靶标)就取决于它与各种酶和其他蛋白质、组织、细胞及其成分的相互作用。虽然一些药物在局部起作用并且不会被吸收到全身循环中,但大多数药物需要吸收到血液中才能产生药理作用。当药物分子被吸收到血液中后,这些分子通过体循环分布到各种器官和组织,在那里它们与细胞成分相互作用,随后被分解(代谢)和消除。除了血液之外,淋巴系统也参与了药物循环过程。这种更缓慢的循环系统(比血液慢约 100-500 倍)对于那些具有较大分子量(>10 kDa)的药物,或者通过与大分子载体(例如纳米颗粒、聚合物、脂质体)结合靶向淋巴系统的小分子药物,或者一旦进入体内就与内源性大分子(例如脂蛋白和蛋白质)结合的物质尤为重要。较大的治疗性蛋白质通过血液和淋巴系统分布,并通过对流传输、受体介导的内吞作用、吞噬作用和液相胞饮作用的方式实现跨细胞移动。因此与小分子药物相比,这些大分子显示出截然不同的药代动力学特征。这些差异包括更长的半衰期、更有限的分布体积以及更长的时间来达到峰值浓度。由于与受体的高亲和力相互作用,治疗性蛋白质的消除与结合效率直接相关,这也称为靶标介导的药物处置(target-mediated drug disposition)。与内源性底物一样,治疗性蛋白质会被蛋白酶和肽酶分解成氨基酸。这些氨基酸中的大部分随后被人体循环利用,其余的(<70 kDa)被分泌到胆汁中并排泄到粪便中或被过滤到尿液中并最终被消除。相比之下,几乎所有小分子都被非目标器官清除,通过细胞色素 P450 (CYP 450)代谢,或通过身体其他部位的一些其他过程代谢,或通过肾脏,或通过胆汁或粪便排泄。
药物相互作用
在任何药物的开发过程中都应考虑药物相互作用的可能性,尤其是在为特定人群(例如,老年人、肝/肾功能不全)调整剂量时,药物-药物相互作用可能引发的不良反应对于药品安全极其重要。治疗性蛋白质的药物相互作用较少,因为它们以与内源性分子相同的方式进行代谢和消除。然而,新型治疗性蛋白质的药物相互作用也不应忽略,尤其是当分子影响代谢酶的表达时(例如,细胞因子介导的药物代谢酶变化)。
药物开发挑战
人们对于生物制剂常见的误解之一,是生物制剂通常由活细胞产生因而在某种程度上更“天然”,故而不需要比小分子更严格的测试。但事实上,对于治疗性蛋白质,质量控制措施通常应更加严格,以避免在制造过程中引入可能的错误。潜在的错误包括官能团的变化,如意外的糖基化、甲基化或磷酸化,或可能改变分子在体内活性的结构变化。免疫原性也是关乎生物制剂安全性和有效性绕不开的考虑内容。这些分子的物理化学特性(包括它们的大尺寸),可以引起快速和级联的免疫反应,从而导致严重的药物不良反应。因此,必须在给药后仔细监测患者。为了降低免疫原性风险,治疗性蛋白质可以在治疗期间与免疫抑制剂(它们自身也存在安全风险)一起使用。每当提供伴随药物时,还必须考虑药物相互作用的可能性。对于更复杂的分子和分子构建体(例如:抗体-药物偶联物、双特异性或修饰蛋白)或通过新型给药途径递送的分子和分子构建体(例如:口服或吸入肽)尤其如此。然而,通过合理的药物开发和风险评估,这些挑战可以预先有效地克服。
小分子与生物制剂中的“王者”
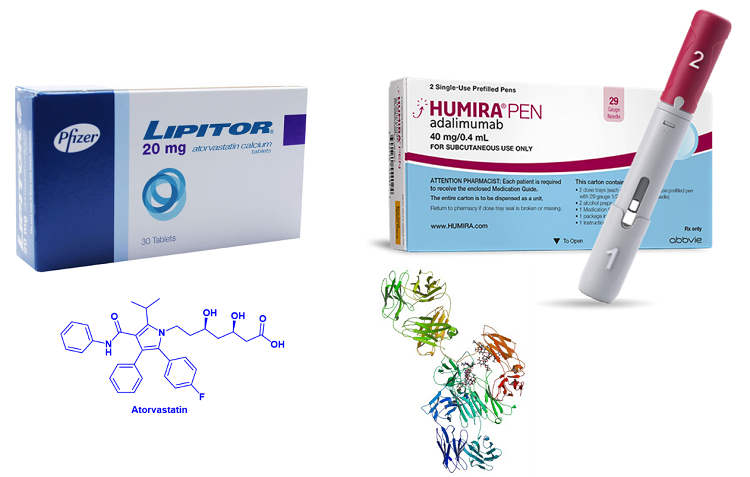
辉瑞的Liptor(立普妥)是小分子药物销售领域无可争辩的王者,它的有效成分为atorvastatin(阿托伐他汀)。阿托伐他汀属于他汀类药物的药物。阿托伐他汀主要用于降低血液中的胆固醇水平,特别是低密度脂蛋白胆固醇(LDL-C),通常被称为“坏”胆固醇。它用于管理和降低患有高胆固醇血症和其他危险因素的个体患心血管疾病的风险,包括心脏病发作和中风。2006年Liptor创造了年销售量160亿美元的记录。在专利流失后的2011 年,Liptor仍创造了约 100 亿美元的亮眼成绩,不过,随后在 2012 年大幅下降至 40 亿美元。到现在,Liptor仍然能创造出每年超过10亿美元的销售额。
当今的药王之王,暂时属于AbbVie的修美乐,尽管它很有可能被Keytruda在今年年底取代,后者2023年的预计销售额为240亿美元(Evaluate数据)。修美乐的活性成分是阿达木单抗(adalimumab)。阿达木单抗是一种肿瘤坏死因子(TNF)抑制剂,被归类为缓解病情抗风湿药(DMARD)。但实际上它用于治疗多种自身免疫性疾病和炎症,包括类风湿关节炎、幼年特发性关节炎、银屑病关节炎、强直性脊柱炎、克罗恩病、溃疡性结肠炎、斑块状银屑病、化脓性汗腺炎、非感染性葡萄膜炎等。修美乐2022年的销售额为212.4亿美元,仅次于Pfizer/BioNTech的Covid-19疫苗Comirnaty。
总结
由于突破性的新疗法和人口老龄化,小分子药物和生物制剂的市场都在不断增长。两者在治疗疾病方面都有一席之地,正可谓“梅须逊雪三分白,雪却输梅一段香”。小分子药物目前更稳定,更容易给药,而生物制剂在解决难以治疗的疾病方面更有希望。
虽然生物制剂面临许多挑战,尤其是在稳定性和复杂性方面,但研究人员和科学家的创新应该可以逐步应对这些挑战。很多以前无法攻克的疾病,在小分子药物无能为力的情况下,新兴的生物药物则提供了新的希望。
生物制剂也代表了制药公司的可靠投资方向,它们的成本和开发时间与小分子药物相当,并且对于仿制药制造商的竞争门槛也比较高,这意味着制药公司可以期待在未来多年内都可获得丰厚的投资回报。
参考资料:
Points to Consider in Drug Development of Biologics and Small Molecules. Allucent. 13, 05, 20
Beck, H. Small molecules and their impact in drug discovery: A perspective on the occasion of the 125th anniversary of the Bayer Chemical Research Laboratory. Drug Discovery Today. 2022. 27, 1560-1574.
Liu, A. Top 10 all-star drugs in 2024: Humira's captain, but who else makes the roster? FiercePharma. 15. 08. 2019.
Worldwide revenue of Pfizer's Lipitor from 2003 to 2019. Statista.
Urquhart, L. The biggest-selling drugs of 2023. Evaluate. 05. 01. 2023.
(本文由北纬55°供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号