一款改良的新型自组装小分子肿瘤疫苗佐剂
美国食品药品监督管理局于2010年批准了一款针对转移性前列腺癌的治疗性癌症疫苗。然而,临床疗效仍然有限,最可能的原因是免疫抑制的肿瘤微环境。诱导有效的抗肿瘤免疫应答仍然是治疗性肿瘤疫苗开发领域的主要挑战。为了增强抗原的免疫原性,佐剂通常被添加到疫苗中以产生强大而持久的适应性免疫应答。过去的癌症疫苗通常是使用含有细菌细胞壁衍生的脂多糖或其衍生物作为佐剂,这大大增加了生产难度和潜在的毒性隐患。疫苗佐剂如何在保持固有免疫刺激效应的同时避免生产难度和毒性一直是一个挑战。
基于此,京都大学上杉志成教授、清华大学李艳梅教授、东京大学石井健教授和日本国立感染症研究所水上拓郎研究员团队近日合作在Journal of Medicinal Chemistry 杂志在线发表了最新研究成果。该课题组前期筛选得到的一种自组装小分子佐剂化合物cholicamide(Angew. Chem., Int. Ed. 2021, 60, 1115 961−969.),其自组装特性使得这种简单的分子能够通过TLR7受体增强免疫应答。以该化合物为先导化合物,通过改变脱氧胆酸和胆酸及连接臂的长度,得到12个cholicamide衍生物。并最终得到了化合物cholicamideβ。
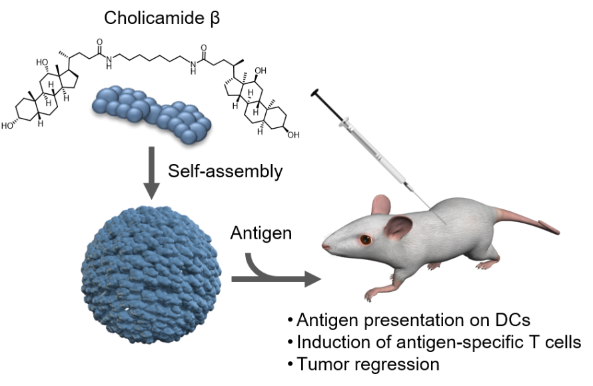
图1. 自组装小分子癌症疫苗佐剂cholicamideβ
相比于母体化合物cholicamide,cholicamideβ是一种更安全小分子自组装佐剂。Cholicamideβ作为疫苗佐剂使用时,可有效刺激抗原呈递细胞,诱导抗原特异性T细胞活化。此外,Cholicamideβ可以保护小鼠免受恶性肿瘤细胞的攻击,且没有明显的毒性。因此,Cholicamideβ可能是一类潜在的、新型的自组装小分子佐剂。
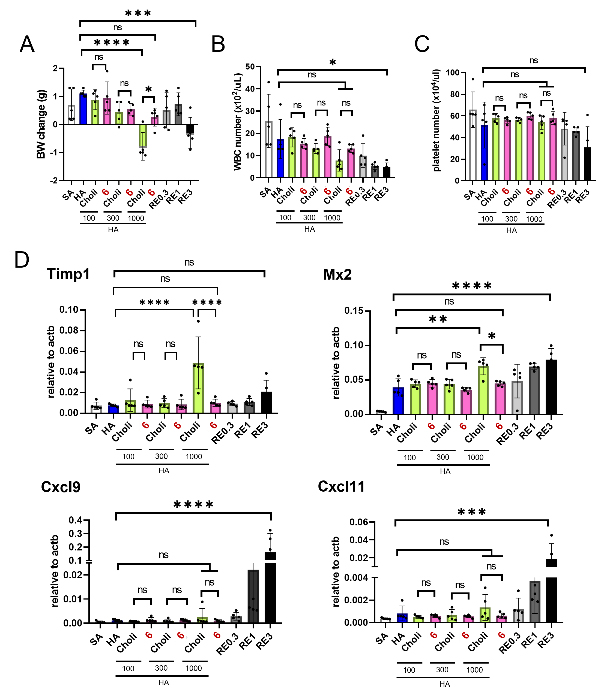
图2. 安全性评价。(A-C) 对体重(BW)、白细胞(WBC)和血小板数量的影响。(D) 安全性生物标志物基因 (Timp1、Mx2、Cxcl9、Cxcl11) 在肺组织中的表达分析。
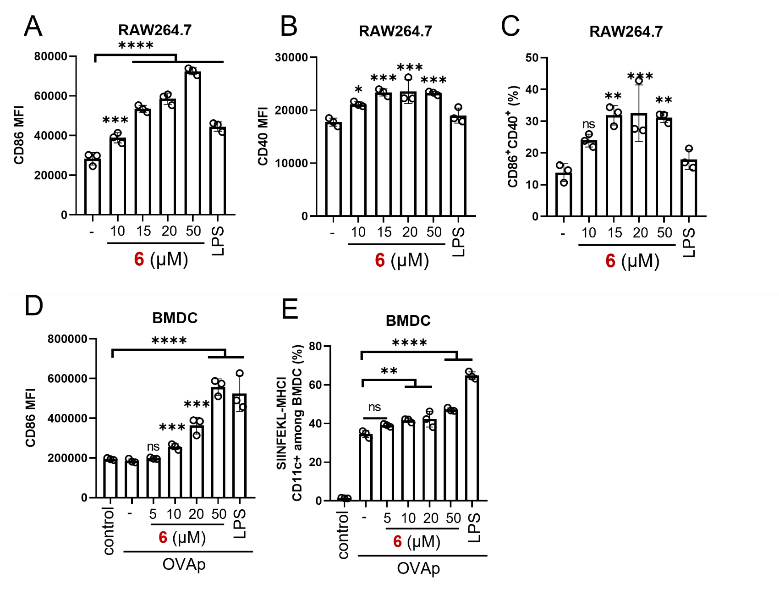
图3. 体外评估抗原呈递细胞的成熟水平和抗原呈递能力。(A-B) 流式细胞术检测RAW264.7细胞表面CD86和CD40的表达强度。(C) RAW264.7细胞表面CD86+CD40+双阳性细胞的比例。(D) BMDCs细胞表面CD86荧光强度统计。(E) BMDCs上的OVAp-MHC-I复合物的比例。
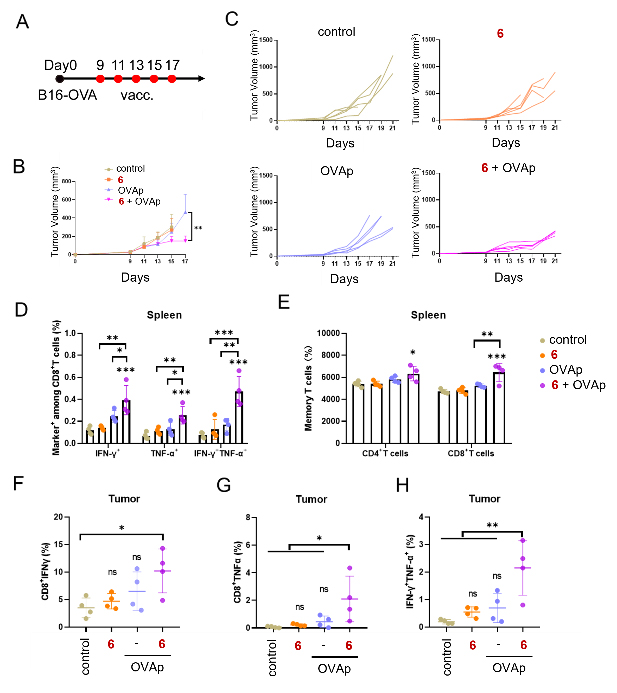
图4. 评价cholicamideβ抗肿瘤能力。(A)B16-OVA黑色素瘤治疗模型。(B-C)肿瘤生长曲线 (D-E)三次免疫后脾脏的免疫应答。(F-H)肿瘤微环境中抗原特异性T细胞响应情况。
京都大学上杉志成教授、清华大学李艳梅教授、东京大学石井健教授和日本国立感染症研究所水上拓郎研究员为该论文共同通讯作者。清华大学化学系博士研究生卓少华、京都大学Naotaka Noda博士和京东大学Kou Hioki博士为共同第一作者。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Identification of a Self-Assembling Small-Molecule Cancer Vaccine Adjuvant with an Improved Toxicity Profile
Shao-Hua Zhuo, Naotaka Noda, Kou Hioki, Shuyu Jin, Tomoya Hayashi, Kou Hiraga, Haruka Momose, Wen-Hao Li, Lang Zhao, Takuo Mizukami*, Ken J. Ishii*, Yan-Mei Li*, and Motonari Uesugi*
J. Med. Chem., 2023, DOI: 10.1021/acs.jmedchem.3c01252
导师介绍
上杉志成
https://www.scl.kyoto-u.ac.jp/~uesugi/
李艳梅
http://lym.chem.tsinghua.edu.cn/
石井健
https://researchmap.jp/read0118835/?lang=english
水上拓郎
https://nrid.nii.ac.jp/nrid/1000060415487/
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号