上科大杨晓瑜课题组Nat. Commun.:通过不对称亲电胺化反应实现取代氨基[2.2]对环番化合物的动力学拆分
[2.2]对环番化合物(PCP)于1950年左右被首次发现,由于其独特的结构以及特殊的光物理和光化学性质,引起了化学家的广泛兴趣。取代的[2.2]对环番化合物(PCP)具有有趣的平面手性,其骨架可作为手性催化剂和手性配体,同时也广泛应用于材料科学中(图1a)。其中取代氨基[2.2]对环番化合物(PCP)是一种重要的取代[2.2]对环番化合物(PCP),在各个领域都有许多应用,其可以作为平面手性双硫脲催化剂、N-杂卡宾(NHC)配体、热激活延迟荧光(TADF)以及圆偏振发光(CPL)发射体等。
然而获得对映体纯的[2.2]对环番化合物(PCP)在有机合成中仍然是一个巨大的挑战,现在很大程度上仍然依赖于手性色谱分离或通过与手性试剂形成非对映体盐或共价加合物的经典化学拆分。催化动力学拆分(KR)已成为提供对映体富集分子的一种有吸引力和实用的方法,在学术界和工业界都有广泛的应用。在过去的二十年里,已经开发了许多可行的催化动力学拆分方法来获得手性PCP衍生物,包括PCP骨架二卤化物的不对称C-N偶联,PCP骨架二酚衍生物的酯化和水解反应,PCP骨架的醛和酮的还原以及PCP骨架亚胺的还原/加成反应等(图1b)。尽管取得了这些进展,但这些方法中仍然存在一定的局限性,包括KR效果不令人满意、底物范围有限以及难以同时获得高ee值的平面手性PCP衍生物的原料和产物。据文献调研可知,氨基[2.2]对环番化合物(PCP)的催化动力学拆分目前还未被报道,这些有价值的手性骨架只能通过已知手性PCP衍生物的化学拆分和衍生化得到。
上海科技大学杨晓瑜(点击查看介绍)课题组近年来开发了一种高效的动力学拆分方法,通过利用手性磷酸(CPA)催化芳胺与商品化偶氮二羧酸酯的不对称胺化反应,对具有点手性(Angew. Chem. Int. Ed. 2021, 60, 5268; ACS Catal. 2021, 11, 8443) 和轴手性 (Angew. Chem. Int. Ed. 2020, 59, 23598) 的芳基胺进行动力学拆分。同时该方法也被应用于具有轴手性的二芳基醚的去对称反应(Angew. Chem. Int. Ed. 2023, 62, e202300481)和平面手性大环的不对称构建之中(Angew. Chem. Int. Ed. 2022, 61, e2022010)。近期,杨晓瑜课题组报道了通过CPA催化的不对称芳香胺化方法,实现了各种取代氨基[2.2]对环番化合物(PCP)的高效动力学拆分,其中取代的氨基[2.2]对环番化合物(PCP)的两种对映异构体可以通过C-H胺化产物的简单衍生而轻易的获得(图1c)。
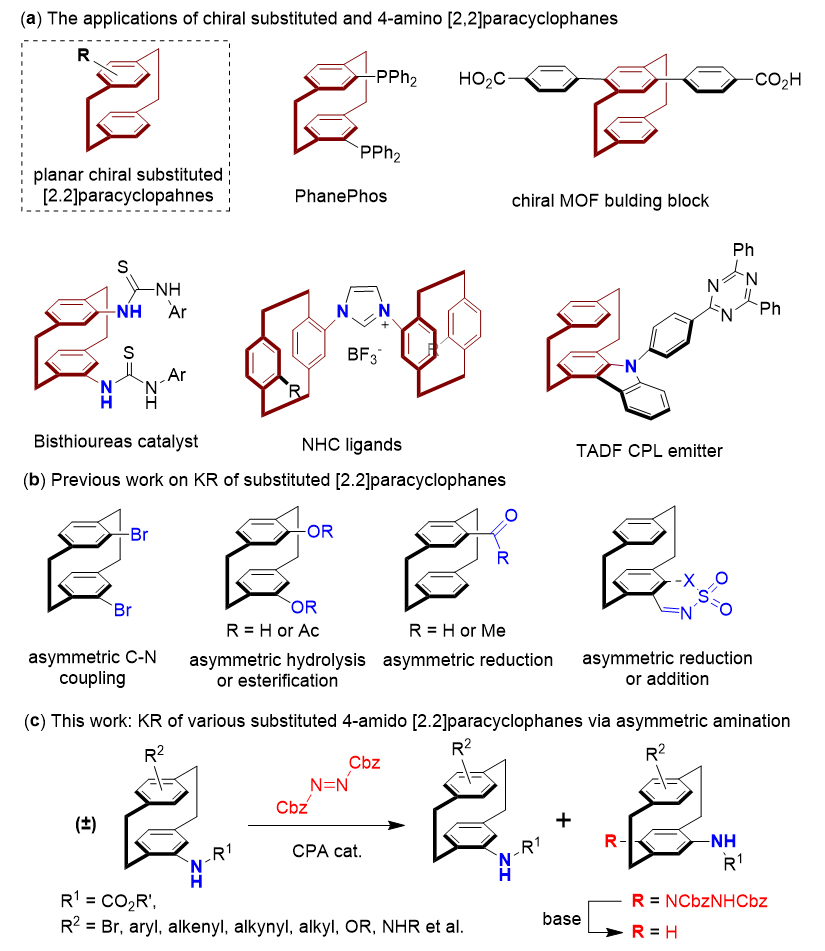
图1. 取代[2.2]对环番化合物的动力学拆分
作者选择外消旋的4-NHBoc取代[2.2]对环番化合物1a作为标准底物进行条件的筛选,通过条件的筛选,最优的条件的是以CPA A5(0.1 当量)作为催化剂,CCl4作为溶剂,偶氮二甲酸二苄酯(0.75 当量)作为亲电试剂,可以以93% ee得到C-H胺化产物和98% ee回收原料,对应的选择性因子(s)是127。当得到最佳动力学拆分(KR)条件后,作者研究了取代的氨基[2.2]对环番化合物(PCP)的底物范围(图2)。作者很高兴地发现在这个反应中,各种N-烷氧羰基都能很好地耐受,而且各种二取代氨基[2.2]对环番化合物(PCP)无论是假同位、假邻位、假间位,还是假对位也都有非常不错的效果。此外,使用该方法,通过适当改变反应条件,非手性假对位取代的二取代氨基PCP 4a底物也可以通过去对称化反应以40%的产率99%的ee值获得预期的C-H胺化产物5a。

图2. 取代[2.2]对环番化合物的动力学拆分底物范围
为了阐明反应的详细机理,作者做了一系列的控制实验(图3)。用标准的KR条件处理N-Boc-N-Me-取代的酰胺基PCP 6a未能提供所需的C-H胺化产物,这表明底物中的N-H部分在该反应中起着关键作用(图3a)。令人惊讶的是,2,5-二甲基取代的N-Boc苯胺6b,一种1a的简化非环番类似物,也发现在标准KR条件不反应,这表明[2.2]对环番化合物的环番骨架在该反应中起到不可或缺的作用(图3b)。此外,作者还尝试了除了N-烷氧羰基之外的其他N-取代基底物的KR反应,但都给出不佳的动力学拆分效果(图3c)。这些结果表明,PCPs N上的取代基在这些KR反应中对反应的高立体选择性起到至关重要的作用。N-未取代的4-氨基[2.2]对环番化合物6g也在标准条件下进行了动力学拆分实验,令人惊讶的是,24小时后没有产生预期的C-H胺化产物7g,而是得到了氨基直接进攻偶氮二羧酸酯的三氮烷产物8g,而三氮烷产物8g和回收的6g都是以低的对映选择性获得的(图3d)。有趣的是,将温度提高到20°C并将反应时间延长到48小时,得到8g和预期的C-H胺化产物7g的混合物。此外,在底物的筛选过程中,当在−10°C下进行反应时(与底物表中的0°C相比较),假间位取代的酰胺基PCPs的KR反应中也产生了大量具有高对映选择性的三氮烷产物8(图3e)。通过手性HPLC仔细监测该反应的过程,三氮烷8x实际上是首先形成的,然后缓慢转化为C-H胺化产物3x。为了研究8x和3x之间的转化,进行了几个控制实验。在没有CPA催化剂的情况下,没有观察到8x和3x之间的转化;用(R)-A5催化剂催化外消旋三氮烷8x的动力学拆分反应,可以得到25% ee值的3x和63% ee值的8x,对应于2.9的s选择性因子(图3f)。这些结果表明,CPA催化的从8x到3x的重排不是KR反应中主要的立体选择性步骤。为了进一步阐明这种肼转移反应,作者进行了交叉实验。将外消旋三氮烷8x和酰胺基PCP 1a以1:1混合置于标准条件下,得到产率为43%的C-H胺化产物3x,ee值为32%,回收的8x产率为43%,ee值为34%(s = 2.6,图3g)。值得注意的是,没有检测到自1a衍生的C-H胺化产物3a,这意味着肼转移反应通过分子内方式进行。基于这些结果,提出了这种KR反应的合理反应机理(图3h)。在CPA催化下的酰胺基直接进攻偶氮二羧酸酯(形成三氮烷8),这一步被认为是立体选择性决定步骤,通过CPA催化剂对底物和偶氮二羧酸酯之间进行双氢键活化。(Sp)-酰胺基PCP 1是动力学上有利的对映体。酸促进的肼从酰胺基到对位的转移被认为是通过para-semidine-type重排进行的,可能是分步的双N[1,3]σ迁移或一步的N[1,5]σ迁移。在大多数情况下,重排步骤比三氮烷的形成更快,所以不能检测到相应的三氮烷中间体。然而由于苯胺对位附近的空间位阻,对于假间位和假对位取代的酰胺基PCPs,重排步骤比初始三氮烷形成步骤慢,导致检测到三氮烷8。
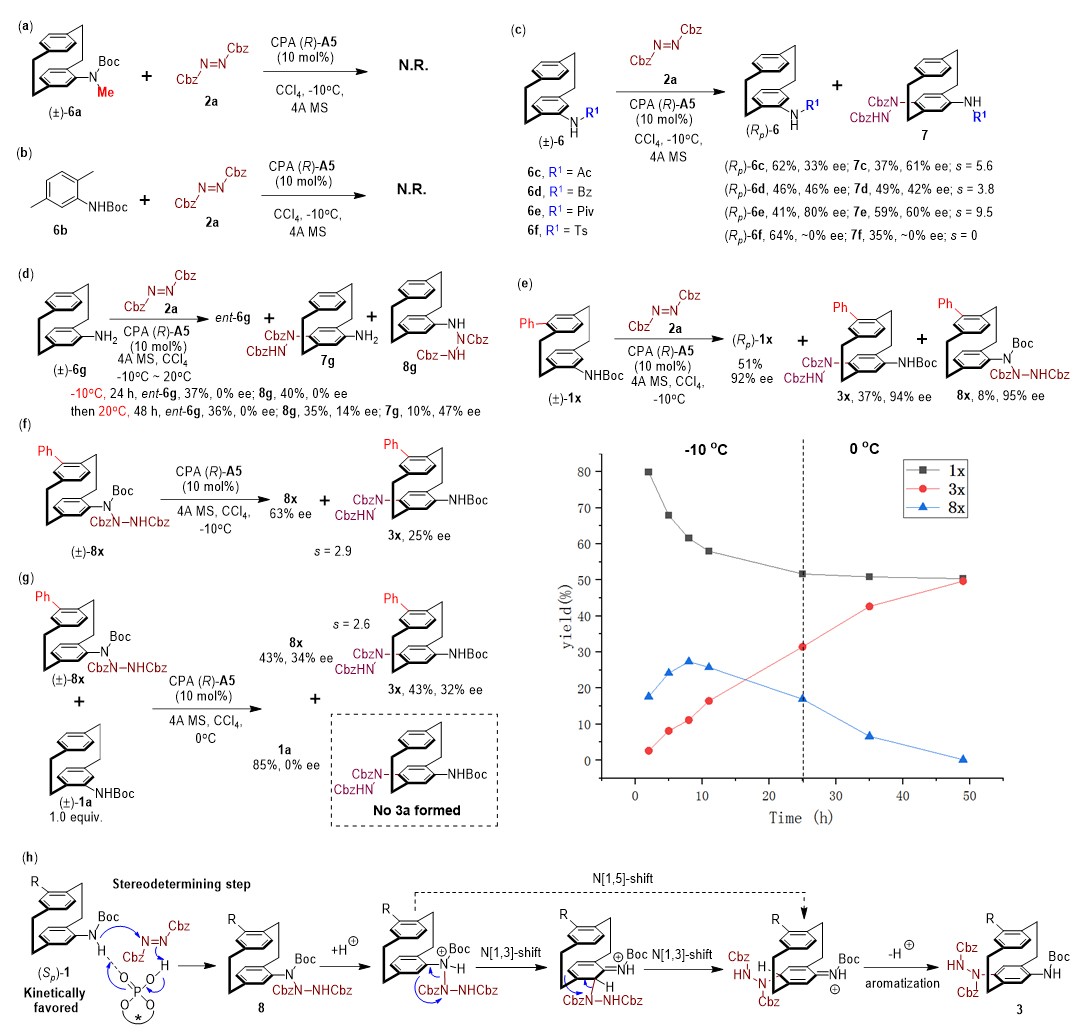
图3. 实验机理研究和假定的反应机理
为了证明该方法的实用性,使用标准条件进行外消旋体1a(2.0 mmol)的大规模KR,仍能获得相同的动力学拆分效果(图4a)。作者对这些平面手性产物的衍生化进行了研究,以展示该方法的实用性。首先,对C-H胺化产物的衍生化进行了考察。用强碱性条件处理3a,可以容易地脱除肼部分,并以94%的产率和94%的ee值得到(Sp)-1a(图4b)。此外,3a中的取代肼基通过简单的催化氢化很容易转化为NH2(9a),而9a与异硫氰酸酯反应可以得到伯胺硫脲型衍生物10a,其进一步与异硫氰酸酯反应可以得到平面手性双硫脲衍生物11a。此外,用NaNO2和KI处理9a得到了对碘酰氨基PCP 12a,它也是可用于进一步衍生的平面手性砌块。接下来,作者还研究了回收的手性酰胺基PCPs产物的衍生化(图4c)。将假同位Br取代的酰胺基PCP(Sp)-1f的N-保护基从Boc变成Piv基团后,进行NHPiv基团导向的sp2-C–H硼化反应。在脱除(Sp)-1f的N-Boc基团后,用乙酰丙酮进行Combes喹啉合成,可以得到相应的含喹啉的PCP衍生物15f;用Pd催化的(Rp) -1a与NIS的对位碘代反应可以得到16a,这也是12a的对映异构体。此外,在脱除Boc之后,苯胺部分与乙二醛二甲基缩醛、甲酸和苄基异氰的四组分反应可生成含吲哚环的PCP衍生物17a。最后,作者还探讨了这些平面手性胺基PCP骨架在手性有机催化剂开发中的应用,分别合成非对映异构体叔胺硫脲双功能催化剂19a和20a。这两种化合物,以及市售的手性叔胺硫脲催化剂(24a和24b),被用来催化2-苯并噻唑亚胺21a与邻苯二甲酸酐22a的不对称[4+2]环化反应(图4d)。其中由(1R, 1S, Rp)-19a催化的反应能获得最优的结果,优于具有非手性苯胺部分(24a和24b)的催化剂以及其差向异构体(1S, 2S, Rp)-20a。
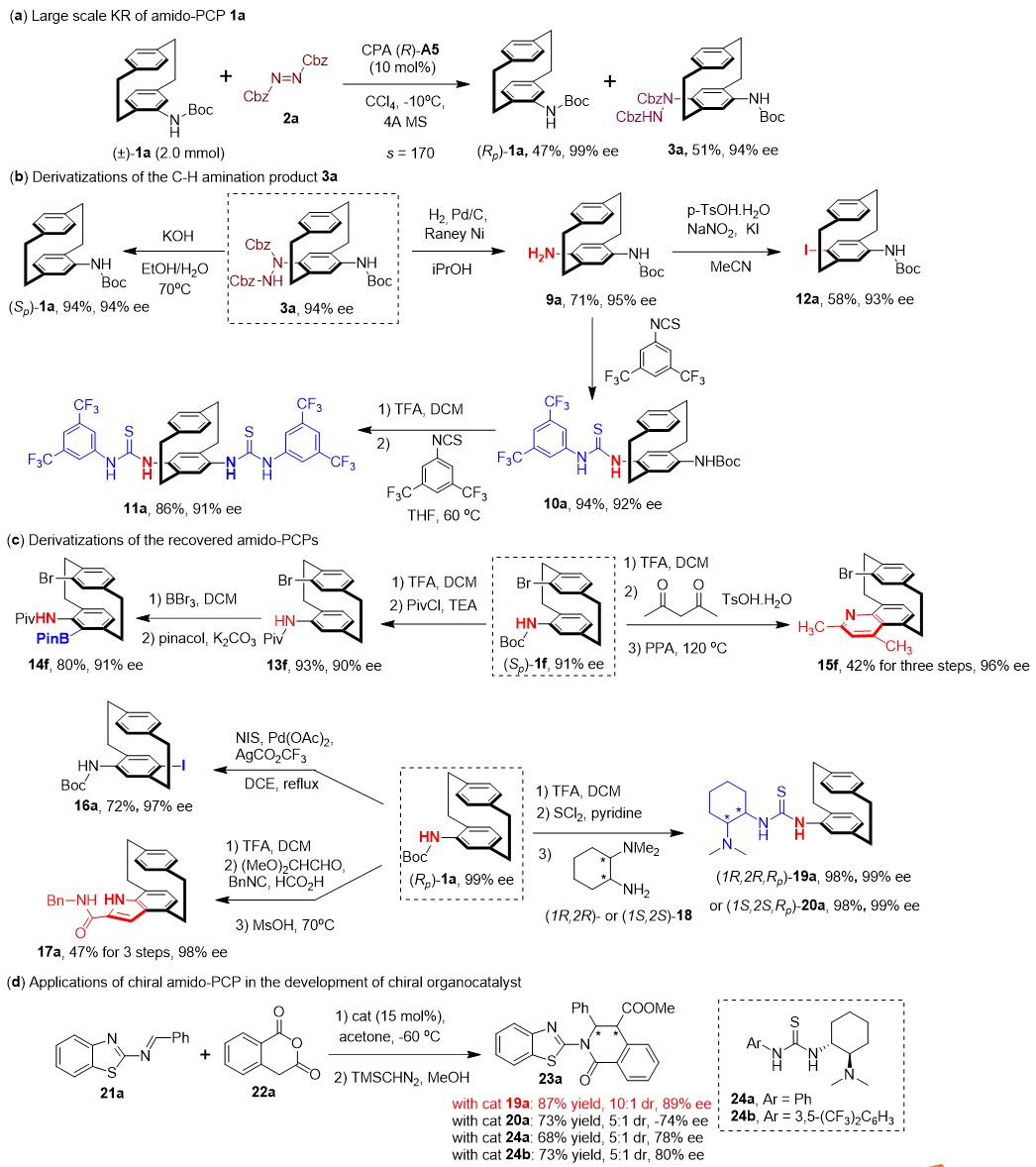
图4. 放大反应和手性产物的转化研究
总结
杨晓瑜课题组报道了通过CPA催化芳胺的不对称C-H胺化方法,实现了各种取代氨基[2.2]对环番化合物(PCP)的高效动力学拆分(KR),包括具有假同位、假邻位、假间位和假对位二取代环番化合物的底物(PCP)。此外该反应还适用于非手性二酰胺PCP底物的去对称化反应。详细的实验研究揭示了芳香亲电C-H胺化反应的一种新的反应机理,包括依次形成三氮烷和N[1,5]-重排过程,以CPA催化的酰胺基与偶氮二羧酸酯的直接加成为立体决定步骤。大规模的KR反应,以及回收的手性起始材料和C-H胺化产物的衍生显示了该反应的应用潜力。
该研究成果近期发表在国际学术期刊Nature Communications (《自然·通讯》)上。杨晓瑜课题组21级博士研究生俞少泽为本文第一作者,21级硕士研究生包晗阳和20级博士研究生张得坤参与了部分工作,上海科技大学为本论文第一完成单位,杨晓瑜教授为本文通讯作者。以上工作都得到国家自然科学基金委、上海科技大学双一流学科科研导向基金和上海科技大学科研启动资金的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Kinetic resolution of substituted amido[2.2] paracyclophanes via asymmetric electrophilic amination
Shaoze Yu, Hanyang Bao, Dekun Zhang & Xiaoyu Yang
Nat. Commun., 2023, 14, 5239, DOI: 10.1038/s41467-023-40718-8
导师介绍
杨晓瑜
https://www.x-mol.com/groups/Yang_Xiaoyu
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!












































 京公网安备 11010802027423号
京公网安备 11010802027423号