海洋生物碱Lepadin E 和Lepadin H诱导肿瘤铁死亡
铁死亡(ferroptosis)是一种新发现的铁依赖性程序性细胞死亡形式,这一概念是在2012 年Dixon 等人提出来的。铁死亡的特征是致命的磷脂氢过氧化物 (PLOOH) 的过度积累,导致细胞结构破坏,包括线粒体收缩和细胞膜穿孔。谷胱甘肽 (GSH) 耗尽和/或细胞内不稳定铁和铁依赖性活性氧 (ROS) 水平增加很容易触发铁死亡过程。大量研究表明,铁死亡在许多癌症疾病的发生和发展中发挥着关键的调节作用,诱导铁死亡能够逆转癌症对化疗、靶向治疗和免疫治疗等常见疗法的耐药性,因此,诱导肿瘤铁死亡是一种有效的治疗策略。尽管越来越多的研究文章和综述对铁死亡的机制进行详细的阐述和总结,但铁死亡诱导剂的开发进展相当缓慢,很少有药物能够进入癌症治疗的临床试验和实践。近日,香港科技大学童荣标(点击查看介绍)和北京大学/深圳湾实验室罗佗平(点击查看介绍)课题组联合报告了一种海洋生物碱 lepadins E和H作为一类新型的铁死亡诱导剂,通过抑制经典的xCT-GPX4途径来诱导肿瘤细胞铁死亡。
在前期的工作中,童荣标课题组完成了化学合成多种lepadin家族分子。在这项研究中,作者对合成的天然产物样品进行细胞毒性体外实验,发现其中lepadins E和H对10种人类癌细胞相对于正常细胞具有强的肿瘤细胞杀伤效果。进一步分析其构效关系表明,lepadins E和H的共轭酯作为Michael受体可能在其抑制肿瘤细胞的过程中发挥重要作用(图1)。
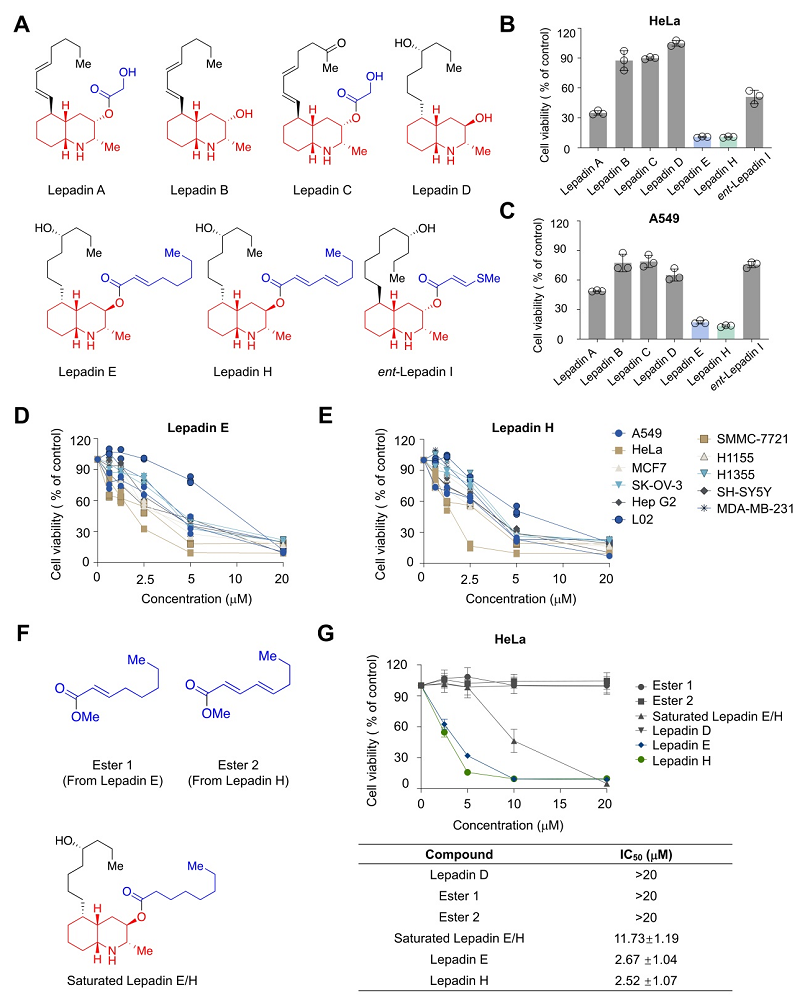
图1. Lepadins E 和 H 抑制肿瘤细胞系的增殖
进一步的体外细胞实验表明Lepadins E 和 H可诱导细胞周期停滞,可引起p53 表达升高。用p53 抑制剂显著抑制了lepadins E 和 H诱导的细胞死亡,证实 p53 在lepadins E 和 H诱导的细胞周期停滞中的重要作用(图2)。
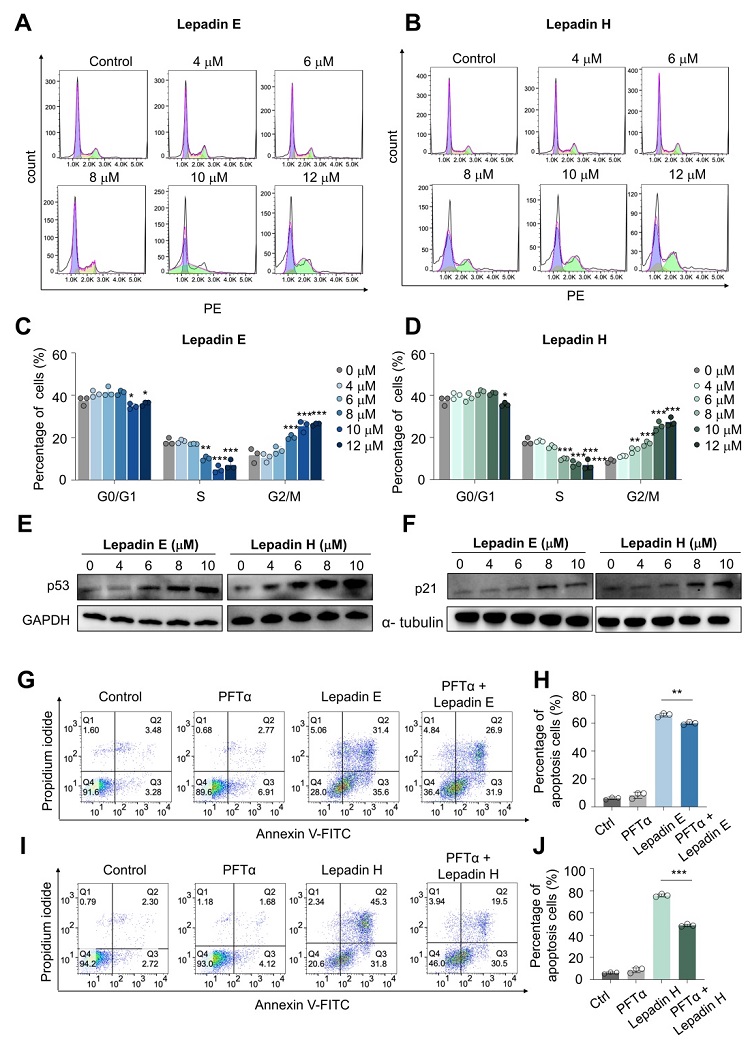
图2 Lepadins E 和 H 促进 p53 表达,导致细胞周期停滞和细胞凋亡
进入细胞周期会导致氧化 ATP 合成速率升高,从而产生副产物活性氧 (ROS),而ROS 的产生可以影响细胞存活或死亡的下游级联,从而参与抗肿瘤治疗的反应。在这项研究中, lepadins E和H显着增加ROS水平并诱导脂质过氧化。转录组和蛋白质组的KEGG通路分析也表明lepadin E和H处理诱导的差异基因和蛋白质显著富集于铁死亡通路。随后,课题组使用了去铁胺 (DFO) 和 Ferrostatin-1 (Fer-1),两种铁死亡抑制剂和分别lepadin E/H共处理,发现其可以大大降低lepadin E/H在肿瘤细胞中的细胞毒性。透射电子显微镜结果也表现出lepadin E/H处理后的细胞也表现出独特的铁死亡特征,包括线粒体体积减少、线粒体膜密度增加以及线粒体嵴消失。在蛋白质水平上,lepadin E/H下调 SLC7A11/GPX4的表达,增加了ACSL4 蛋白水平。这些发现无疑证实了lepadin E/H通过铁死亡过程的 SLC7A11-GPX4 途径诱导的肿瘤细胞死亡(图3)。
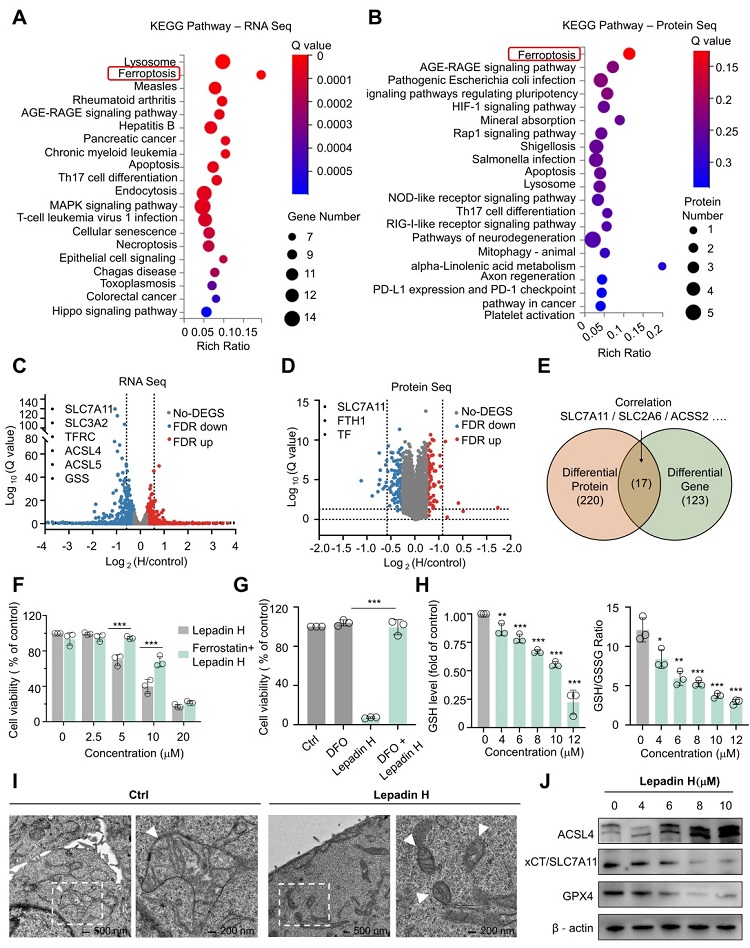
图3. Lepadin H 诱导 HeLa 细胞中的细胞铁死亡
最后作者通过小鼠模型评估了lepadin H的体内功效,发现lepadin H显著抑制了肿瘤生长,且没有观察到对主要器官的毒性作用。
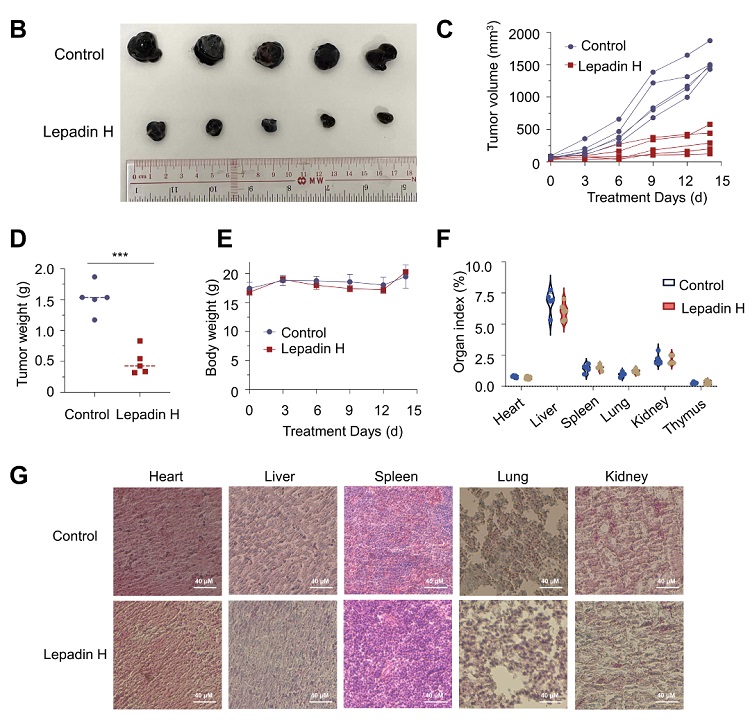
图4. Lepadin H显着抑制了小鼠肿瘤生长
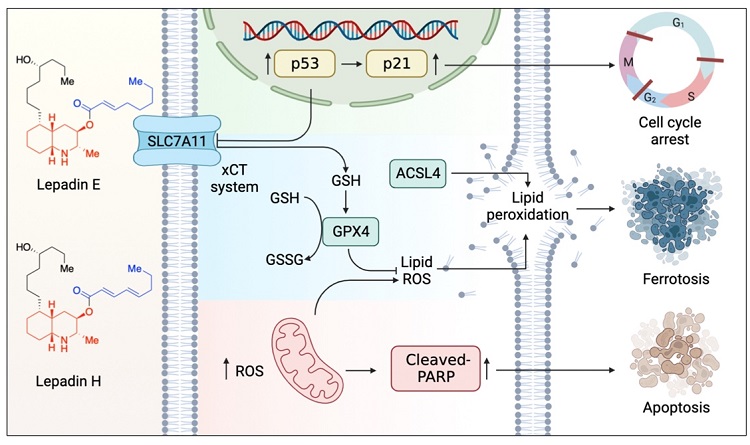
图5. Lepadins E 和 H 作用机制图
综上,童荣标和罗佗平课题组阐明了海洋生物碱lepadinsE和H的作用模式,并验证了它们作为一类新型铁死亡诱导剂的抗肿瘤效果,具有抗肿瘤的临床转化潜力(图5)。这一成果近期发表在Journal of Medicinal Chemistry 上,文章第一作者为香港科技大学和深圳湾实验室联合培养博士生王文君。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Marine Alkaloid Lepadins E and H Induce Ferroptosis for Cancer Chemotherapy
Wenjun Wang, Foqing Ma, Yuen Tsz Cheung, Guihua Zeng, Yiqin Zhou, Zijing Chen, Lixin Liang, Tuoping Luo*, and Rongbiao Tong*
J. Med. Chem., 2023, DOI: 10.1021/acs.jmedchem.3c00659
研究团队简介

童荣标,现任香港科技大学化学系副教授,博士生导师。1996-2003年于湖南大学化学化工学院学习并获理学学士与硕士学位。2003-2008年于美国艾莫莉大学(Emory University)化学系攻读博士学位,师从Frank E. McDonald教授研究聚环氧化合物的仿生环化反应并应用于天然产物的全合成(Abudinol),于2008年获得理学博士学位(化学)并获得杰出成果奖(Charles Lester Award)。2008-2011年在美国宾夕法尼亚大学(University of Pennsylvania)Amos B. Smith, III教授实验室从事博士后研究,发展了一系列的适用于三组分负离子接力化学(Anion Relay Chemistry)的关键连接子。他在2011年7月起任香港科技大学化学系助理教授, 2017年7月提升为副教授(长聘教授), 2023年7月晋升为正教授(长聘)。他曾获得Asian Core Program Lectureship Award,Young Career Focus及Thieme Chemistry Journal Award等荣誉,现在的主要研究兴趣在药物化学,绿色化学,和天然产物全合成等。
https://www.x-mol.com/university/faculty/7074

罗佗平,深圳湾实验室分子生理研究所合作研究员。2005年本科毕业于北京大学化学学院,2011年获美国哈佛大学化学博士,随后在美国H3 Biomedicine Inc.从事博士后研究,进行遗传医学导向的药物研发工作。2013年起,任北京大学化学学院特聘研究员、生命科学联合中心预备研究员(2016年转为研究员);2019年晋升为北京大学长聘副教授。获Thieme Chemistry Journals Award (2017)、国家优秀青年科学基金(2018)、第七届中国化学会-英国皇家化学会青年化学奖(2019)等资助和奖项。具体研究成果与论文请参见课题组主页(http://www.chem.pku.edu.cn/luotp/ )。
https://www.x-mol.com/university/faculty/8710
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号