脂质体-酶纳米ROS反应器用于抗肿瘤治疗
在细胞中,不同的酶被隔离在特定的细胞器和生物分子凝聚体中,为多步级联反应提供了一个受限空间,以实现高的反应效率和独立的生物过程。目前大多数研究都集中在用人工合成系统模仿自然界的腔室化策略上,来模拟基本的细胞结构和反应以及复杂的生物催化过程。然而,将这些合成系统用于真正的生物医学应用很少实现。
酶促反应可以消耗肿瘤的内源性营养物质或/和产生细胞毒性物质,因此可作为治疗恶性肿瘤的新型工具。目前作为酶促仿生封装系统的空心纳米容器的材料主要基于空心二氧化硅、合成聚合物、巨型单层囊泡和巨型内质网囊泡等,存在合成条件苛刻、操作困难、生物相容性差、和酶促效率低等问题。相比之下,脂质体具有良好的生物相容性和合适的尺寸效应,并已在临床实践中得到了广泛的应用。
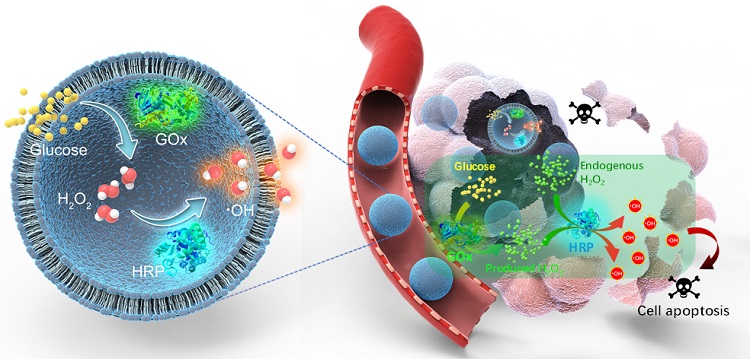
图1. 脂质体纳米反应器的组成和酶促级联反应(左)以及基于酶促级联反应的抗肿瘤治疗机制(右)。
基于以上背景,大连理工大学孙文教授联合中国海洋大学姜帅教授、德国马普高分子所Katharina Landfester教授等制备了基于脂质体的酶促纳米反应器(LNRs),模拟真核细胞器的结构和级联反应,用于抗肿瘤治疗(图1)。纳米反应器由葡萄糖氧化酶(GOx)和辣根过氧化物酶(HRP)组成,两种酶在脂质体中的共包覆创造了一个受限的微环境,增加了局部H2O2浓度,从而提高了串联反应的效率。
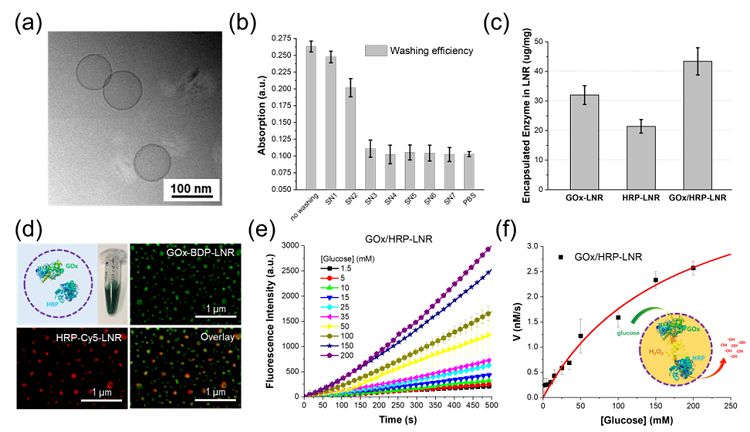
图2. 纳米反应器的体外表征及酶促反应动力学
脂质体纳米反应器能够抑制肿瘤营养供应,产生高细胞毒性的羟基自由基(•OH),在体外和体内均能有效抑制肿瘤的生长,并表现出良好的生物相容性。更重要的是,脂质体纳米反应器制备所使用的磷脂材料已被用于商业脂质体制剂,并被广泛证明具有良好的生物安全性,这对其生物医学应用具有潜在价值。该工作将脂质体的优良生物相容性与高效的串联酶反应相结合制备了脂质体酶促纳米反应器,开发了其成为抗肿瘤纳米药物的潜力。

图3. 体内肿瘤治疗部分
这一成果近期发表在Angew. Chem. Int. Ed.上,文章的第一作者是大连理工大学博士研究生王然和中国海洋大学博士研究生于英杰。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Liposomal Enzyme Nanoreactors based on Nanoconfinement for Efficient Anti-Tumor Therapy
Ran Wang, Yingjie Yu, Meiyu Gai, Ana Mateos Maroto, Svenja Morsbach, Xiang Xia, Maomao He, Jiangli Fan, Xiaojun Peng, Katharina Landfester, Shuai Jiang, Wen Sun
Angew. Chem. Int. Ed., 2023, DOI: 10.1002/anie.202308761
孙文教授简介

孙文,大连理工大学教授,博士生导师,2018年博士毕业后加入大连理工大学化工学院彭孝军院士团队,开展了以功能染料纳米化技术为核心核心用于疾病荧光诊断及光驱动治疗。以第一及通讯作者在Nat. Chem.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed、 Adv. Mater.、Matter、Adv. Funct. Mater. 、Biomaterials、Chem. Rev. Acc. Chem. Res.等知名学术期刊上发表研究成果50余篇。6篇入选ESI高被引,多篇文章分别被 JACS、Adv. Mater. 和Adv. Sci.杂志选为封面/内封面。SCI引用7200余次, H因子43。获2019年度中国石油和化学工业联合会科技进步一等奖。承担国家自然科学基金优秀青年基金项目、面上项目、中央高校科技领军人才团队项目等。
姜帅教授简介

姜帅,中国海洋大学教授,博士生导师。2021年5月加入中国海洋大学医药学院,主要从事纳米药物递送系统开发与纳米-生物界面作用的研究工作。发表研究论文40余篇,其中以第一或通讯作者在Angew. Chem.、Adv. Funct. Mater.、ACS Nano、Nano Lett.、Acc. Chem. Res.等知名学术期刊发表研究论文25篇,篇均影响因子>10;文章引用1300余次,h指数20。主持国家自然科学基金青年基金、山东省优秀青年基金(海外)和中国海洋大学青年英才工程第一层次基金等项目。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号