如何实现共轭二烯和一氧化碳的[4+1]环加成反应?用环丙烷加盖
五元碳环是天然产物和药物分子中广泛存在的结构单元。构建该类骨架最经典的方法之一是烯、炔和一氧化碳的 [2+2+1] 环加成反应(即Pauson–Khand反应),其产物是共轭的2-环戊烯酮。为了构建具有不同取代模式的五元碳环,化学家们还一直在努力发展其他金属催化的环加成反应。比如,到目前为止,北京大学余志祥(点击查看介绍)课题组已发展了四种[3+2]反应可以构建不同的五元碳环。那么是否可以用比较常见也容易合成的共轭二烯和一氧化碳的 [4+1] 环加成反应合成五元碳环呢?此前的文献中没有对这个问题进行回答。最近余志祥课题组发现,铑催化的普通的共轭二烯和一氧化碳的 [4+1] 环加成不能实现,但如果用环丙烷加盖的二烯(cyclopropyl-capped diene,或称烯丙叉环丙烷)作为底物,相应的 [4+1] 环加成反应则可以实现(图1)。他们发展了这种新型[4+1]反应,并通过量子化学计算分析回答了为什么其中一个反应成功,而另一个反应失败。该工作(反应发展+机理研究)以全文形式发表在J. Am. Chem. Soc.上。
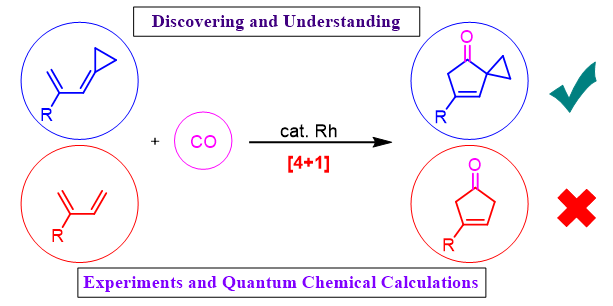
图1. 两种 [4+1] 环加成。图片来源:JACS
利用底物1a进行条件筛选后(详见原文),余志祥课题组以“5 mol% [Rh(cod)Cl]2 催化剂、1 atm CO、甲苯、30 ℃”为标准条件进行了底物拓展(图2)。R1为(杂)芳基的底物1a~1l均能在24 h内以中等或较高产率生成对应的 [4+1] 环加成产物,芳环邻、间、对位取代及吸电子、给电子取代基均可兼容。环己基底物1m亦可较快发生反应,但一级烷基取代底物(1n~1p)反应较慢,需将反应时间延长至48~72 h。底物中的环丙烷上亦可存在并环结构(1q),此时除延长反应时间外还需要将温度提升至60 ℃。取代基在R2位置时底物极易分解,仅能以较低产率得到 [4+1] 环加成产物(2r)。取代基在二烯末端时 [4+1] 反应则无法发生。
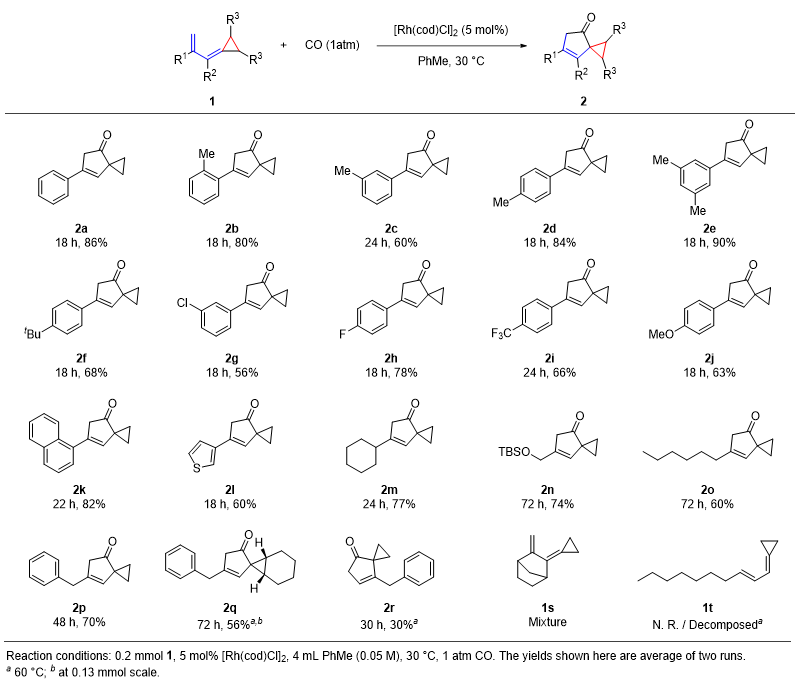
图2. [4+1] 环加成反应底物拓展。图片来源:JACS
随后余志祥课题组以2a为例进行了产物衍生化。2a可被NaBH4还原为醇,随后在酸性条件下重排为具有5/4并环的桥头三级醇6。2a亦可在Pd/C催化下发生碳碳双键的氢化,再通过Wittig反应生成8。8可发生乙烯基环丙烷(VCP)的常见反应,如镍催化的VCP重排生成5/5并环产物10,及VCP-炔 [5+2] 反应生成5/7并环产物9。在碱性条件下,2a可异构化为共轭的环戊烯酮11,该化合物可在TMSI作用下开三元环生成12,或发生镍催化的[3+2]反应生成5/5螺环13。2a还可以转化为磺酰腙,再通过 Bamford–Stevens 反应生成环戊二烯衍生物14。
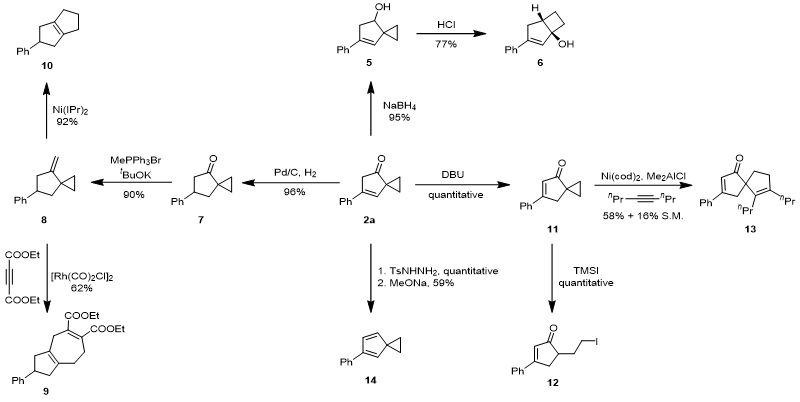
图3. [4+1] 环加成产物衍生化。图片来源:JACS
为了说明环丙烷对该反应的重要性,余志祥课题组以无取代的环丙烷加盖的丁二烯(SM1)和1,3-丁二烯(SM2)为例计算了[4+1]反应的自由能面(图4)。环丙烷加盖的丁二烯与铑催化剂的配合物IN1经历氧化环化和一氧化碳配位生成IN3。IN3存在两种可能的插羰方向:插环丙烷一侧的反应路径中插羰更容易,决速步为还原消除(TS3);插另一侧的反应路径中决速步为插羰(TS2b)而还原消除相对容易。两条路径的总活化自由能几乎相同(23.7 kcal/mol)。最后通过配体交换生成 [4+1] 产物,反应放能21.2 kcal/mol。1,3-丁二烯同样经历氧化环化、一氧化碳配位、插羰、还原消除、配体交换生成 [4+1] 产物,决速步为插羰(TS5),总活化自由能29.4 kcal/mol。注意到一氧化碳配位、插羰、还原消除这三个过程对于环丙烷加盖的丁二烯和1,3-丁二烯是类似的:一氧化碳配位均放能~7 kcal/mol,插羰活化自由能均为~20 kcal/mol,还原消除活化自由能亦均为~20 kcal/mol,而氧化环化这一步骤中环丙烷加盖的丁二烯则比1,3-丁二烯容易得多(活化自由能低4.0 kcal/mol,且少吸能7.5 kcal/mol)。故可认为二烯有环丙烷加盖时,氧化环化伴随该底物中亚甲基环丙烷(MCP)的角张力释放,额外提供了~7 kcal/mol的热力学驱动力。该驱动力可传递至后续的插羰和还原消除,使得反应总活化自由能降低了~7 kcal/mol。
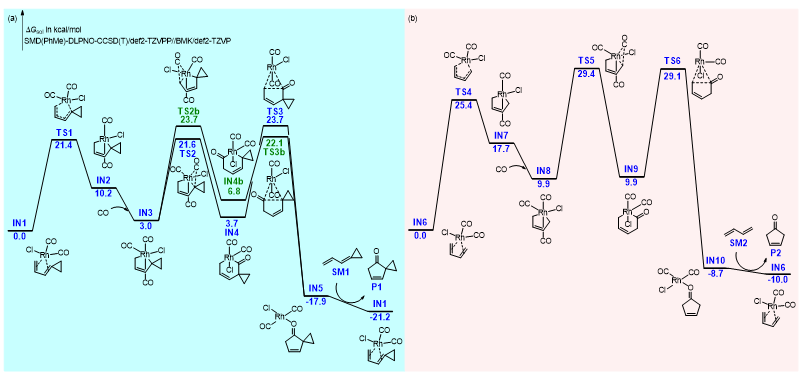
图4. 环丙烷加盖的丁二烯(a)和1,3-丁二烯(b)与一氧化碳的 [4+1] 反应自由能面。图片来源:JACS
环丙烷加盖对二烯反应活性的提升亦可由图5的氢化热看出。环丙烷加盖提供了~12 kcal/mol的热力学驱动力(比较图5中反应a和c)。如果二烯用环丁烷加盖,则没有明显的张力释放(比较图5中反应a和b),实验上该类型的底物也不能实现 [4+1] 环加成反应(见原文)。
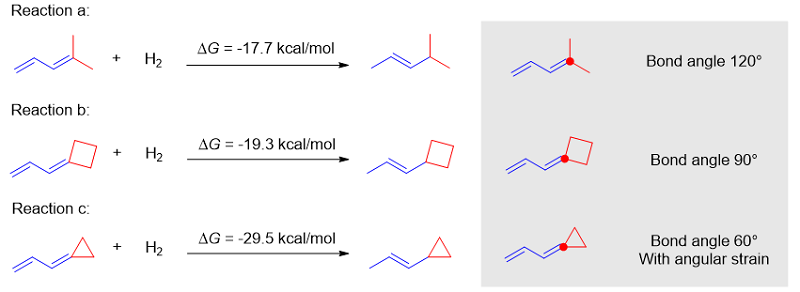
图5. 三种二烯的氢化热对比以评估角张力
总结
余志祥课题组发展了一种基于角张力释放的[4+1]环加成反应(图6)。在中性铑催化下,环丙烷加盖的共轭二烯可与一氧化碳反应生成具有5/3螺环结构的3-环戊烯酮。该产物亦可进行多种衍生化反应构建5/4并环、5/5并环、5/7并环、5/5螺环等多种环系。这一[4+1]反应能够发生的关键在于环丙烷加盖的二烯底物中的MCP片段具有角张力,该角张力可在氧化环化过程中部分释放以降低后续插羰及还原消除过渡态的能量。而简单取代的1,3-丁二烯缺少这一热力学驱动力,故其 [4+1] 环加成反应很难发生。
本文的研究工作是在余志祥教授指导下完成的。论文共同第一作者为杨昱升博士和博士研究生李涵潇,课题组的本科生朱天宇和张子游也做出了许多贡献。
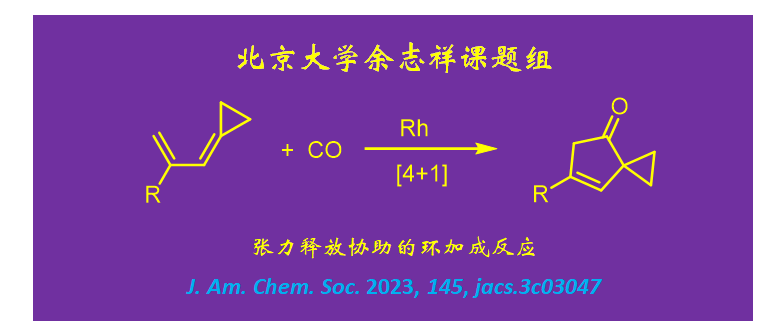
图6. 环丙烷加盖二烯和一氧化碳的 [4+1] 环加成反应。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Rh-Catalyzed [4+1] Reaction of Cyclopropyl-Capped Dienes (but not Common Dienes) and Carbon Monoxide: Reaction Development and Mechanistic Study
Yusheng Yang, Han-Xiao Li, Tian-Yu Zhu, Zi-You Zhang and Zhi-Xiang Yu
J. Am. Chem. Soc., 2023, DOI: 10.1021/jacs.3c03047
余志祥教授简介
教育和工作经历:
1987-1991,武汉大学,学士;
1994-1997,北京大学,硕士;
1997-2001,香港科技大学,博士;
2001-2004,加州大学洛杉矶分校,博士后;
2004-现在,北京大学,副教授/教授,理论和合成有机化学课题组组长。
研究方向和科研工作简介:
余志祥教授主要在有机化学反应的发展与应用、反应机理研究两个方向开展科研工作。他发展了[5+2+1], [7+1], [4+2+1], [5+2], [4+3], [3+2+1], [4+2], [5+1], [3+2], [4+1]等一系列成环反应,并将其中的一些反应应用于天然产物的合成(国内外的课题组也在应用这些成环反应进行天然产物全合成);他对自己课题组所发展的系列成环反应和其它重要或新的化学反应(如Lu-(3+2)反应,Corey-Chaykovsky反应,烯酮以及烯酮亚胺盐参与的[2+2]反应)的机理进行研究,揭示反应的具体过程,影响因素和原因等,并提出了多种新型反应模式和理论模型(如质子迁移模型、内型/外型氧化环金属化反应模式、分子亲核性/亲电性的前线轨道理论)。在科研中余志祥教授非常注重“反应机理研究↔反应设计和发展”的互动:他利用计算化学为主要手段研究反应机理,然后基于机理设计新反应,并通过实验进行验证和发展。
主要荣誉:
1. 药明康德生命化学研究奖-学者奖,2018;
2. 北京大学拜尔研究者奖,2018;
3. 教育部长江学者,2015;
4. 全国百篇优秀博士论文指导导师,2012;
5. 中国化学会-Sci-Finder有机合成创造奖,2011;
6. 中国化学会-巴斯夫公司青年知识创新奖,2011;
7. 中国化学会-物理有机化学奖,2011;
8. 国家杰出青年基金获得者,2008。
https://www.x-mol.com/university/faculty/8608
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号