Science:如何在杂环里插入另一个环
环状有机化合物,特别是杂环化合物,在药物化学和天然产物化学以及材料科学等领域有着广泛的应用和重要的意义,这是因为环状结构不仅可以影响亲脂性、三维性和骨架刚性等特性,而且可以决定分子功能和反应性。1881年,化学家首次将一个或两个原子插入环状分子中进行骨架编辑(Ber. Dtsch. Chem. Ges., 1881, 14, 1153-1163),从而获得扩环产物。随后,不少课题组报道了将硼、氮或碳原子插入环状化合物中进行骨架编辑的反应(图1A),同时还可以通过插入氧和碳的两步法策略实现多环芳烃的去芳构化扩环反应。此外,将双原子插入高张力环酮的催化策略已成为合成桥接环和稠合环的有用工具,若将这一概念扩展到小环插入杂环母环(“ring-in-a-heterocycle”),那么就能轻松地构建双环骨架(图1B)。另一方面,杂(双)环单元是许多重要生物活性天然产物的基本骨架,而富含C(sp3)骨架的底物(如:双环[1.1.0]丁烷(BCB))凭借三维结构和增加的构象刚性等性质有助于成功的新药设计,因此将富含C(sp3)的环插入杂环中构建双环骨架极具吸引力。尽管最近报道了BCB与张力环丙烷的环加成来构建双环[3.1.1]庚烷,但由于活化位点、化学选择性和区域选择性等合成挑战,使得BCB插入自然界中广泛存在的杂环化合物极具挑战性。
在此前研究基础上,德国明斯特大学的Frank Glorius教授课题组设想能否利用张力小环通过断裂-重连(cleavage-rebound)来实现杂环的扩环反应,该反应要在温和的条件下进行以避免在断裂杂环的同时断裂四元碳环。近日,他们成功地利用光氧化还原催化将具有环张力的四元环插入到噻吩环中,并以良好的收率、优异的化学选择性和区域选择性构建了一系列八元双环骨架(图1D),其反应过程如下:{[Acr-Mes2]+[BF4]-}*作为光氧化还原催化剂活化噻吩并形成高活性的自由基阳离子中间体I,I进攻BCB形成中间体II或III,接着通过开环-插入过程形成八元环中间体IV,最后经单电子转移还原便可获得目标产物(图1C)。相关成果发表在Science 上,Frank Glorius教授和美国加州大学洛杉矶分校的K. N. Houk教授为共同通讯作者。
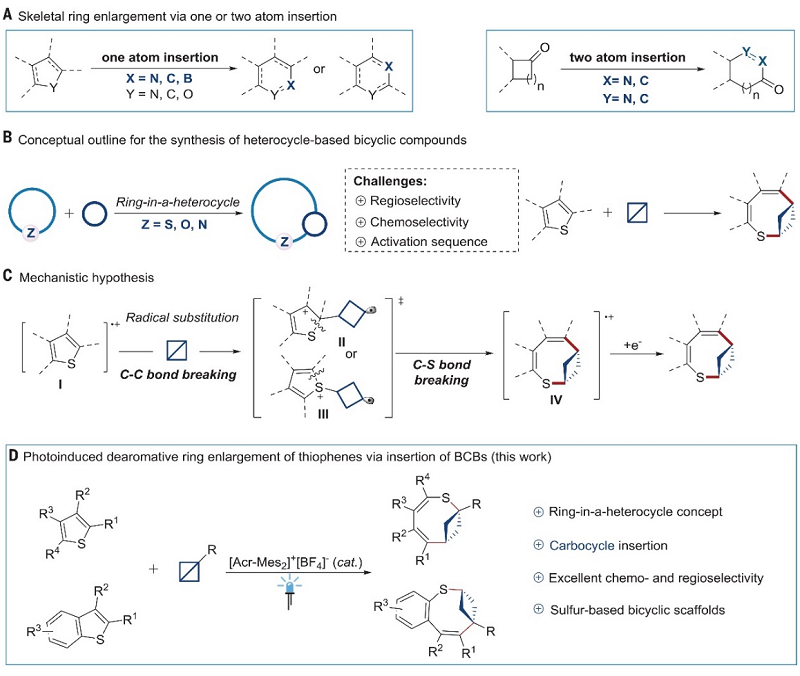
图1. 背景介绍及本文工作。图片来源:Science
首先,作者选择3-苯基噻吩(1a)和双环[1.1.0]丁烷-1-(吗啉基)甲酮(2a)为模板底物对反应条件进行优化,结果显示在吖啶盐([Acr-Mes2]+[BF4]-)为光催化剂、MeCN为溶剂的条件下于氩气气氛下反应12 h,可以80%的收率和良好的区域选择性(3a:3a' = 94:6)获得主要异构体3a。此外,对照实验表明可见光和光催化剂缺一不可,同时该反应对高氧浓度和水具有极强的敏感性,但对于较高的温度和光强的变化均可耐受。在最优条件下,作者对BCB骨架的底物范围进行了考察(图2),结果显示一系列环酰胺(3a-3e)、酰胺(3f-3k)、酯基(3l)、酮羰基(3m)和醚(3n)取代的BCB均能兼容该反应,以良好的收率和区域选择性获得所需产物,特别是产物3a还能以2.4 mmol规模进行制备(收率:84%)。其次,作者还探究了噻吩衍生物的底物适用性,结果显示各种单取代噻吩(3o-3s)、3,4-二取代噻吩(3t-3w)、2,4-二取代噻吩(3x-3ac)、三取代噻吩(3ad)、甲基取代的噻吩(3ae)甚至未取代噻吩(3af-3ag)均能以中等至良好的收率和高区域选择性转化为相应产物,尽管由于空间位阻导致2,4-二取代噻吩比3,4-二取代噻吩具有更高的区域选择性。然而,2-甲基-3,5-二苯基噻吩进行反应时却没有检测到所需产物,这可能是由于2,5-位双取代引起的空间位阻所致。
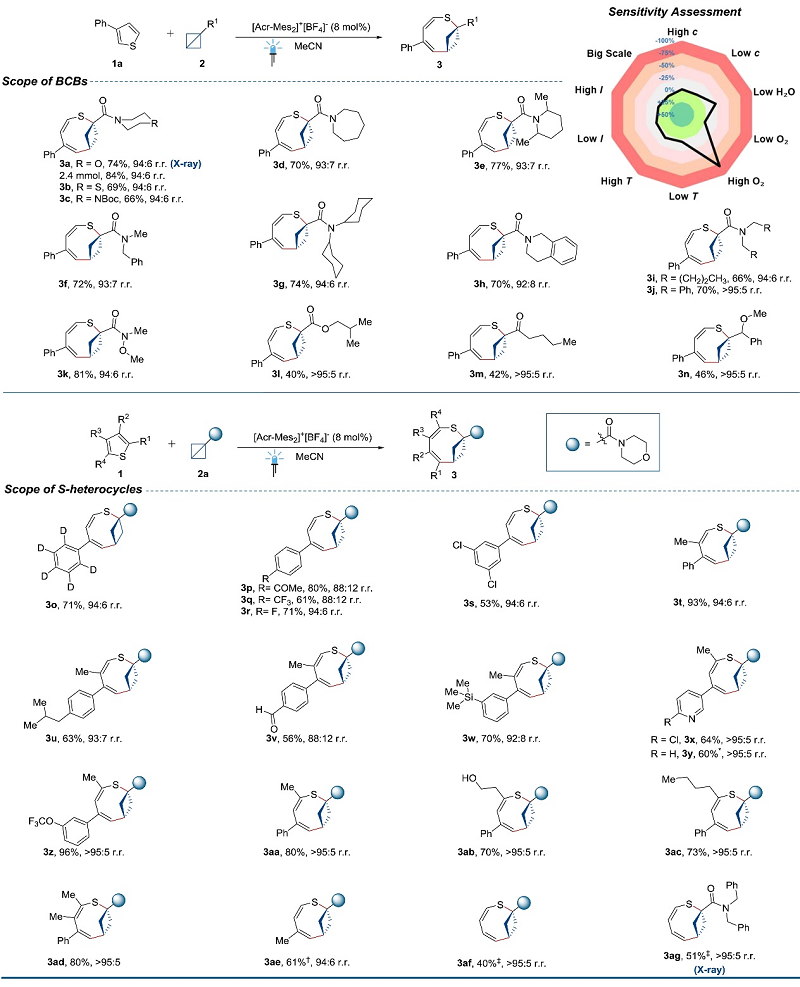
图2. BCB和噻吩的底物范围拓展。图片来源:Science
随后,作者对苯并噻吩衍生物的底物范围进行了探索,并观察到与噻吩相反的区域选择性。如图3所示,羟基(3ai)、硅基(3aj)、甲基(3ak-3al)、苯基(3am-3ao)、炔基(3ap)、烯基(3av)、环己基(3aq)、吡啶和嘧啶衍生物(3ar-3at)甚至薄荷醇单元(3aw)取代的苯并噻吩均能实现这一转化,并以中等至较好的收率和区域选择性得到相应产物,特别是产物3ai还可以1.2 mmol规模进行制备(收率:93%)。为了进一步证明这种杂环扩环反应的化学选择性和区域选择性,作者将含有两个相同苯并噻吩结构的复杂分子与BCB(2a)进行反应,结果显示两种底物均与其中一个苯并噻吩骨架进行反应,并以优异的化学选择性和区域选择性获得单一的异构体(3ax-3ay)。然而,在同时含有苯并噻吩和噻吩单元的底物中,BCB仅在苯并噻吩位点进行反应(3az)。另外,作者还通过3a、3ag和3ar的晶体结构分析了这些产物的立体化学和区域化学。
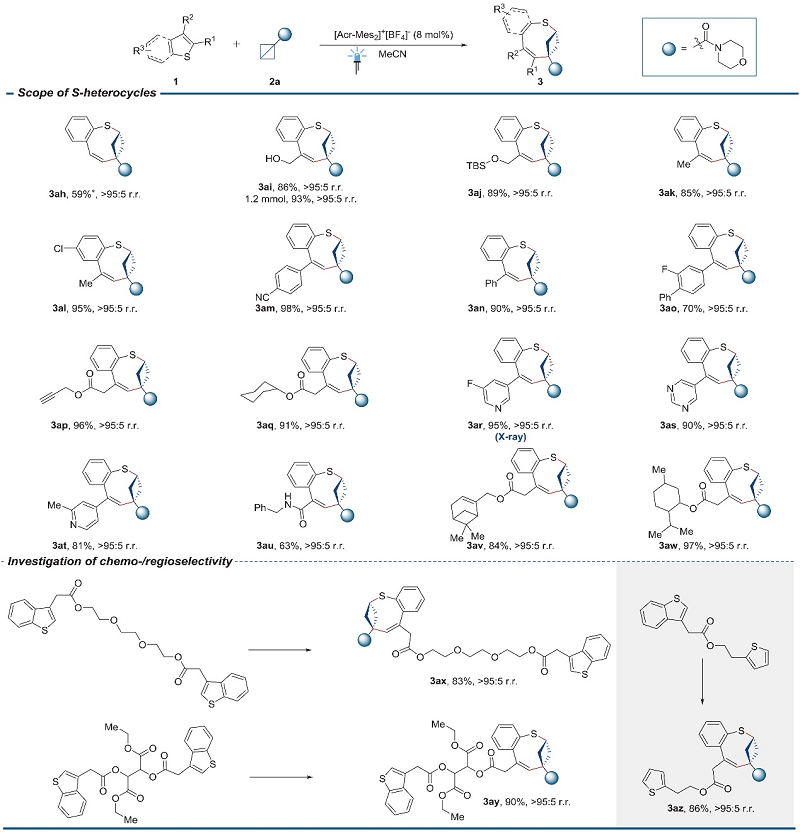
图3. 苯并噻吩的底物拓展。图片来源:Science
为了进一步探究反应机理,作者进行了一系列实验。具体而言:1)Stern-Volmer荧光猝灭实验表明激发态光催化剂(PC*)更容易被3-苯基噻吩1a淬灭而非BCB 2a(图4A),这与最初的机理假设相一致;2)循环伏安法显示在1.68 V下观察到1a的氧化峰(图4B),而未检测到2a的氧化峰,这与PC*对1a的氧化相一致;3)模板底物1a 和2a 在TEMPO的存在下进行反应时没有产生所需的产物,从而表明反应中存在自由基途径(图4C);4) 1a与2a反应的量子产率Φ为0.87(图4D);5)分子间竞争实验表明富电子杂环比缺电子杂环更具反应性。其次,作者还进行了密度泛函理论(DFT)计算(图4E),结果表明PC*先氧化1a生成自由基阳离子中间体[1a]•+,后者与BCB经过渡态[TS1]-+(限速过渡态,自由能能垒为12.6 kcal/mol)进行插入反应并提供热力学上更稳定的中间体[IM1]•+。随后,[IM1]•+形成C-S键并产生杂环的过程([TS2]-+)在动力学和热力学上均是有利的,同时光催化剂对[IM2]•+的还原在热力学上也有利(能垒为11.5 kcal/mol)。最后,C-S键裂解(TS3)在动力学上很有利,并且产物3a的生成是不可逆的。值得一提的是,DFT计算表明苯并噻吩的反应机理不同于与3-苯基噻吩1a。如图4F所示,将BCB插入S-自由基[1ah]•+的自由能能垒(TS4,12.9 kcal/mol)与TS1相似,随后的C-C键形成是限速过渡态([TS5]-+),自由能能垒为16.1 kcal/mol。虽然无法检测到还原的[IM4],但预测C-S键裂解得到产物3ah在动力学上更有利。
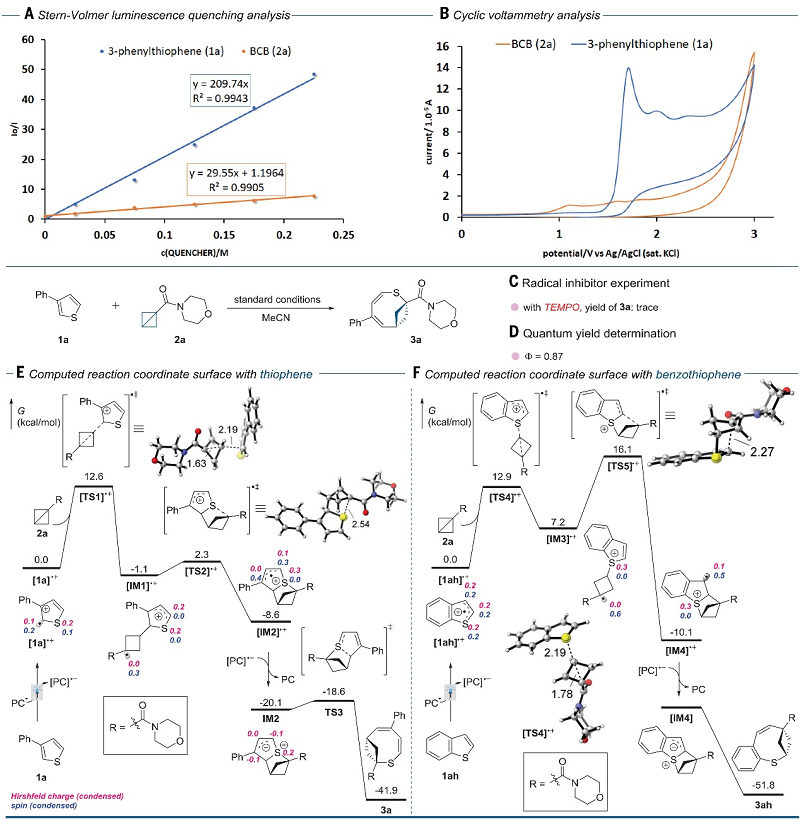
图4. 机理研究。图片来源:Science
最后,作者对产物进行了一系列衍生化(图5)。1)化合物3a在四氢呋喃为溶剂的条件下进行选择性酰胺还原并以82%的收率得到醛3ba;2)3a经化学选择性氧化成功地转化为亚砜3bb(收率:85%)和砜3bc(收率:81%);3)3a在保留碳-碳双键的情况下还原酰胺羰基,以64%的收率获得叔胺3bd;4)3a经化学选择性的烯烃氢化分别以76%和87%的收率得到所需产物3be和3bf;5)以化合物3ai为起始原料,在氢化钠的作用下引入烯丙基并得到烯丙基醚3bg(收率:92%);6)3ai通过选择性氧化和酯化反应转化为相应的醛3bh(收率:92%)和酯3bi(收率:90%),这些结果进一步展现出含硫双环骨架具有潜在的适用性。
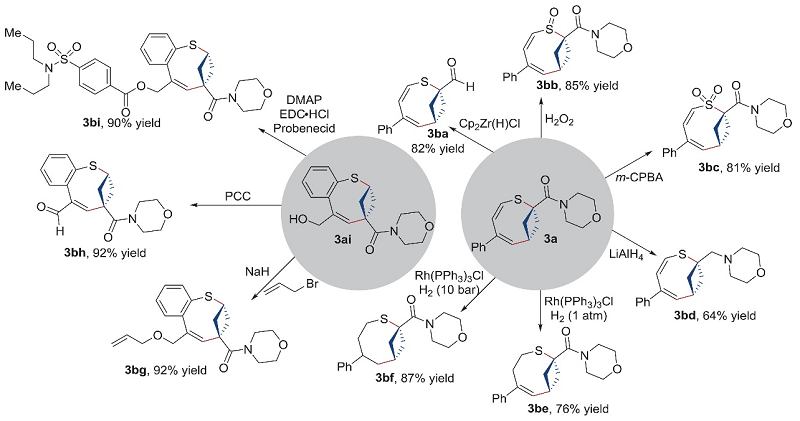
图5. 合成应用。图片来源:Science
总结
本文利用光氧化还原催化的方式,将具有环张力的四元环成功地插入到噻吩环中,并构建了一系列八元双环骨架,这些双环产物还可以进行一系列衍生化。由于含氮和氧的中型双环骨架也普遍存在于天然存在和合成的生物活性分子中,因此这种小环插入杂环母环的策略将会促进杂环化合物扩环反应的进一步发展。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Dearomative ring expansion of thiophenes by bicyclobutane insertion
Huamin Wang, Huiling Shao, Ankita Das, Subhabrata Dutta, Hok Tsun Chan,
Constantin Daniliuc, K. N. Houk, Frank Glorius
Science, 2023, 381, 75-81. DOI: 10.1126/science.adh9737
导师介绍
Frank Glorius
https://www.x-mol.com/university/faculty/46677
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号