香港城市大学Nat. Chem.:四价铂光氧化剂实现肿瘤光氧化疗法
光动力疗法(Photodynamic Therapy, PDT)是一种创新的肿瘤治疗方法,通过特定波长的光源激活光敏剂产生活性氧物种来引起肿瘤细胞损伤。该疗法已经广泛应用于多种癌症的治疗,包括皮肤癌、头颈部癌症、肺癌、前列腺癌等。相比传统化疗,光动力疗法具有高度选择性和局部控制性的优势。通过精确调节光源的位置和强度,可以实现对肿瘤组织的精确照射,以最大程度消灭肿瘤细胞,减少对周围健康组织的损害。此外,光动力疗法与化疗药物不会出现交叉耐药性,可以与化疗协同治疗。然而,传统的光动力疗法仍然存在一些限制。例如,大部分实体肿瘤组织内部缺乏氧气,肿瘤乏氧环境极大地限制了光动力疗法产生活性氧物种的效率,从而降低了治疗效果。另外,传统光敏剂对短波长的光源敏感,但这种光源在组织中的穿透能力有限,仅适用于浅表肿瘤。
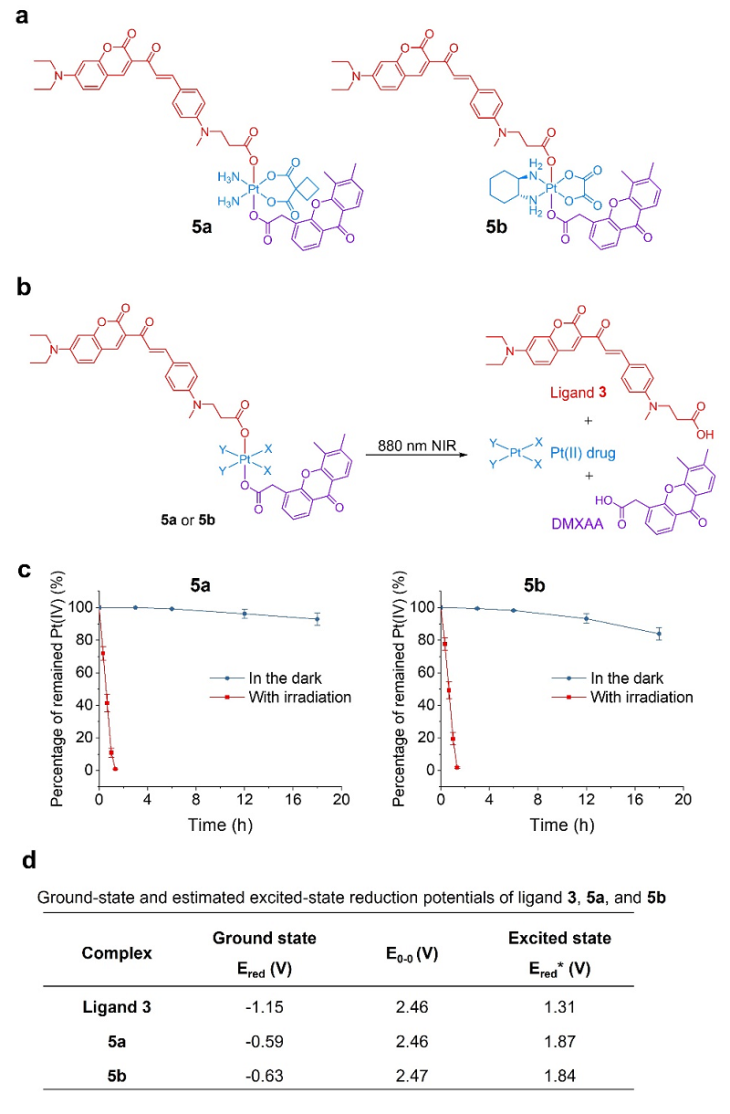
图1. (a) 近红外光激活的四价铂光氧化剂化学结构。(b) 和 (c) 四价铂光氧化剂在非激活条件下能够在生理环境中保持稳定,然而在近红外光照射下能够被还原为临床药物,并释放出轴向基团。(d) 四价铂光氧化剂和光敏配体的基态和激发态还原电势。图片来源:Nat. Chem.
针对上述限制,香港城市大学朱光宇(点击查看介绍)团队与合作者设计合成了一种新型近红外光激活的四价铂光氧化剂(图1)。研究发现,四价铂与特定光敏配体结合以后,能够显著增强光敏配体在激发态的氧化能力。这种“金属增强的光氧化特性”使得该类四价铂配合物能够作为光氧化剂,直接在肿瘤细胞内氧化肿瘤生存相关的生物分子,产生活性氧物种,而无需氧气的参与。这就让这类金属光氧化剂在实体瘤的乏氧环境中仍能保持高效的肿瘤杀伤能力,克服了传统光动力疗法对氧气的依赖性限制。另外,这种金属药物将激发波长从传统光动力疗法的可见光波段提高到近红外波段,增强了组织穿透能力,扩大了潜在的适应症范围。
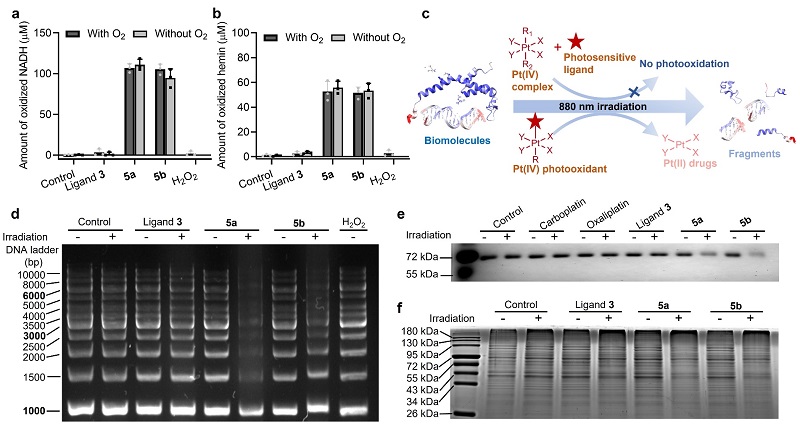
图2. 四价铂光氧化剂能够直接氧化生物分子。图片来源:Nat. Chem.
体外实验表明,这类四价铂光氧化剂能够在近红外光照射下,以不依赖氧气的方式氧化多种生物分子,如高铁血红素(hemin)、还原型烟酰胺腺嘌呤二核苷酸(NADH)、蛋白质和DNA等,同时前药自身被还原为临床铂药,如卡铂或奥沙利铂(图2)。与传统临床铂药物相比,四价铂光氧化剂在非激活状态下对细胞的暗毒性极低,能有效地避免对正常组织的毒副作用。然而一旦受到近红外光的激活,其抗肿瘤活性会极大地提高,最高可超过临床药物461倍,并且能够克服肿瘤细胞对铂类药物的耐药性。此外,传统光动力学治疗的光敏剂,如焦脱镁叶绿酸a(PPA)在乏氧环境中的抗肿瘤活性要比常氧环境中降低7倍以上,然而四价铂光氧化剂在乏氧环境中仍能保持高效的肿瘤杀伤能力(图3),克服了传统光动力学疗法在复杂乏氧肿瘤环境中的局限性。
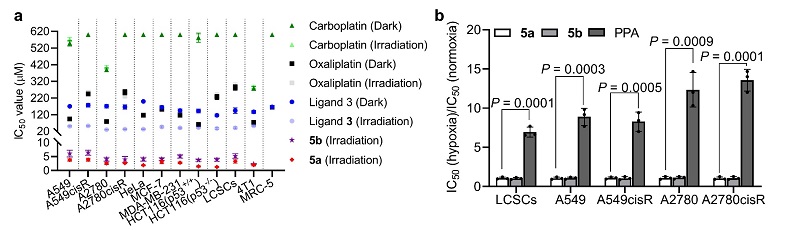
图3. 四价铂光氧化剂在常氧条件 (a) 和乏氧条件 (b) 下均表现出极强的抗肿瘤活性。图片来源:Nat. Chem.
进一步的机理研究表明,这类光氧化剂能够穿透到肿瘤球内部,并且有效地富集在肿瘤细胞的内质网区域。与传统铂类药物主要通过引起DNA损伤来消灭肿瘤细胞的模式不同,四价铂光氧化剂虽然在活化后释放出临床铂药物,然而其并不会引起肿瘤细胞的DNA损伤。在光照激活以后,前药通过氧化内质网周围的生物分子,产生大量的活性氧类物质和脂质过氧化物,从而引起肿瘤细胞的氧化应激,杀伤肿瘤细胞。此外,研究人员发现,这类光氧化剂在活化过程中还会产生大量的氢离子,极大地降低细胞内的pH值,导致肿瘤细胞酸中毒,进一步增强抗肿瘤效果(图4)。这种“双管齐下”的协同作用机理导致了独特的细胞死亡方式:光氧化剂在激活后能够在肿瘤细胞内产生大量的脂质过氧化物,打破细胞内的氧化还原稳态,并破坏细胞的膜结构;这些机制与铁死亡类似。然而,光氧化剂产生脂质过氧化物的方式并不依赖与细胞内的铁离子,在加入铁离子螯合剂后,光氧化剂的细胞毒性和产生脂质过氧化物的能力几乎不受到影响。不仅如此,光氧化剂所导致的肿瘤细胞的细胞器形态改变也与其他细胞常见死亡模式有较大区别,表明这类光氧化剂所引发的细胞死亡模式与其他抗肿瘤药物引起的细胞死亡(如凋亡、自噬、焦亡等)都不相同,其融合了细胞氧化应激和细胞酸中毒所引起的细胞死亡的特点,能够高效地消灭肿瘤细胞(图5),克服肿瘤细胞对光动力学疗法和铂类化疗药物的耐受性;同时,四价铂该光氧化剂还能诱导肿瘤细胞发生免疫原性细胞死亡(immunogenic cell death, ICD),从而刺激免疫细胞的增殖与活化,进一步强化治疗效果。这种新型的细胞死亡模式属于非传统坏死(nonclassical necrosis)。
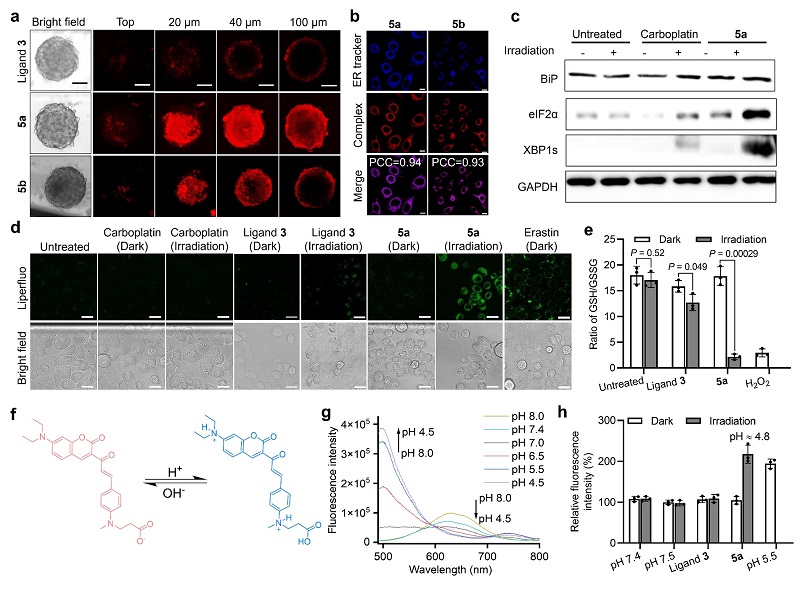
图4. (a) 四价铂光氧化剂能够深入肿瘤球内部,(b) 并富集在内质网。(c-e) 光氧化剂5a能够在近红外光激活后产生脂质过氧化物,破坏细胞内氧化还原稳态,引起细胞氧化应激。(f-h) 光氧化剂在激活后能够降低肿瘤细胞内pH。图片来源:Nat. Chem.

图5. 四价铂光氧化剂的细胞内作用机理示意图。图片来源:Nat. Chem.
体内实验表明,光氧化剂在激活后表现出比母体药物卡铂高出8倍以上的肿瘤抑制效果,且没有表现出显著的毒副作用。四价铂光氧化剂在活化以后还能够有效地抑制肿瘤细胞的转移,这是传统光动力疗法难以实现的(图6)。不仅如此,光氧化剂还能高效地诱导肿瘤细胞发生ICD,进而激活免疫系统。免疫荧光切片显示,光氧化剂5a在近红外光激活以后,肿瘤组织中的CD4+和CD8+T细胞的数量分别增加了7倍和23倍,表明四价铂光氧化剂在活化后能够显著促进免疫细胞增殖与活化,有助于进一步增强治疗效果。
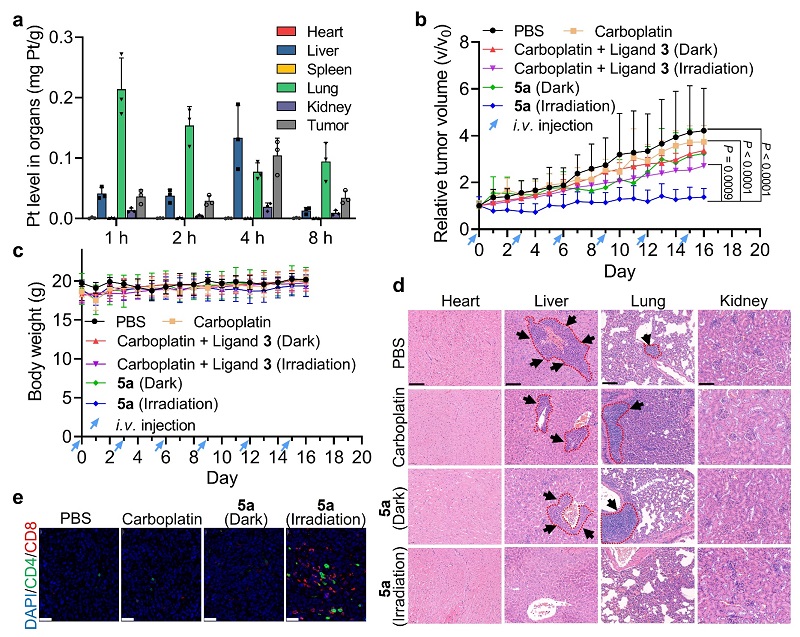
图6. 四价铂光氧化剂5a在非激活时没有表现出明显的毒性,在光照激活后能够有效地抑制肿瘤细胞生长和转移,同时激活免疫系统。图片来源:Nat. Chem.
总的来说,该项研究设计了一种能够被近红外光激活的四价铂光氧化剂,能够有效地克服传统光动力学疗法依赖氧气且激发波长较短的问题。该项工作作为概念验证性研究,揭示了金属药物特别是可控活化的金属药物具有优越的光氧化特性。肿瘤光氧化疗法正是利用这种光氧化特性,通过光氧化剂直接氧化肿瘤内生存相关的生物分子,产生活性氧类物质、脂质过氧化物和氢离子,打破肿瘤细胞的内稳态,高效地消灭肿瘤细胞;与传统光动力学疗法相比,肿瘤光氧化疗法不但具有更高的肿瘤氧化损伤效率,同时还能够引发了不同的细胞死亡模式来克服乏氧等复杂肿瘤环境对治疗效果的限制以及刺激免疫系统活化,展示出了巨大发展潜力,为抗癌药物的开发带来了新的思路。
该研究工作近期发表于Nature Chemistry,香港城市大学化学系博士后邓志勤博士为文章第一作者,生物系博士后黎煌璨为共同第一作者,香港城市大学化学系朱光宇教授和生物医学系何明亮教授为共同通讯作者,香港城市大学化学系为第一通讯单位。合作者还包括香港城市大学生物医学系杨梦苏和卢沛芝教授,机械工程系吕坚教授,材料系李扬扬和雷党愿教授等。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Near-infrared-activated anticancer platinum(IV) complexes directly photooxidize biomolecules in an oxygen-independent manner
Zhiqin Deng, Huangcan Li, Shu Chen, Na Wang, Gongyuan Liu, Danjun Liu, Weihui Ou, Feijie Xu, Xiong Wang, Dangyuan Lei, Pui-Chi Lo, Yang Yang Li, Jian Lu, Mengsu Yang, Ming-Liang He & Guangyu Zhu
Nat. Chem., 2023, DOI: 10.1038/s41557-023-01242-w
导师介绍
朱光宇
https://www.x-mol.com/university/faculty/26823
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号