Nat. Catal.:光氧化还原和有机催化实现不饱和醛的立体选择性氰基化
氰化物对羰基化合物的不对称加成是一种经典的有机化学反应,并广泛应用于高附价值手性氰醇化合物的合成。早在1912年,Bredig和Fiske等人利用生物碱衍生的有机催化剂来促进HCN对苯甲醛的不对称加成(图1a)。尽管该过程的立体选择性较低(对映体比例(e.r.)<55:45),但此方法是化学家开发的第一例非酶不对称催化反应。此后,化学家发展了α,β-不饱和羰基化合物(如:酰亚胺和酮)与氰化物的不对称共轭加成反应,但是这些反应依赖于手性催化剂,可实现氰化物的1,4-加成。然而,目前有关α,β-不饱和醛(1)的立体选择性共轭氰化仍然是一大难题(图1a),这是因为实现此转化主要的困难在于如何高化学选择性地实现氰化物的1,2-加成和1,4-加成。1954年,Prelog和Wilhelm重新研究了Bredig和Fiske开创性的有机催化体系,并发现肉桂醛与HCN反应具有独特的1,2-化学选择性(图1b)。事实上,迄今为止报道的所有方法都证实了线性烯醛的羰基部分与氰化物只能发生1,2-加成。
考虑到经典的离子途径不适用于共轭1,4-氰化反应,意大利博洛尼亚大学的Paolo Melchiorre教授课题组尝试利用自由基机制的不同反应性来实现1,4-氰化反应。具体而言,手性胺催化剂与α,β-不饱和醛1缩合生成缺电子的亚胺离子A,再通过SET还原形成具有亲核性的手性5π-电子β-烯胺基自由基B(形式上的极性反转),其可拦截亲电性的氰源并通过后续的水解即可获得1,4-加成产物。近日,他们在Nature Catalysis 上报道了光氧化还原催化和有机催化协同催化的α,β-不饱和醛的立体选择性共轭加成氰化反应(图1c),高收率、高对映选择性地获得了一系列1,4-氰化产物,并具有广泛的官能团耐受性。
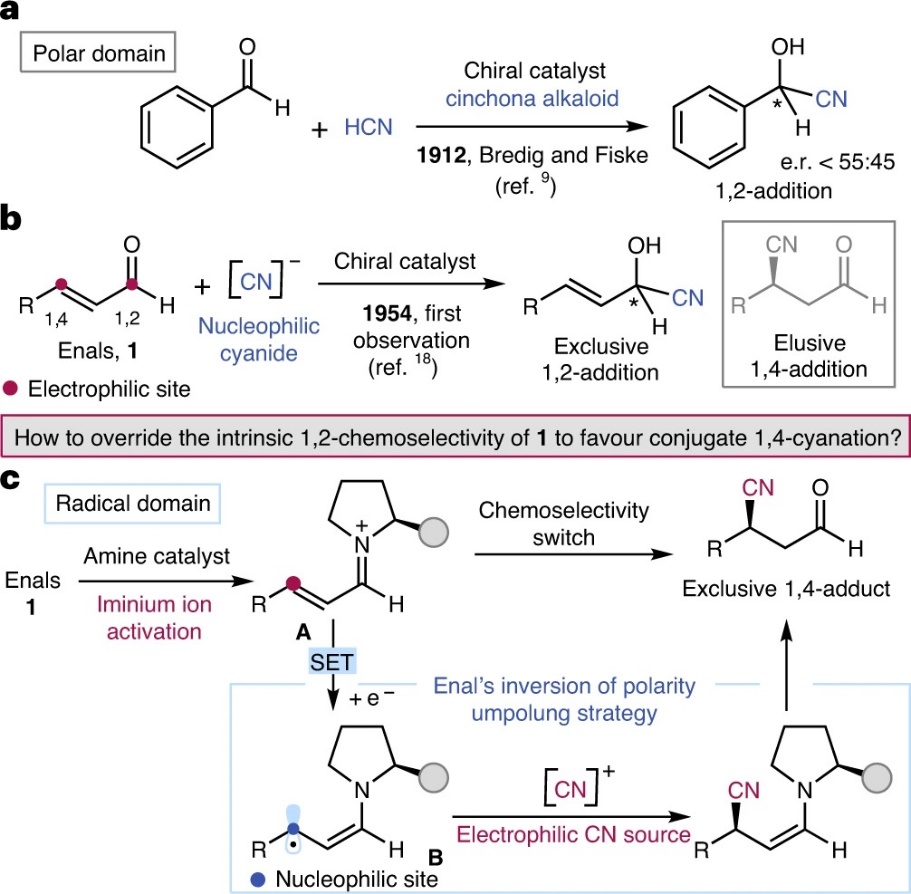
图1. 醛以及α,β-不饱和醛的反应性概述。图片来源:Nat. Catal.
1992年,Barton发现稳定且市售的对甲苯磺酰氰(TsCN)可以拦截碳中心自由基,因此作者选择辛烯醛1a为模板底物、TsCN为氰源、4-CzIPN(1 mol%)为光催化剂、二氢吡啶R-1为还原猝灭剂、DME为溶剂并在蓝光照射下探究各种手性仲胺催化剂(图2a),结果显示A-1和A-2不仅收率较低,而且没有对映选择性,当使用A-3时则以67%的收率和71:29 e.r.值获得1,4-氰化产物2a,同时将溶剂换为乙酸乙酯(EtOAc)可进一步提高对映选择性(81:19 e.r.)。对手性胺催化剂进一步优化后发现芳烃骨架上具有大位阻全氟异丙基的催化剂A-4可将对映选择性提高至88:12 e.r.,并且将手性胺的用量增加到30 mol%可以75%的分离收率和91:9 e.r.值获得单一的区域异构体2a。另外,对照实验表明没有蓝光照射、光催化剂或胺催化剂时反应无法进行,同时还原性猝灭剂的性质也很重要。需要指出的是,由于对甲苯磺酰基与烯醛1a的竞争性加成,上述反应过程均会产生砜副产物2a′,并且2a和2a′可以在羰基还原后通过色谱纯化轻松分离。
在此基础上,作者提出了可能的反应机理(图2b)。首先,光催化剂4-CzIPN在蓝光照射下变为激发态4-CzIPN*,被二氢吡啶R-1(Eox=+1.37 V vs Ag/AgCl)淬灭并形成还原性物种4-CzIPN•-(此过程通过Stern-Volmer淬灭实验得以证实)。然后,4-CzIPN•-通过SET还原缺电子亚胺离子A(由氨基催化剂A-4和烯醛1a缩合而成)并得到手性β-烯胺基自由基B(其空间效应可以调控与TsCN的结合方式),接着与亲电性氰源TsCN发生立体控制的加成反应获得自由基中间体C,再发生β-断裂生成烯胺D,同时释放出对甲苯磺酰基自由基E(产生副产物2a′)。最后,烯胺中间体D经水解便可得到手性β-氰醛2并再生有机催化剂A-4。
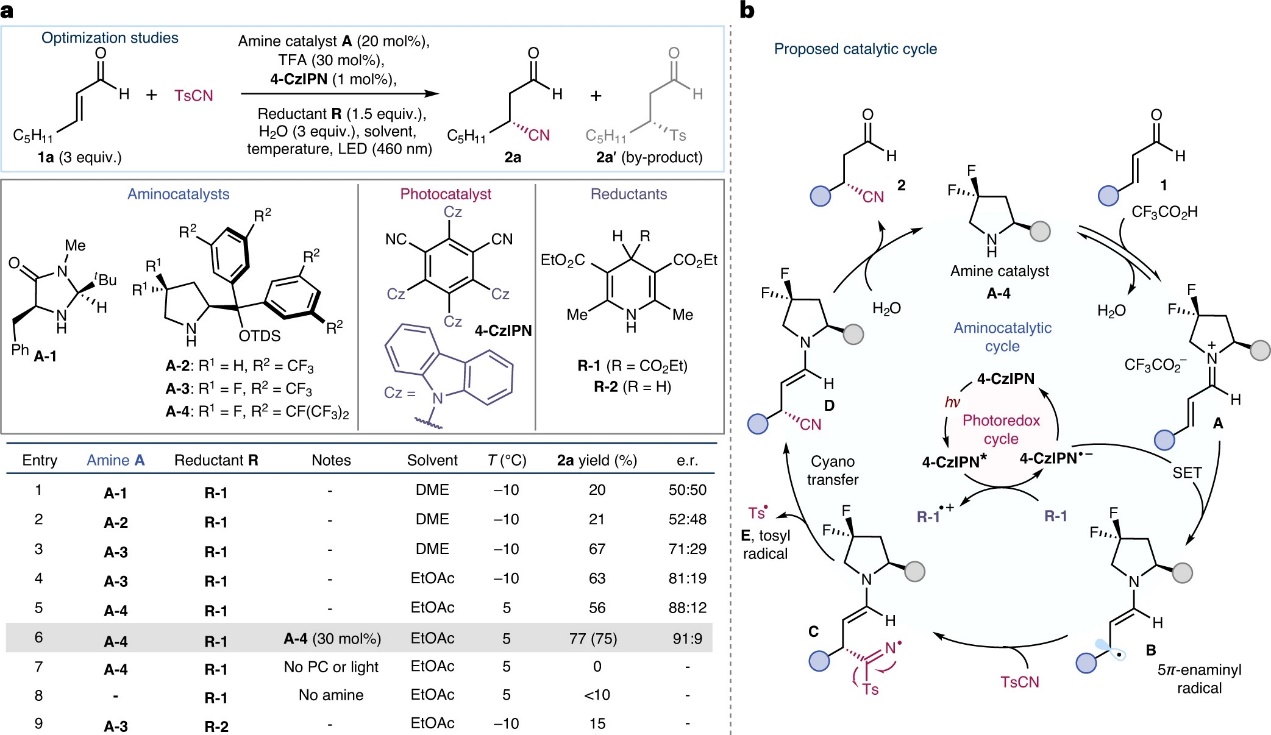
图2. 反应条件筛选和反应机理。图片来源:Nat. Catal.
在最优条件下,作者对该反应的底物范围进行了探索。为了便于后处理,作者用NaBH4将粗产物2还原为相应的氰醇3(一锅法)。如图3a所示,不同基团(如:烷基(3a-3d)、芳基(3e-3h)、烯基(3i-3k)、炔基(3l)、酰亚胺(2m)、醚(3n)、氰基(3o)、酰胺(2p)、游离醇(2q)、氯原子(2s)、游离羧酸(2t))取代的α,β-不饱和醛均能兼容该反应,以中等至良好的收率和对映选择性获得相应产物2或还原产物3,并通过X-射线衍射分析证实产物3d衍生物的绝对构型。此外,带有反应性酮羰基的复杂类固醇衍生物同样能顺利实现1,4-氰化反应(2r,9:1 d.r.),进而证实了胺催化剂A-4(而不是手性底物)是立体控制的主导因素。值得注意的是,1a的共轭氰化可以1 mmol规模进行,同时仅轻微影响效率(分离收率:55%,e.r.值:90.5:9.5)。其次,作者还对β-氰基醛加合物2a进行了一系列衍生化(图3b),例如:1)2a中的醛基可以与亲核性氰化物发生1,2-氰化反应,高收率、高立体选择性地得到氰醇4a;2)2a经Pinnick氧化得到β-氰基羧酸4b,可通过钯催化的氰基氢化,以90.5:9.5 e.r.值得到γ-氨基丁酸(GABA)衍生物4c。
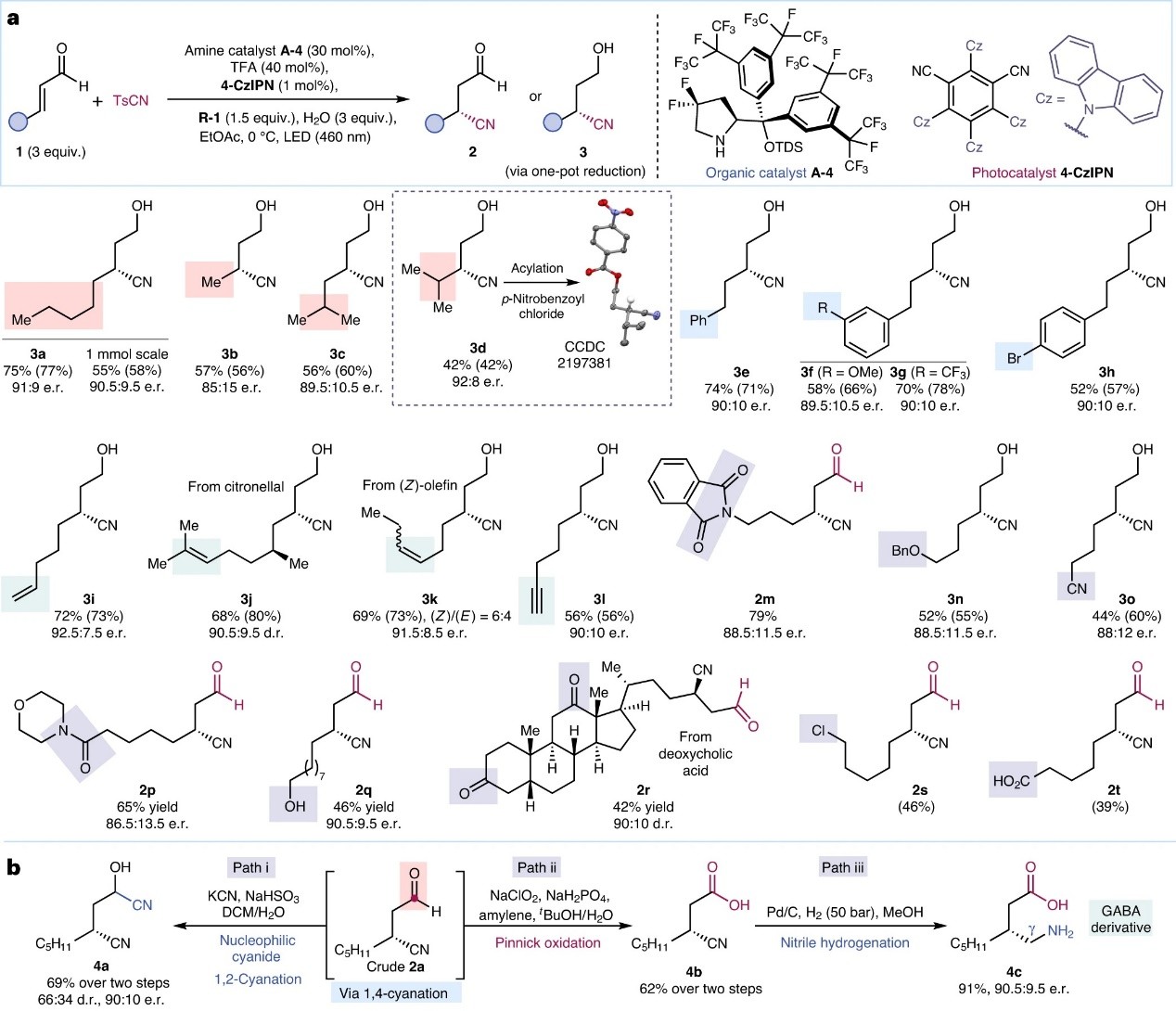
图3. 底物拓展。图片来源:Nat. Catal.
最后,作者将逆转烯醛固有反应性的策略用于其它不对称催化中。对反应条件稍加修改后,可以良好的化学选择性和立体选择性实现α,β-不饱和醛1与对甲氧基苄基(PMB)2-苯基丙烯酸酯(5)的β-烷基化,制备了一系列具有合成挑战性的线性1,6-二羰基化合物(6),同时能耐受多种官能团,例如:烷基(6a-6d)、芳基(6e-6h)、烯基(6i-6k)、氯化物(6l)、游离醇(6m)、醚(6n)和酯基(6o)。其次,不同基团取代的丙烯酸酯也是合适的偶联试剂,并以高收率、高对映选择性转化为相应产物(6p-6t)。如图4b所示,当产物6a被LiAlH4完全还原时得到两个非对映体二醇产物7a和7b,并且两者可分离和表征。此外,作者还通过X-射线衍射分析证实还原产物7e衍生物的绝对构型(图4c)。值得一提的是,烯丙基砜8作为有效的自由基捕获剂,经此催化体系也能以60%的收率、90:10 e.r.值得到相应产物9,从而实现了目前少有报道的α,β-不饱和醛的不对称共轭烯丙基化过程(图4d)。另一方面,作者还通过自由基钟实验证明了β-烯胺基自由基中间体的存在(图4e)。
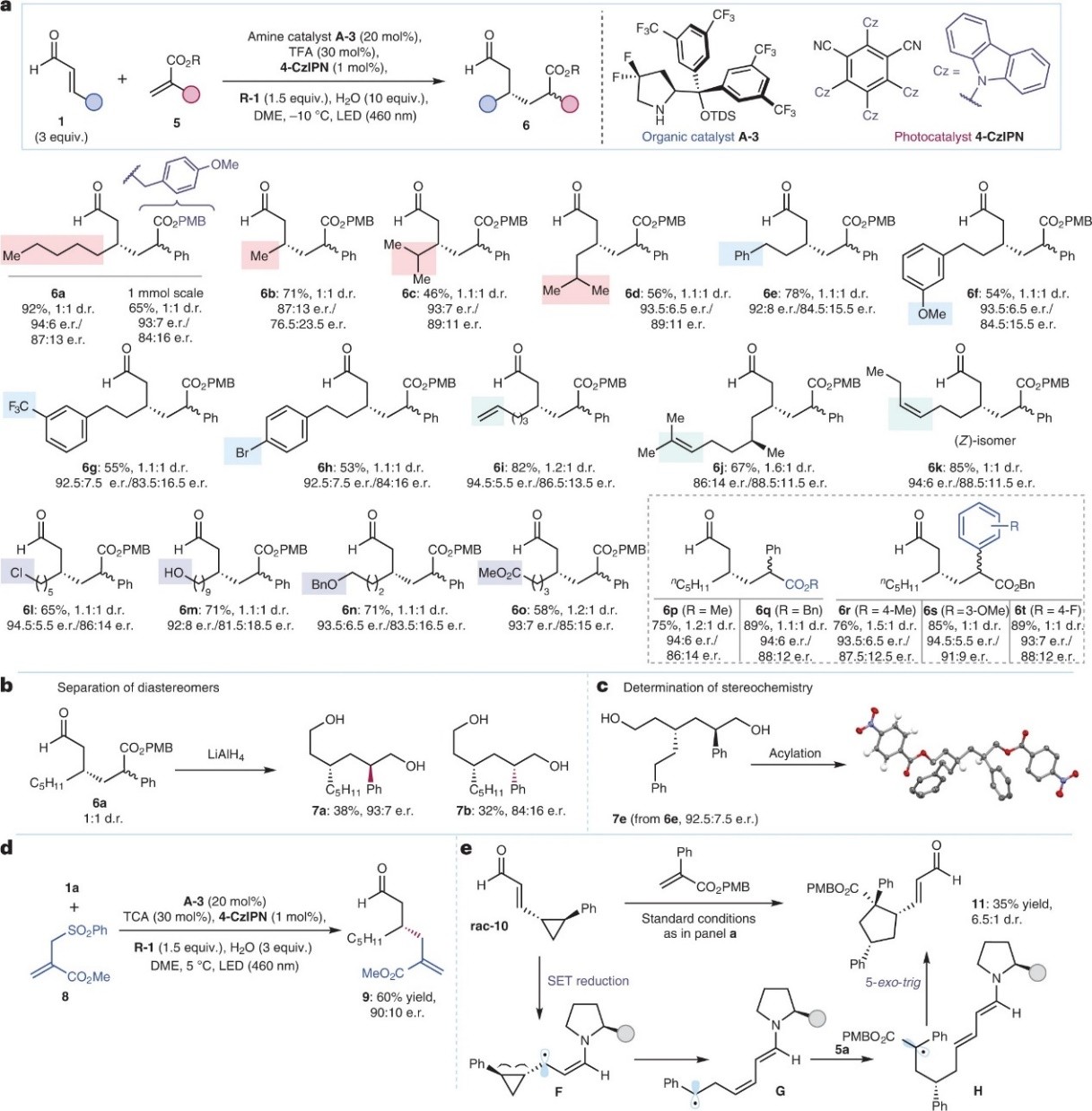
图4. 有机催化烯醛与丙烯酸酯反应的底物范围以及机理研究。图片来源:Nat. Catal.
总结
总而言之,Paolo Melchiorre课题组发展了光氧化还原催化和有机催化协同催化的α,β-不饱和醛的立体选择性共轭加成氰基化反应。此反应具有良好的底物适用性和官能团兼容性,并可以兼容生物活性分子骨架。此外,该逆转烯醛固有反应性的策略还可在开发其它非常规的立体控制自由基官能团化过程中得到应用。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Stereoselective conjugate cyanation of enals by combining photoredox and organocatalysis
Martin Berger, Dengke Ma, Yann Baumgartner, Thomas Hin-Fung Wong, Paolo Melchiorre
Nat. Catal., 2023, 6, 332-338, DOI: 10.1038/s41929-023-00939-y
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号