基于亚甲基萘醌中间体构建手性萘酚和萘胺类化合物
亚甲基醌是不对称合成中常见的中间体。但常见的亚甲基醌中间体,羰基和亚甲基单元往往分布在同一个芳环之中,分布于不同环上的类似物并没有被用于不对称合成。近日,香港科技大学孙建伟教授(点击查看介绍)和林振阳教授(点击查看介绍)课题组合作实现了第一个涉及此类亚甲基萘醌中间体的不对称反应。使用合适的手性磷酸催化反应原位生成萘亚甲基醌或氮杂萘亚甲基醌中间体,并原位参与不对称亲核加成。该方法同时提供了一种以优异对映选择性构建具有远程手性中心的萘酚和萘胺的新方法。控制实验和DFT计算也为这种新型的萘亚甲基醌中间体提供了佐证。
亚甲基醌(QMs)在有机合成和生物转化中都是一个有用的中间体。由于亚甲基单元容易受到亲核进攻恢复芳构化,这类中间体被广泛应用于合成各种不同苄位取代的酚衍生物,并且在各种不对称催化体系中可以快速构建苄位立体中心。但目前被广泛研究应用的亚甲基醌中间体,亚甲基和羰基往往处于同一个环之内,分布于两个环的萘亚甲基醌中间体的不对称催化反应尚未实现。由于这种萘亚甲基醌两个单元之间的距离较长,不对称控制更具挑战。作者首次使用这种萘亚甲基醌完成了不对称催化反应,从而合成了一系列具有远程手性中心的2-萘酚和2-萘胺衍生物(图1)。
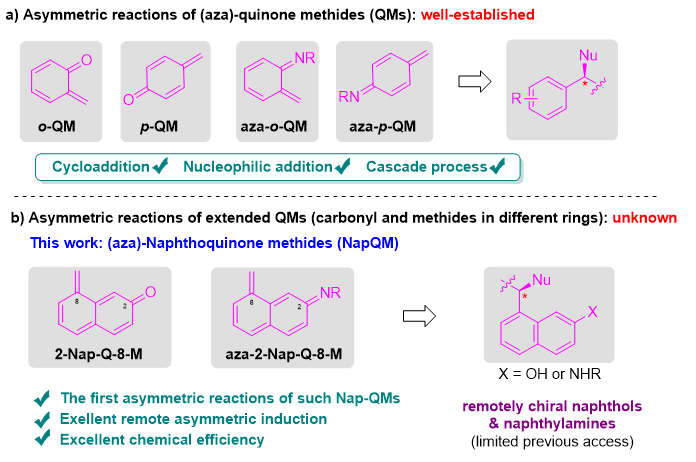
图1. 亚甲基醌化合物的研究进展
作者选用消旋的萘苄醇1a与咔唑2a作为模板底物,通过大量的条件筛选得出最优反应条件为:5 mol%的A4为催化剂,5Å分子筛为添加剂,二氯甲烷为溶剂,在室温下反应,能以较好的收率和对映选择性得到目标产物3a(图2)。
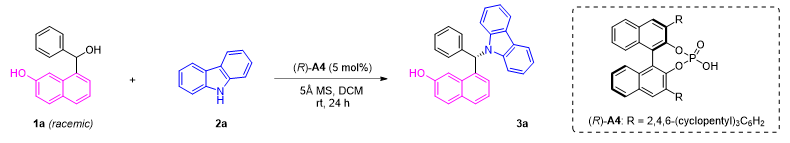
图2. 最佳反应条件
在最优反应条件下,作者对反应的适用范围进行了考察。结果显示该反应具有良好的官能团兼容性(图3)。
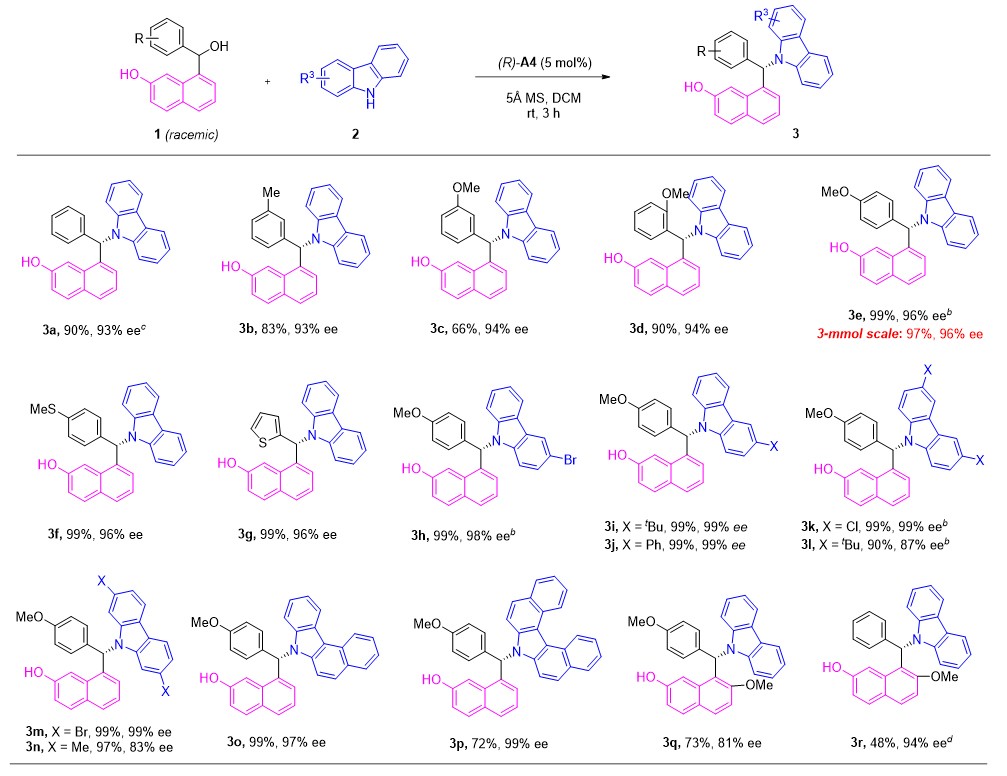
图3. 咔唑加成下底物的适用范围
接着,如果使用吲哚作为亲核试剂,对于多种取代基,反应同样可以以较高的产率及对应选择性得到相应产物(图4)。
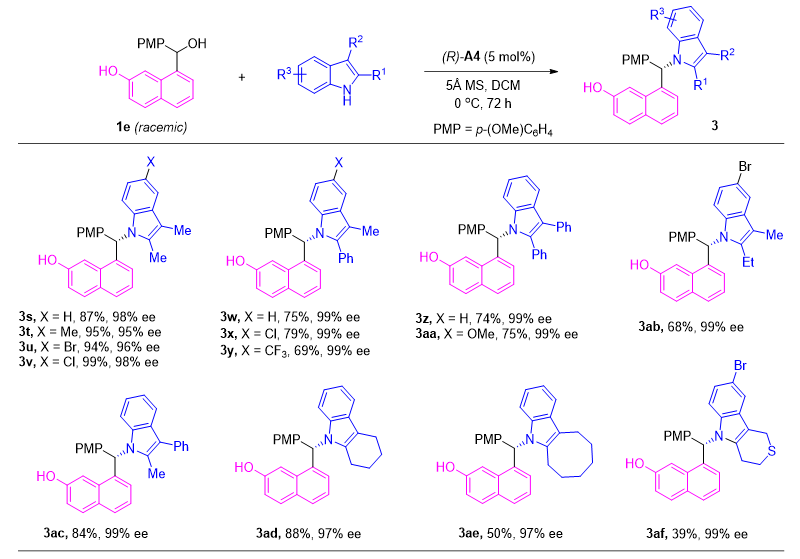
通过萘亚甲基醌中间体成功完成对2-萘酚衍生物对应选择性转化之后,作者进一步探索通过相应的氮杂萘亚甲基醌中间体将这种对应选择性转化扩展到萘胺的可行性。对此,在标准条件下,作者发现当使用金刚烷酰基保护的萘胺衍生物4和咔唑2a为模板底物时,反应可以以93%的ee值得到产物(图5)。
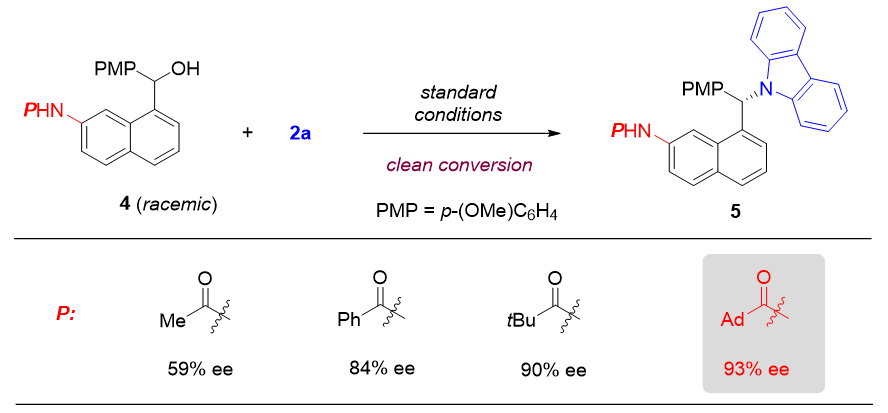
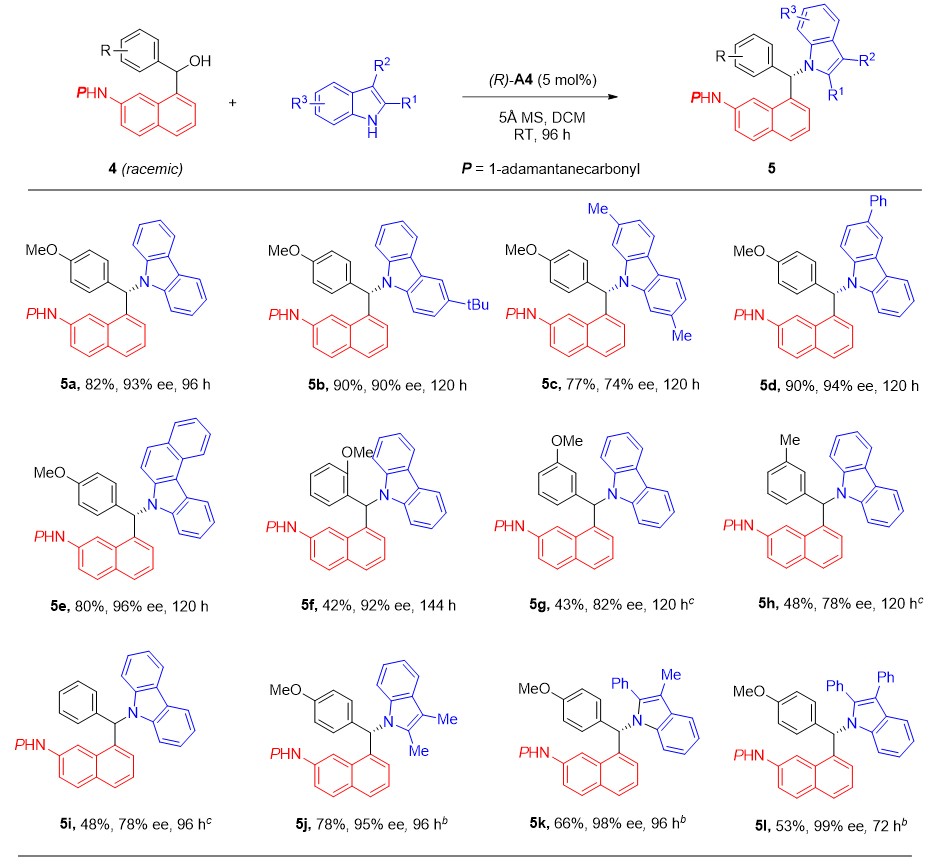
并且,该体系同样拥有良好的官能团容忍度(图6)。
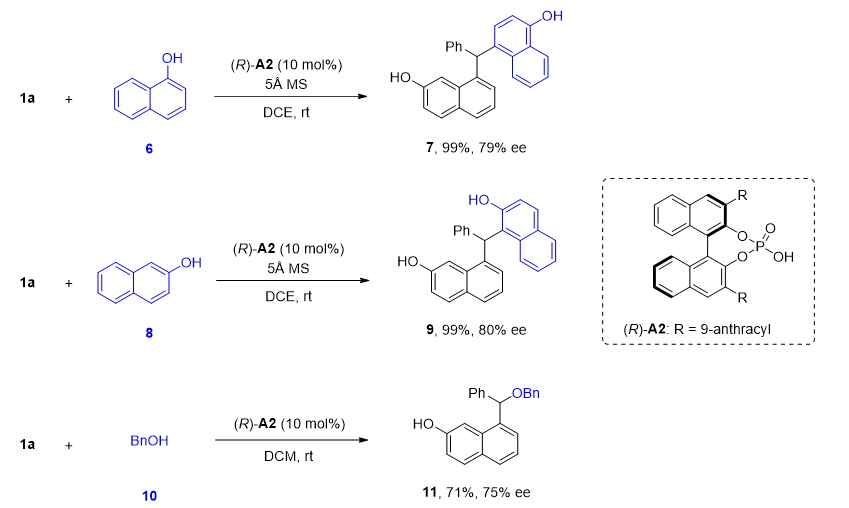
作者还评估了其他亲核试剂对萘亚甲基中间体的不对称加成。除了氮亲核试剂外,他们发现作为碳亲核试剂的α-萘酚、β-萘酚和氧亲核试剂的苄醇也适用于该反应(图7)。
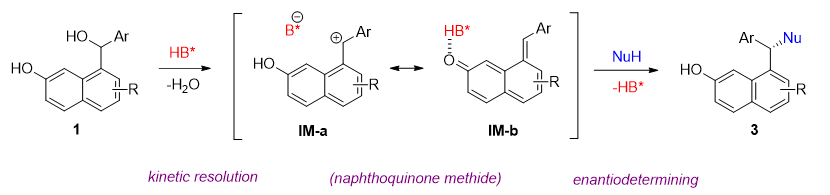
作者通过控制实验对机理进行了研究。首先,当使用甲基保护的萘酚1a’为底物在标准条件下进行反应,反应几乎不能得到预期的产物。这一结果与假设的萘亚甲基醌中间体一致,因为在没有游离羟基的情况下,这种中间体是难以获得的。此外,作者监测了反应进程中1e与3e的ee值,3e的ee值在反应过程中保持不变,但1e的ee价值随着时间的推移而增加。一方面,这一观察结果也证明了反应有萘亚甲基醌中间体的参与。另一方面也说明1e脱水得到萘亚甲基醌中间体存在动力学拆分的过程。总之,这些结果表明该反应并不经由直接的Sn2机理。同时,非线性效应也显示反应的对映选择性并非由单个磷酸分子控制(图8)。

在上述实验结果的基础上,作者提出了一种可能的反应途径,反应物1在酸催化下脱水得到碳正离子中间体IM-a,而该中间体可以通过萘环上的远端羟基转化为较为稳定的萘亚甲基醌中间体IM-b,随后发生由氢键诱导的不对称亲核加成反应(图9)。
为了证实所提出的机理,作者还对1a和2a之间的模型反应进行了DFT计算。计算结果证明了关键的萘亚甲基醌的生成,同时也证明了反应的对应选择性由两个磷酸分子所控制(图10)。
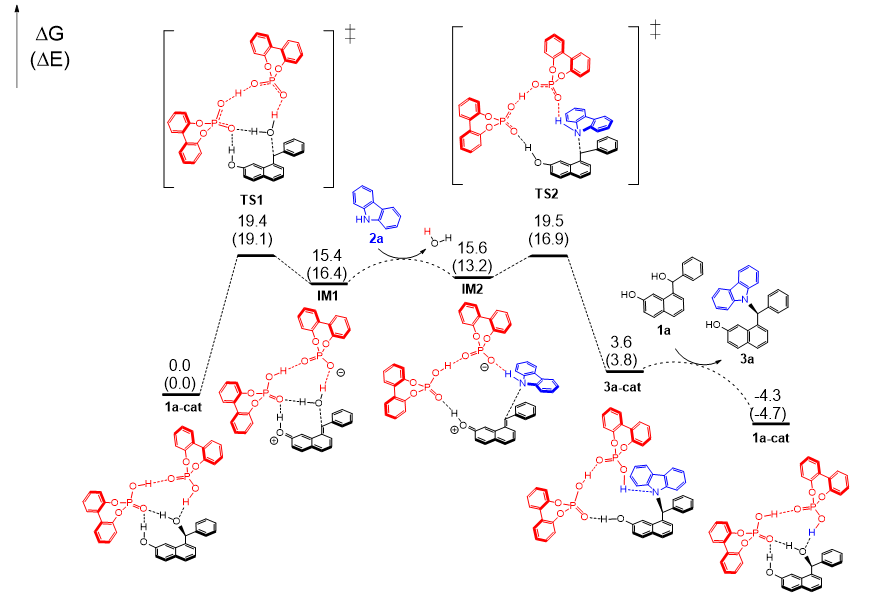
图10. DFT计算结果
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Asymmetric Synthesis of Remotely Chiral Naphthols and Naphthylamines via Naphthoquinone Methides
Shuxuan Liu, Ka Lok Chan, Zhenyang Lin*, and Jianwei Sun*
J. Am. Chem. Soc., 2023, 145, 12802–12811, DOI: 10.1021/jacs.3c03557
导师介绍
孙建伟
https://www.x-mol.com/university/faculty/7073
林振阳
https://www.x-mol.com/university/faculty/38301
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!


































 京公网安备 11010802027423号
京公网安备 11010802027423号