“铋”不可少:Nat. Chem.报道Bi催化的自由基C-N键交叉偶联反应
金属催化的自由基交叉偶联反应使得传统的双电子极性断裂模式发生了概念性转变,并为有机化合物的构建提供了新途径,特别是基于烷基自由基的偶联反应已被证明在构建C(sp3)-C/杂原子键方面具有巨大的潜力。近年来,光氧化还原催化和电化学合成领域的进展促进了上述合成策略的发展和应用,与第一排过渡金属催化结合之后尤其值得关注。当交叉偶联循环过程中需要单电子过程时,Fe、Co、Ni、Cu等占据优先位置,进而导致氧化还原过程可以通过(n)/(n+1)/(n+2)氧化态发生(图1a,右)。恰恰是这种特殊的化学行为导致某些前体(如:氧化还原活性酯(RAEs)、Katritzky盐(KSs))可以通过单电子转移(SET)的氧化加成产生相应的烷基自由基。另一方面,化学家在利用主族元素模拟过渡金属催化的氧化还原过程方面做出许多努力,例如:pnictogens可参与SN2-型极性氧化加成,从而在(n)/(n+2)氧化还原催化循环中实现双电子控制,进而模拟后过渡金属(图1a,左)。然而,氧化还原活性亲电试剂的自由基氧化加成通常仅限于第一排过渡金属,并且主族金属配合物仍难以实现这一过程。
近年来,德国马克斯•普朗克煤炭研究所的Josep Cornella教授(点击查看介绍)团队证明了Bi(III/V)或Bi(I/III)催化循环如何实现C-F(Science, 2020, 367, 313-317,点击阅读详细)、C-O(J. Am. Chem. Soc., 2020, 142, 11382)或C-H(J. Am. Chem. Soc., 2021, 143, 12487)的成键以及其它反应(J. Am. Chem. Soc., 2019, 141, 4235)。然而,尽管已知较重的主族元素可以产生持久且稳定的自由基,但化学家对铋自由基催化作用的研究还远远不够。近日,Josep Cornella教授课题组在Nature Chemistry 上报道了低价态铋络合物(1)如何与氧化还原活性的烷基自由基前体(如:烷基邻苯二甲酰亚胺酯和烷基Katritzky盐)进行单电子氧化加成并生成可表征的烷基铋(III)配合物,可作为Bi-C自由基平衡配合物(图1b,底部)。此外,作者发现此过程产生的α-氨基烷基自由基易被Bi(II)氧化为可以被N-亲核试剂捕获的亚胺阳离子,从而实现了Bi催化自由基C-N键交叉偶联反应(图1b,顶部),而且不需要借助光氧化还原体系、化学氧化剂、外部碱或电化学装置。
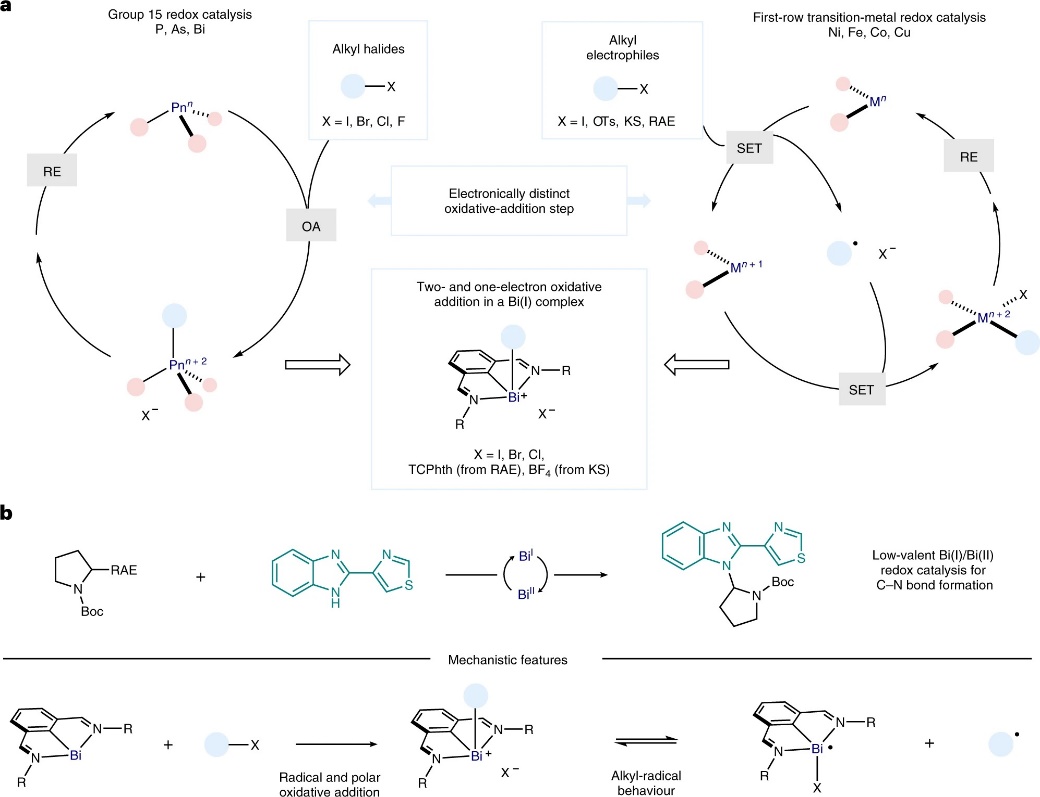
图1. 解锁铋的单电子氧化加成过程。图片来源:Nat. Chem.
由于Bi(I)中心6p2孤对电子的强亲核性,Bi(I)络合物(1)已被证明与烷基卤化物和三氟甲磺酸酯发生极性SN2型反应。类似地,1能与一系列苄基(伪)卤化物(如:Cl、Br、I、甲磺酸盐)定量反应并生成苄基-铋(III)配合物(5-8,图2b),同时循环伏安法分析证明C-X(X=卤化物)键断裂应该是通过经典的SN2途径进行。另外,电化学研究表明1可能与烷基氧化还原活性亲电试剂一起参与SET氧化加成过程(图2a),并且1与等量的四氯邻苯二甲酰亚胺(TCPhth)酯2反应后经SET、裂解、CO2释放和自由基重组得到苄基铋(III)配合物9,可通过NMR、高分辨质谱(HRMS)和X-射线衍射分析进行表征。此外,KS 4也能与1进行自由基加成反应并生成10。正如预期所示,非氯化邻苯二甲酰亚胺酯3与1混合时仍未反应。除了苄基之外,一级(12)或二级(13)RAEs也能发生同样的过程并得到稳定的烷基-铋(III)配合物,而三级RAEs(如:1-金刚烷羧酸衍生的RAEs)虽能与1反应,但得到的加合物不稳定并且不能在标准条件下进行表征。值得注意的是,该过程可以在芳基溴的存在下进行反应并以93%的收率获得唯一产物11,这说明该过程与经典的极性过渡金属氧化加成是正交的(图2b)。
另一方面,作者发现经典的SN2反应对空间效应很敏感(>24 h for 14),而相应RAE的单电子氧化加成在<5 min内就能定量形成配合物12。此外,作者发现配合物9、12和13在电子顺磁共振(EPR)光谱下具有活性,而12的低温EPR分析表明两个自由基物种以不同的速率衰变形成,这与C-Bi键的均裂相一致。事实上,用低温NMR监测1与环丙基甲基碘化物在黑暗中的反应(图2c),发现在-20 ℃反应1 h便可完全转化为环丙基甲基加合物16,再加热到50 °C会缓慢转化为开环化合物18(12 h后收率为35%),这表明16中的C-Bi键发生均裂并形成笼内自由基对(int-1)。此外,将16的溶液用蓝色LED照射5 min后会完全转化为18,进而说明光可以加速自由基开环过程。然而,当环丙基甲基RAE 17与1反应时未观察到16的类似物,但在黑暗中进行反应却能获得自由基开环产物19,这表明SET和RAE 17的断裂形成笼内铋(II)/烷基自由基对(int-1),其中环丙烷开环比自由基重组更快,从而导致19的形成。
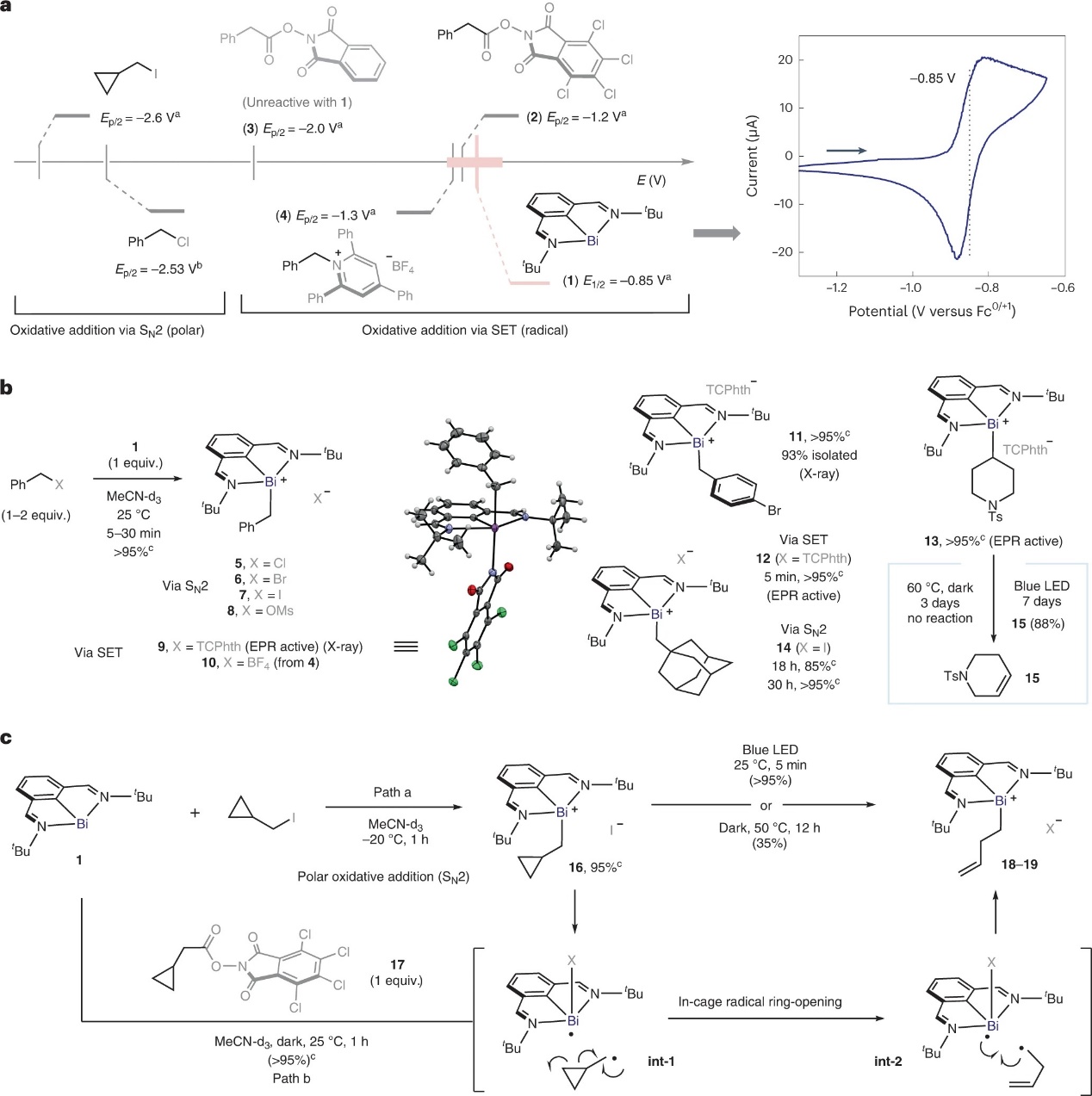
图2. 铋(I)的氧化加成。图片来源:Nat. Chem.
如图3a所示,配合物13产生的二级烷基自由基与Michael受体(如:苯基乙烯砜)在黑暗中(收率:57%)或蓝光照射下(收率:85%)进行反应时均能得到Giese加成产物21。另外,配合物13在溶液中是稳定的(图2b),即使在60 ℃放置3天也不会反应;但在蓝光LED照射下却缓慢地转化为消除产物15和Bi(I)。值得注意的是,当作者试图分离脯氨酸衍生的α-氨基烷基-铋(III)加合物23时,却观察到脱羧胺化产物24的形成,同时回收Bi(I)络合物1(图3a,右),这可能是由于相应的α-氨基烷基自由基被高活性铋(II)物种氧化为亲电型亚胺阳离子,再与TCPhth阴离子反应形成C-N键。随后,作者对C-N键交叉偶联反应进行了条件优化,并得到最佳反应条件:即RAE 22与苯并咪唑25在Bi(I)络合物1(10 mol%)为催化剂、DMA为溶剂的条件下于25 ℃反应2 h,可以88%的收率获得C-N键交叉偶联产物26(图3b),并且唯一观察到的副产物是TCPhth亲核竞争产物24和酰基转移产物27。对照实验表明无Bi催化剂时仅产生酰基转移产物,而添加TEMPO则完全抑制了反应。
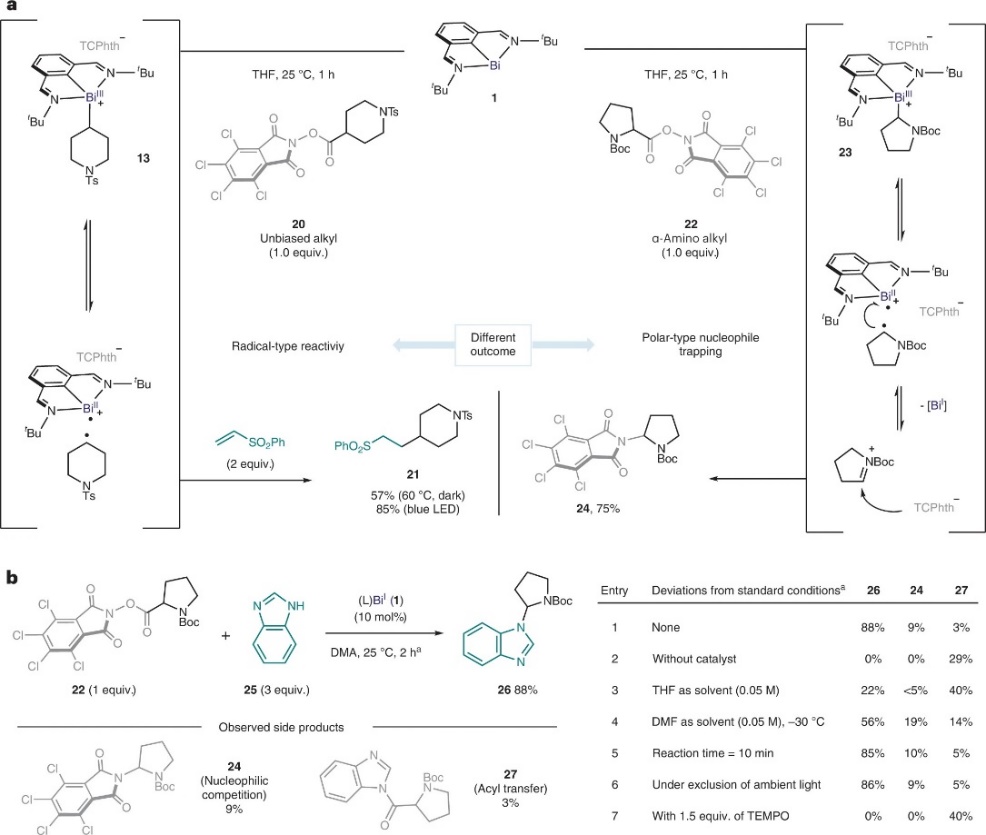
图3. 烷基-铋配合物和α-氨基烷基-铋配合物的反应性研究。图片来源:Nat. Chem.
在最优条件下,作者对C-N键交叉偶联反应的底物范围进行了考察(图4),结果表明天然/非天然α-氨基酸(如:脯氨酸(26)、苯丙氨酸(29)、缬氨酸(30、34)、亮氨酸(35)、谷氨酸(36)、哌可酸(32、33))衍生的RAEs均能兼容该反应,以良好的产率获得C-N键偶联产物。类似地,其它N-杂环(如:苯并咪唑(26、28、45)、三唑(37)、咪唑(38、44、46)、吡唑(32、33、40-43))也能顺利地转化为相应的C-N键偶联产物。有趣的是,非对称杂环(如:苯并三唑(39))也可以参与此转化,以5:1的N1/N2区域选择性获得相应产物。此外,该策略还可实现生物活性分子的后期修饰,包括:茶碱(47)、噻菌灵(48)、利鲁唑类似物(49)。值得一提的是,在无外加亲核试剂的情况下,α-氨基RAEs(24)和α-氧代RAEs(50、51)都能通过CO2释放得到脱羧胺化产物,这是对Gregory C. Fu报道光化学策略的补充,允许使用α-杂原子RAEs代替无电性差异的烷基底物。
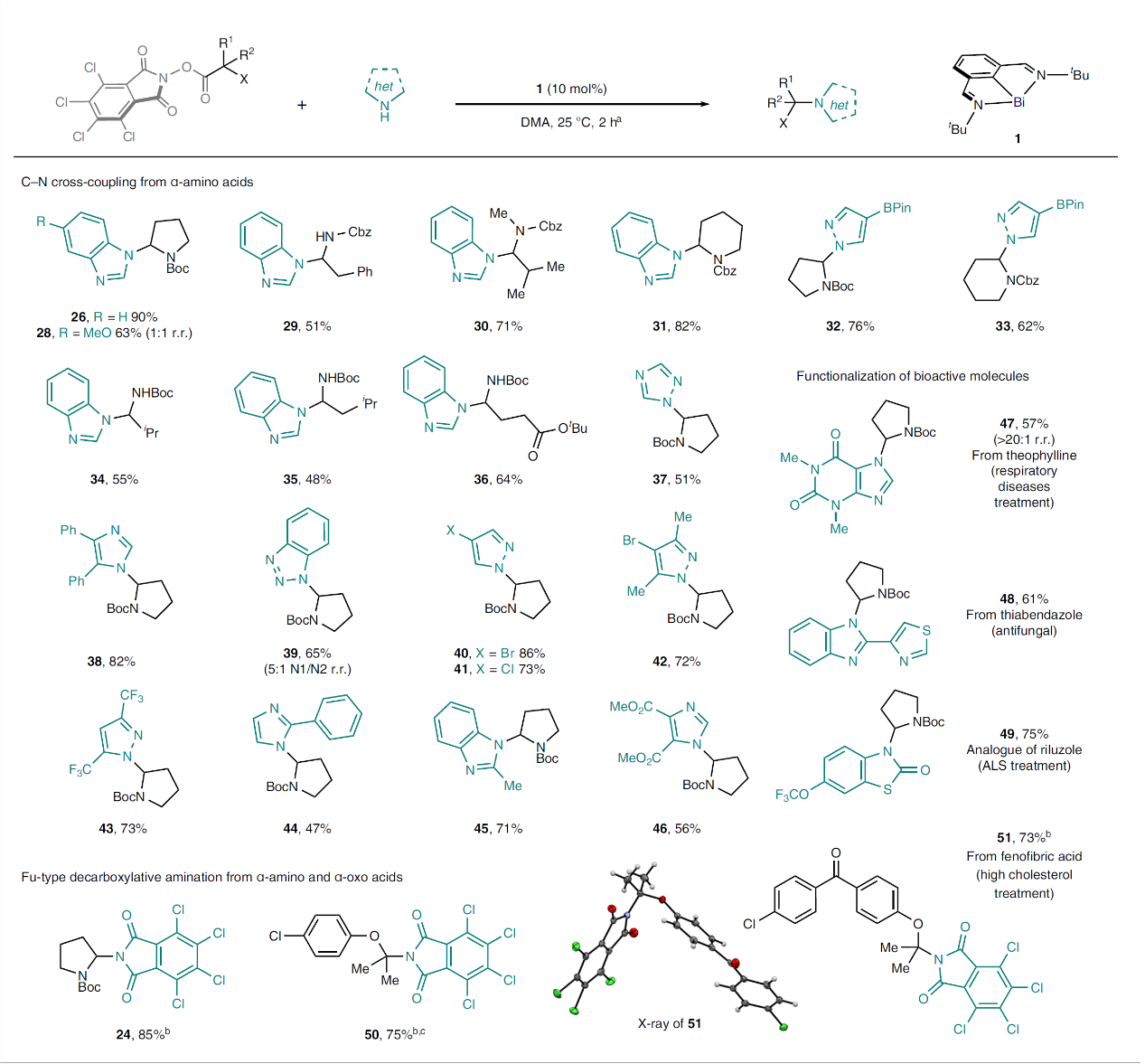
图4. 底物拓展。图片来源:Nat. Chem.
为了进一步探究反应机理,作者进行了一系列实验(图5),结果表明:1)1(10 mol%)与α-氨基RAE 22在DMF-d7为溶剂的条件下进行反应时,NMR监测表明α-氨基烷基-铋(III)中间体23会随着RAE的消耗而增加,并与Bi(I)络合物1共存;2)配合物23可以由1与22的反应进行表征;3)积累的23在-20 °C放置1 h后衰变为1(Bi(I/II/III)路径),并且RAE 22产生脱羧胺化产物24的速率高于前一过程。因此,作者考虑到另一种途径,即相应的笼内自由基对直接通过SET进行反应生成亚胺阳离子并再生Bi(I)(Bi(I/II)途径)。或者,上述自由基对经自由基重组导致23的积累,并最终生成产物24和1。总的来说,自由基氧化加成似乎是主导途径的决速步,正如1在整个反应过程中持续存在所表明的那样。重要的是,低温EPR光谱可以检测到强烈的单线信号,这与相应的α-氨基烷基自由基片段的存在相一致。此外,即使在黑暗中也能观察到这种强烈的EPR信号,进而说明Bi(I/II)在无外部光照射下也能促进这种反应性。

图5. 机理研究。图片来源:Nat. Chem.
总结
Josep Cornella教授课题组展示了铋(I)配合物如何与氧化还原活性的烷基自由基前体(如:烷基邻苯二甲酰亚胺酯和烷基Katritzky盐)进行单电子氧化加成并生成可表征的烷基铋(III)配合物,可作为Bi-C自由基平衡配合物。此外,作者发现此过程产生的α-氨基烷基自由基易被Bi(II)氧化为可以被N-亲核试剂捕获的亚胺阳离子,从而实现了Bi催化自由基C-N键交叉偶联反应,并且不需要借助光氧化还原体系、化学氧化剂、外部碱或电化学装置。总的来说,这些发现开辟了一个主族元素自由基偶联的领域,并为Bi自由基催化的相关转化铺平了道路。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Bismuth radical catalysis in the activation and coupling of redox-active electrophiles
Mauro Mato, Davide Spinnato, Markus Leutzsch, Hye Won Moon, Edward J. Reijerse, Josep Cornella
Nat. Chem., 2023. DOI: 10.1038/s41557-023-01229-7
导师介绍
Josep Cornella
https://www.x-mol.com/university/faculty/166344
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号