上科大杨晓瑜课题组Angew. Chem.:对映选择性多组分反应构建手性氮杂螺烯
螺烯是由多个芳环邻位稠和的多环芳香族化合物,由于其骨架末端芳环之间的空间排斥,迫使其在空间上呈现扭曲的螺旋状,从而具有独特的螺旋手性。由于其独特的螺旋手性以及刚性的π-共轭多环芳烃结构,手性螺烯在不对称催化、手性材料科学以及分子机器等众多领域中均有着广泛应用。其中,杂螺烯是一类在其分子骨架中含有杂芳环结构的螺烯分子,由于引入的杂芳烃自身具有的碱性、易氧化及良好的金属配位能力等属性,使得杂螺烯在应用中表现出更多独特的性质。因此,手性螺烯及杂螺烯的高效对映选择性合成受到有机化学家的广泛关注,近年来也诞生了一系列不对称催化构建手性螺烯骨架的方法,如过渡金属催化的三炔[2+2+2]环加成(J. Am. Chem. Soc. 2007, 129, 12078)以及炔烃的分子内氢芳基化反应(J. Am. Chem. Soc. 2014, 136, 5555)等。然而,这些方法大多局限于全碳骨架螺烯的构建,较少应用于杂螺烯的不对称构建;而且这些方法大多使用贵金属催化剂(如铑、金、钯等),其昂贵的价格也限制了这些方法的进一步应用。
不对称有机小分子催化相较于过渡金属催化具有绿色环保、官能团兼容性好等特点;然而相较于后者,不对称有机小分子催化在螺烯的不对称合成中则应用较少,到如今仅有几例相关的报道。近年来,闫海龙课题组在手性双官能团催化剂作用下利用邻亚乙烯基醌(VQM)中间体,实现了两类手性螺烯分子的不对称构建(图1A, B)。List课题组则报道了首例不对称有机催化手性螺烯的合成,他们利用手性Brønsted酸催化酮和芳基肼的双分子对映选择性Fischer吲哚合成实现了含有吲哚核的氮杂螺烯不对称合成(图1C)。2020年,Rodriguez和Bonne团队报道利用手性氢键催化剂实现了芳基酚与氯代硝基烯烃的双分子不对称[3+2]环加成串联消除反应,实现了氧杂螺烯的不对称合成(图1D)。
催化不对称多组分反应可以快速、多样化地合成具有结构多样性和复杂性的手性化合物,从而引起了化学家们的广泛关注。然而到目前为止,催化对映选择性合成手性螺烯的方法仍局限于单分子及双分子反应,催化不对称多组分反应在螺烯不对称合成中的应用尚未见报道。上海科技大学杨晓瑜(点击查看介绍)课题组近年来致力于手性有机小分子催化不对称构建非传统中心手性分子(平面手性:Angew. Chem. Int. Ed. 2022, 61, e2022010;轴手性二芳基醚:Angew. Chem. Int. Ed. 2023, 62, e202303430)。最近,该课题组利用手性磷酸催化下的三组分连续Povarov环化和氧化芳构化过程,以优异的对映选择性实现了一系列含有吡啶核的氮杂螺烯的不对称构建(图1E)。
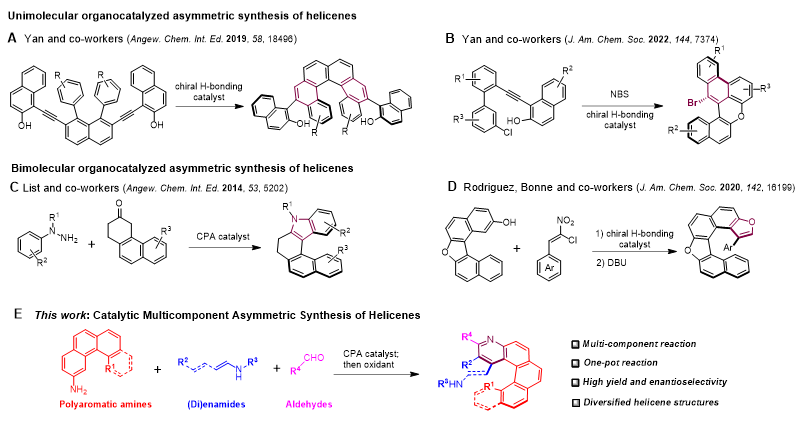
图1. 不对称有机小分子催化合成手性螺烯
作者以[4]-螺烯芳胺1a为前体,在手性磷酸催化下首先与苯甲醛3a形成亚胺,继而与烯胺2a发生对映选择性Povarov反应生成手性四氢喹啉型环化产物,该反应具有出色的区域选择性,仅生成芳胺1-位环化的产物;随后该产物在DDQ作用下经由氧化芳构化过程,最终以81%的产率和99% ee得到最终含有吡啶核的氮杂[5]螺烯4a(图2)。在得到最优的反应条件后,作者考察了该方法的底物范围,发现不同的醛、烯烃以及螺烯芳胺前体均能兼容该反应条件,并以优异的产率和对映选择性得到一系列螺旋手性的氮杂[5]螺烯和构型受限的氮杂[4]螺烯。
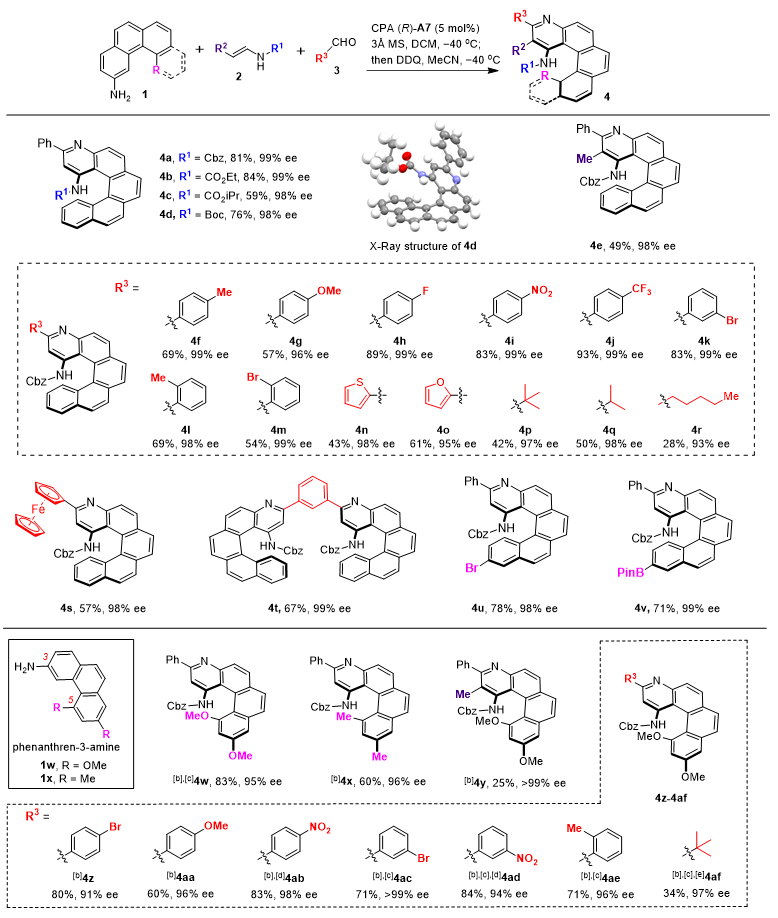
图2. 底物适用性考察
为了进一步拓展氮杂螺烯结构的多样性,作者进一步对二烯胺类化合物在该方法中的适用性也进行了考察。最终在对反应条件进行略微调整后,亚胺中间体可以和二烯胺5a在手性磷酸B2催化下以71%的产率及94% ee得到1-烯胺取代的氮杂[5]螺烯6a,且不同类型的醛也均适用于该反应(图3)。
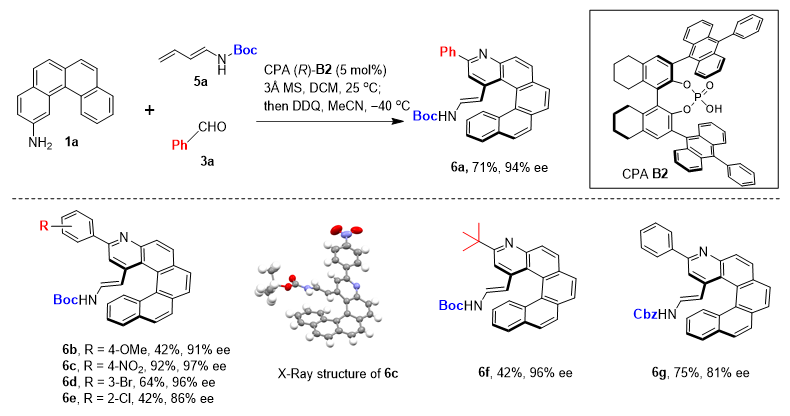
图3. 二烯胺适用性考察
为了进一步了解该三分子顺序环化-氧化芳构化的反应过程,作者以二烯胺5a与芳胺1a及苯甲醛参与的反应为模板对该反应的过程进行了详细的研究(图4)。在第一步Povarov环化反应结束后,作者观察到四氢喹啉型环化产物存在一对非对映异构体,并以82%的产率和94% ee分离得到7a,同时以8%的产率及77% ee得到非对映异构体7a’。随后,作者分别对7a和7a’在标准条件下用DDQ处理均得到对映选择性保持的相同构型的氮杂螺烯6a,这也表明螺烯产物的螺旋手性由四氢喹啉型环化产物C-1位的构型确定。此外,作者在-60 ℃下,用当量DDQ对7a进行处理,能够以52%的产率得到手性保持的亚胺型半氧化产物8a。此外,作者通过DFT计算研究了四氢喹啉型环化产物的潜在螺旋手性,计算结果表明 (P)/(M)-四氢喹啉型产物相互转化的过渡态能垒较低,这也说明四氢喹啉型产物的潜在螺旋手性并不稳定。基于以上结果,作者对该反应历程提出了一个可能的机理:芳胺与醛首先缩合形成亚胺,随后在手性磷酸介导下与烯胺发生环化反应并以优异的对应选择性及非对应选择性生成具有不稳定螺旋手性的四氢喹啉型环化产物。随后该中间产物在DDQ作用下,具有更稳定构象的四氢喹啉型中间体经由逐步脱氢芳构化形成构型稳定的氮杂螺烯;其中氮杂螺烯终产物的螺旋手性由四氢喹啉型产物C-1位立体中心转化而来。
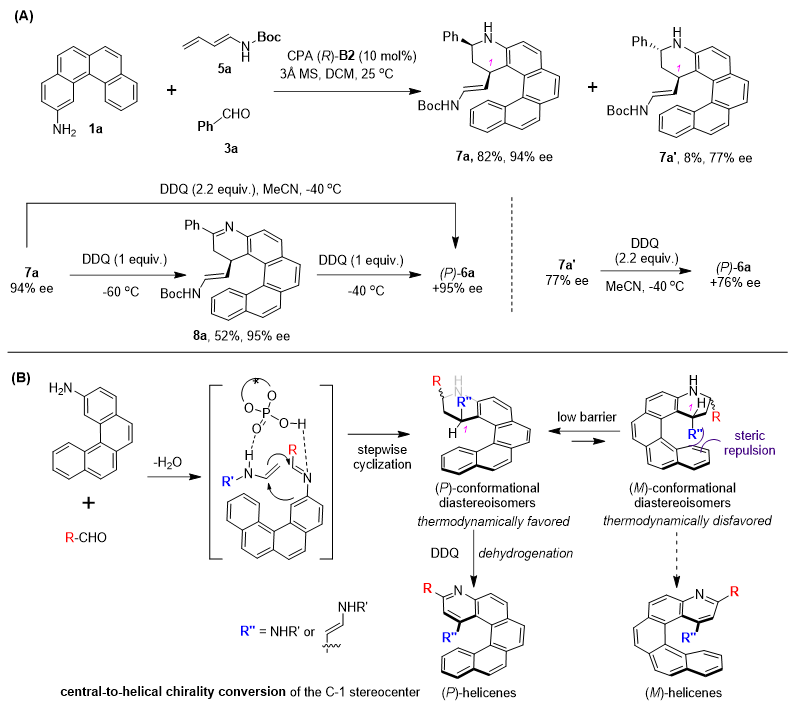
图4. 反应机理研究
为了进一步拓展该方法的应用前景,作者对4a、4w以及6a的合成进行了规模放大实验,结果显示均能以优异的产率及对映选择性得到相应的手性氮杂螺烯产物(图5A)。作者也对产物4a和6a进行了一系列转化,以优异的产率得到了一系列结构更加丰富的氮杂螺烯衍生物(图5B, C)。值得一提的是,作者通过两步简单的转化,从9a出发合成了一对互为非对映异构体的双官能团催化剂20a和20b,并将其与商业可得的双官能团催化剂20c和20d分别应用于2-苯并噻唑亚胺21a与邻苯二甲酸酐22a的不对称[4+2]环加成反应中(图5D)。反应结果显示,基于氮杂螺烯骨架的 (P,1S,2S)-20a能够给出明显优于20c和20d的催化结果,这也说明了手性螺烯骨架在该对映选择性反应中的重要作用。
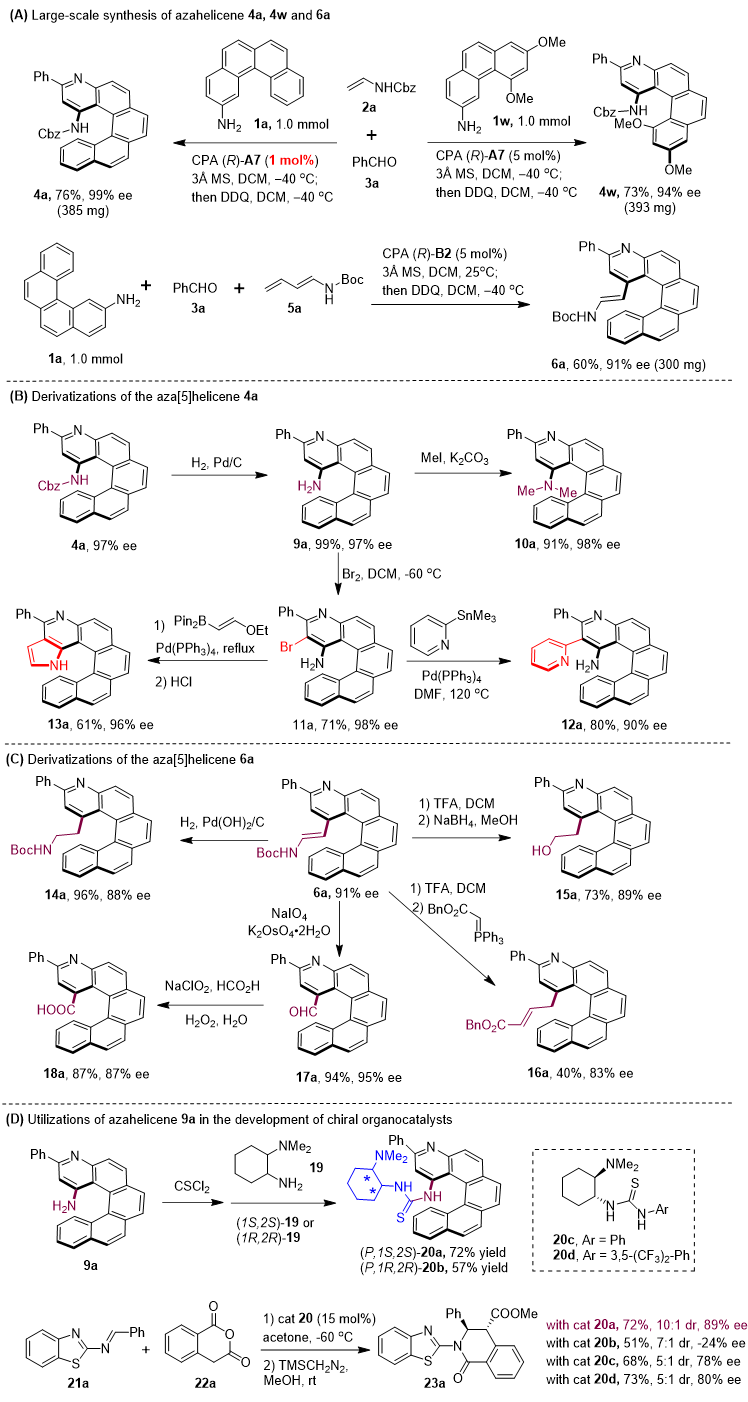
图5. 放大规模实验及手性产物衍生化
由于螺烯分子独特的π-共轭多环芳烃结构及其独特的空间螺旋结构,手性螺烯已经在材料领域得到了广泛的应用,特别是作为有机发光二极管(OLED)材料。作者对该系列氮杂螺烯分子的光物理性质及手性光学性质也进行了研究(图6)。值得注意的是,由于其分子骨架中存在的氮原子,使得该系列分子能够在酸性环境中被质子化,而质子化的螺烯分子则表现出不同的光学性质,且再次碱化处理后仍可恢复原状。这一系列独特的酸碱-触发光学性质转化有望应用于新型有机光电材料的开发中。
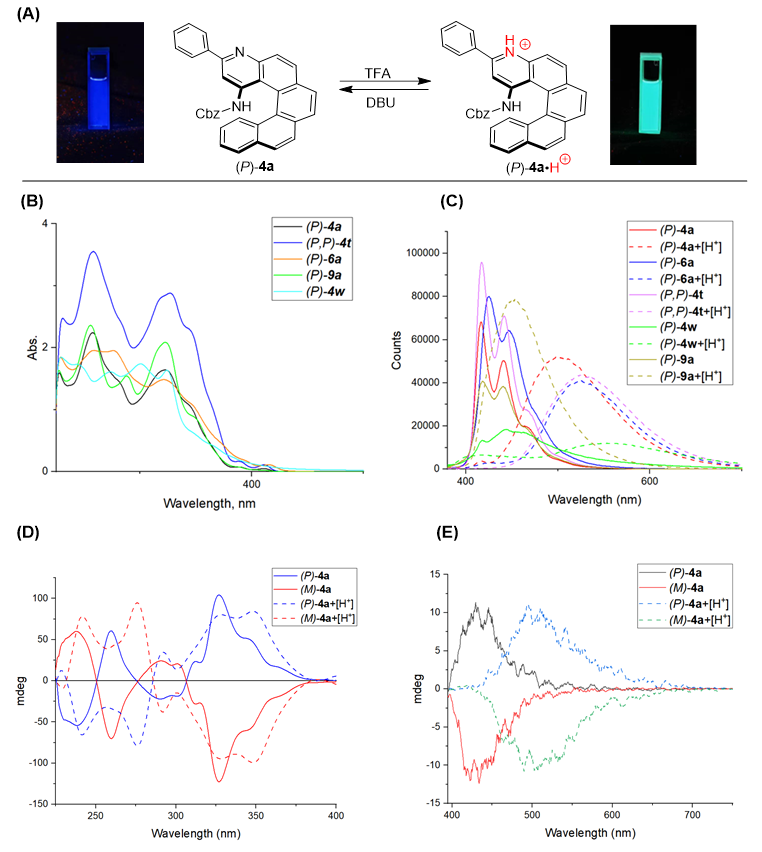
图6. 手性氮杂螺烯分子的光学性质
该研究成果近期发表在国际学术期刊Angew. Chem. Int. Ed.(《德国应用化学》)上。杨晓瑜课题组博士后刘炜与2020级博士研究生秦天人为本文第一作者,上海科技大学为本论文第一完成单位,杨晓瑜教授为本文通讯作者。以上工作都得到国家自然科学基金委、中国博士后科学基金、上海市超级博士后项目和上海科技大学科研启动资金的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective Synthesis of Azahelicenes through Organocatalyzed Multicomponent Reactions
Wei Liu#, Tianren Qin#, Wansen Xie, Jinmiao Zhou, Zidan Ye, Xiaoyu Yang*
Angew. Chem. Int. Ed., 2023, DOI: 10.1002/anie.202303430
导师介绍
杨晓瑜
https://www.x-mol.com/groups/Yang_Xiaoyu
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!





















































 京公网安备 11010802027423号
京公网安备 11010802027423号