中山大学JACS:胶原杂交的化学与生物学
胶原蛋白是人体含量最丰富的蛋白质,是几乎所有组织细胞外基质的最主要成分。它为细胞提供支撑和保护,并介导组织再生等众多生理过程。胶原蛋白是由三条多肽链通过链间氢键构成的三螺旋分子结构。这种结构在疾病和损伤的组织中可能被破坏,产生解旋的胶原三螺旋。
近年来,为了通过胶原蛋白的分子结构检测组织和机体损伤,胶原杂交的概念被提出,并发展出胶原杂交肽(Collagen Hybridizing Peptide,CHP)这一分子探针——CHP能够与解旋、变性的胶原蛋白链形成杂交的三螺旋,但与三螺旋完整的胶原分子没有亲和力,从而能够甄别、靶向机体和组织因降解重塑或机械破坏而产生的胶原损伤。近日,中山大学的李旸(点击查看介绍)团队及合作者在Journal of the American Chemical Society 上发表了综述文章,系统介绍了胶原杂交的概念和发展,总结了几十年来对胶原三螺旋折叠规律的化学探索,并讨论了当下与日俱增的生物医学研究,这些研究证实解旋胶原是一种有待关注的,广泛存在的病变组织细胞外基质特征。这是首篇聚焦胶原杂交原理与技术的综述文章。
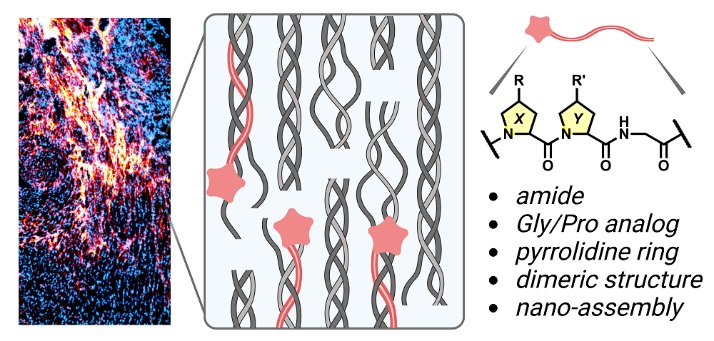
图1. 损伤组织(如心梗瘢痕)中存在大量结构破坏的胶原蛋白,其中胶原分子的三螺旋结构发生了大量解旋,可被胶原杂交肽(CHP)特异性地杂交结合。图片来源:J. Am. Chem. Soc.
胶原杂交的结构基础是CHP形成胶原三螺旋结构的强烈倾向性。这种倾向性由CHP多肽的关键结构元素主导。该综述总结了指导化学工作者设计三螺旋折叠类胶原多肽的的结构准则,包括(1)体积足够小的(类)甘氨酸残基;(2)促使多肽链间形成氢键网络的元素;(3)以吡咯烷环为主体结构的脯氨酸和羟脯氨酸残基及其替代物。这些化学结构的规律可应用于新的CHP多肽设计。
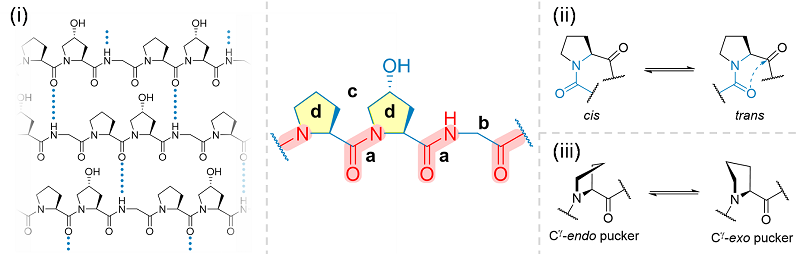
图2. CHP多肽探针的设计离不开对三螺旋结构与折叠的关键化学要素的理解。图片来源:J. Am. Chem. Soc.
目前,科学家对于胶原的变性解旋在疾病和损伤中的生物学意义的理解还处于起步阶段。胶原杂交技术的出现,使胶原解旋变得容易检测与测量。迄今,全球已经有数百实验室使用了该技术来评估由于酶解重塑、机械损伤等条件引起的组织内胶原解旋,比如心肌梗死、纤维化、椎间盘退变和肌腱劳损等。通过综述近3年来生物医学研究中利用CHP揭示的数十项适应症中的解旋胶原,科研人员有望进一步阐明胶原破坏作为组织损伤标志物的生物医学意义,为众多疾病的诊疗提供新靶点和思路。
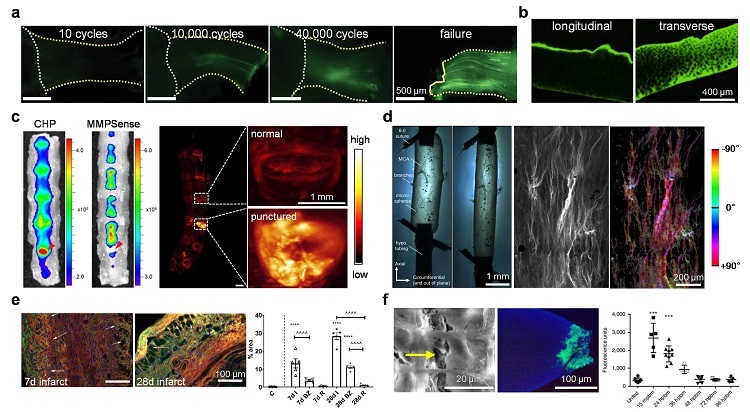
图3. 通过胶原杂交揭示的机械性组织损伤,包括在跟腱(a)、软骨(b)、椎间盘(c)、血管(d)、心脏(e)、肠道(f)等组织中发现的机械损伤。图片来源:J. Am. Chem. Soc.
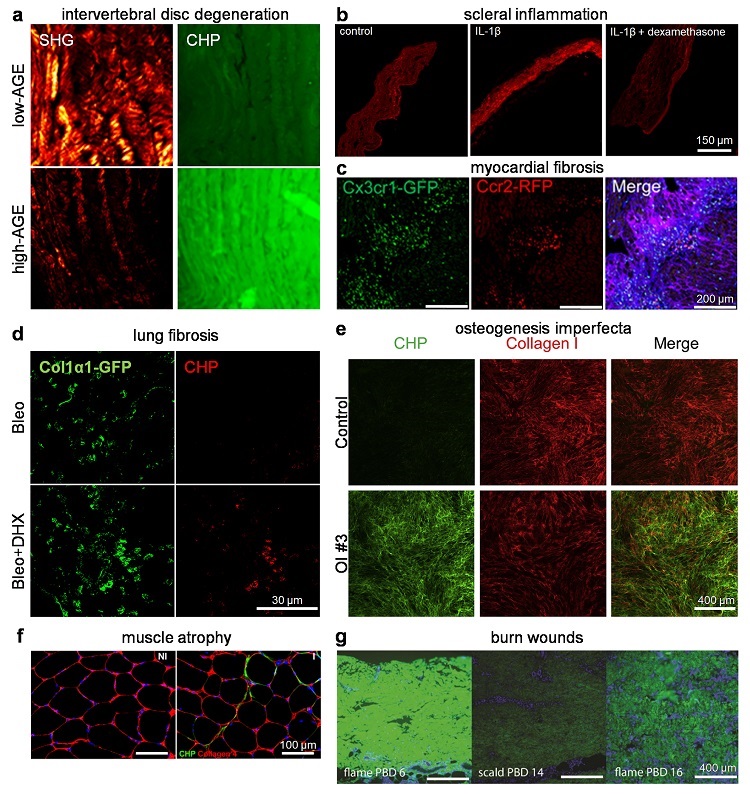
图4. CHP标记的疾病组织重塑产生的解旋胶原,包括在椎间盘炎症退变(a)、巩膜炎症(b)、心肌纤维化(c)、肺纤维化(d)、成骨不全症(e)、肌肉萎缩(f)、烫伤(g)等病变中发现的解旋胶原。图片来源:J. Am. Chem. Soc.
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

The Chemistry and Biology of Collagen Hybridization
Xiaojing Li, Qi Zhang, S. Michael Yu*, and Yang Li*
J. Am. Chem. Soc., 2023, DOI: 10.1021/jacs.3c00713
两位共同第一作者

张祺(左)和李晓静(右)
李旸研究员

李旸课题组网站:
https://www.x-mol.com/groups/ChemBioCollagen
微信公众号与Bilibili:“胶原三螺旋”
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号