锰配合物诱导DNA损伤有助于激活cGAS-STING信号通路
环磷酸鸟苷-腺苷合成酶(cGAS)-干扰素基因刺激因子(STING)是体内感受细胞质DNA的重要信号通路。激活cGAS-STING通路能影响下游一系列免疫相关事件,如刺激和募集TANK-结合激酶1(TBK1)和干扰素调节因子3(IRF3)、诱导I型干扰素(IFN-I)、促炎因子IL-6和TNF-α的分泌和释放、促进树突状细胞(DC)成熟和迁移、交叉启动肿瘤特异性T细胞等,由此可以调节先天及适应性免疫反应。由于该通路在抗肿瘤免疫中发挥重要作用,因此是肿瘤免疫治疗的重要靶点。
锰是人体内重要的微量元素,参与许多生理过程。新近研究表明,Mn2+可以增强cGAS的灵敏度,并触发第二信使cGAMP的产生,从而增强STING和cGAMP之间的亲和力。然而,激活cGAS-STING通路需要高剂量的Mn2+,但是高浓度的Mn2+会引起神经毒性和心血管毒性,所以其医学应用受到很大限制。锰配合物具有较高的生物稳定性和惰性,可以降低游离Mn2+的系统毒性,使其治疗肿瘤的潜力得以充分发挥。
南京大学王晓勇教授(点击查看介绍)研究团队最近报道了两种多功能锰(II)配合物MnPC和MnPVA(图1),其中1,10-邻菲啰啉(P)作为DNA嵌入剂有利于DNA损伤,丙戊酸(VA)作为组蛋白去乙酰化酶(HDAC)抑制剂可阻碍DNA损伤修复,它们与锰形成配合物可以加强DNA损伤效果,并激活抗肿瘤免疫反应,实现以化学免疫机制治疗肿瘤的目的。
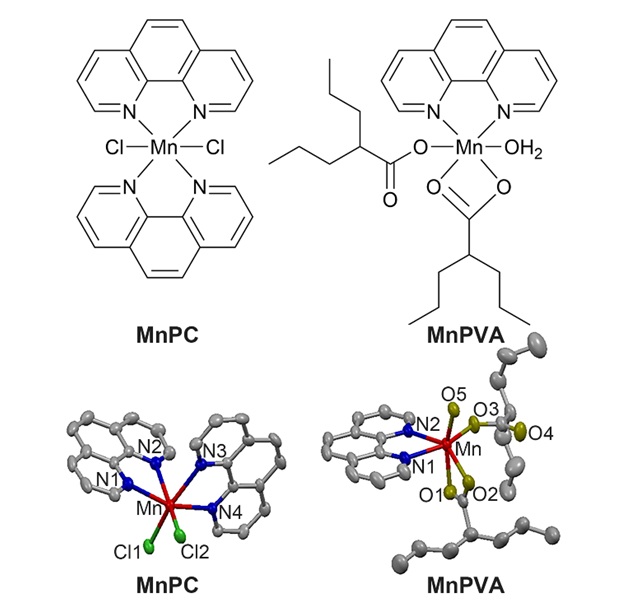
图1. MnPC和MnPVA的化学结构和晶体结构
一方面,MnPC和MnPVA通过嵌入和氧化作用损伤细胞核或线粒体DNA,而且作为HDAC和PARP抑制剂阻止DNA损伤修复,从而增强DNA损伤(图2),直接诱导肿瘤细胞凋亡,产生较强的细胞毒活性(表1)。
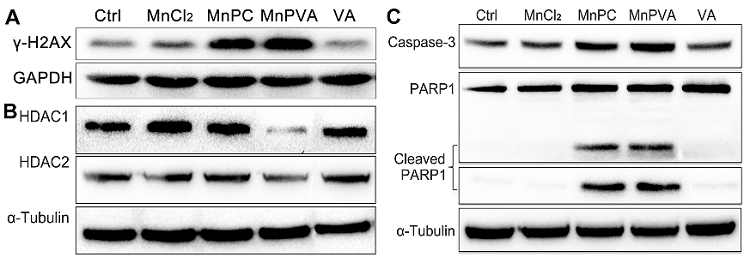
图2. 化合物(6 µM)与MDA-MB-231细胞孵育24 h后细胞内DNA双链断裂标志蛋白γ-H2AX(A)、孵育48 h后细胞内DNA修复相关蛋白HDCA1/2(B)和PARP1(C)的表达。

表1. 化合物对不同细胞的毒性(IC50,µM,72 h)
另一方面,由于MnPC和MnPVA能有效损伤DNA,增加细胞质中DNA片段的含量,从而促进肿瘤细胞和免疫细胞中cGAS-STING通路的激活及下游TBK1和IRF3的上调(图3),启动了固有免疫应答和肿瘤细胞与邻近免疫细胞之间的双向交流。
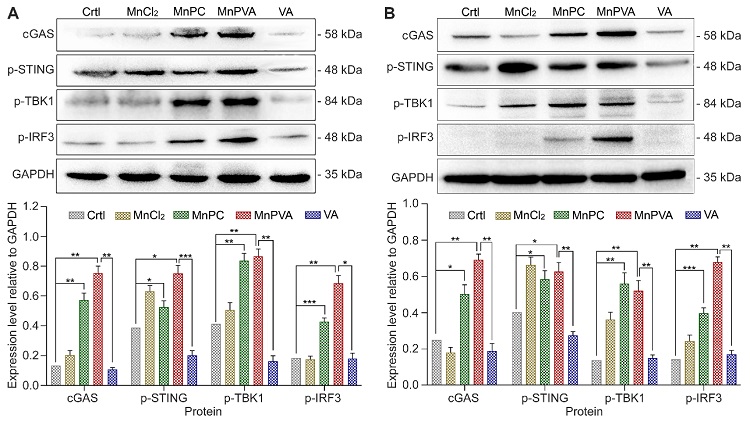
图3. MDA-MB-231细胞(A)和THP-1细胞(B)分别与6 µM和3 µM化合物孵育24 h后cGAS-STING通路相关蛋白的表达及蛋白相对含量。
激活的TBK1和IRF3转位到细胞核,诱导产生IFN、IL-6和TNF-α,它们从细胞核分泌到细胞质和肿瘤微环境中,促进DC和巨噬细胞成熟和抗原提呈,并诱导巨噬细胞由促肿瘤M2表型向抗肿瘤M1表型极化,刺激细胞毒性T细胞(图4)杀伤肿瘤细胞。
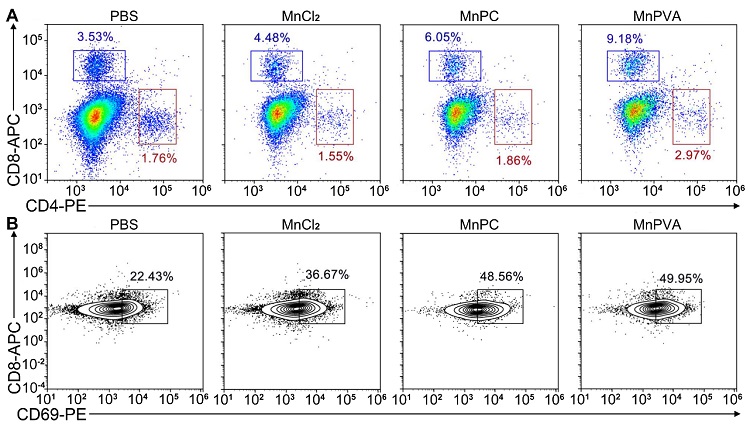
图4. 化合物(1.3 mg Mn kg‒1)治疗4T1荷瘤小鼠16天后,肿瘤组织中CD8+ T(蓝框)和CD4+ T(红框)细胞的表达(A)及CD8+ T细胞中CD69+亚群的表达(B)。
由于1,10-邻菲啰啉和丙戊酸配体使配合物的DNA损伤能力增强,从而提高了MnPC和MnPVA激活cGAS-STING通路的能力,使其表现出比Mn2+更强的免疫活性和抗肿瘤活性,显示出作为肿瘤化学免疫治疗剂的巨大潜力(图5)。
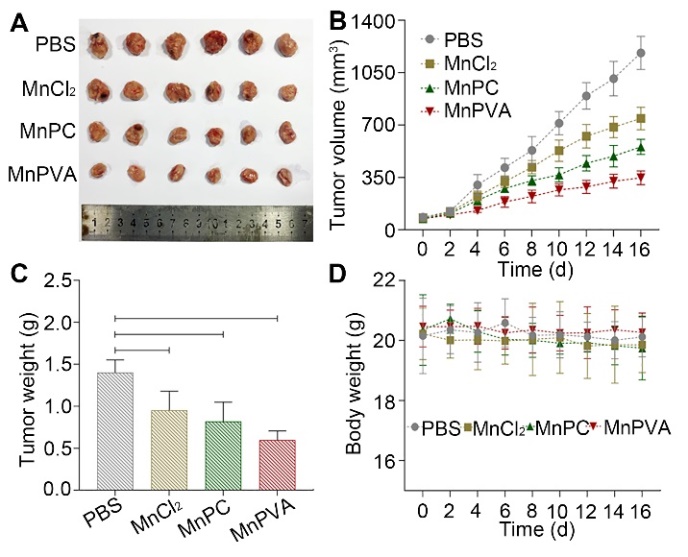
图5. 化合物(1.3 mg Mn kg‒1)对4T1荷瘤小鼠的治疗作用。(A)16天后肿瘤图像,(B)肿瘤体积,(C)肿瘤重量,(D)小鼠体重。
锰配合物不仅通过损伤DNA直接杀死肿瘤细胞,也通过激活免疫反应间接杀死肿瘤细胞,具有化学免疫协同治疗的特点,其作用机制概括如下(图6)。
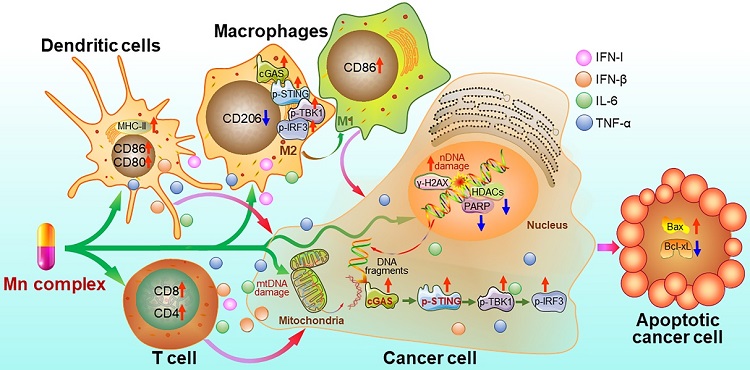
图6. 锰配合物损伤DNA、激活抗肿瘤免疫反应的作用机制
以上结果表明,在肿瘤细胞和免疫细胞中,MnPC和MnPVA对cGAS-STING信号通路的刺激能力远高于MnCl2或Mn2+,因为它们能诱导产生更多的DNA碎片释放到细胞质中,激活cGAS-STING通路。所以,通过构建具有损伤DNA或阻断修复DNA损伤功能的锰配合物可以获得更有效的cGAS-STING激动剂。
该论文发表在Chem. Sci.,第一作者是南京大学生命科学学院博士生蔡林祥,通讯作者是南京大学医药生物技术国家重点实验室王晓勇教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Manganese(II) complexes stimulate antitumor immunity via aggravating DNA damage and activating cGAS-STING pathway
Linxiang Cai, Ying Wang, Yayu Chen, Hanhua Chen, Tao Yang, Shuren Zhang, Zijian Guo, Xiaoyong Wang
Chem. Sci., 2023, 14, 4375–4389, DOI: 10.1039/d2sc06036a
导师介绍
王晓勇
https://www.x-mol.com/groups/Wang_Xiaoyong
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
镧系离子-核苷酸配位纳米激动剂活化STING信号通路 2022-09-11
-
干预DNA损伤修复机制的抗耐药性四价铂抗癌前药 2020-04-24
-
靶向线粒体代谢和糖酵解的金属抗肿瘤药物 2019-04-20
-
同时光激活cGAS-STING通路和焦亡的Pt(II)-三苯胺配合物用于癌症免疫治疗 2022-08-28
-
Self-Oxygenated Hydrogel Enhances Immune Cell Response and Infiltration Via Triggering Dual DNA Damage to Activate cGAS-STING and Inhibiting CAFsHuiting Tian, Nan Zhu, Haiting Wang, Yanpo Li, Qiuping Yang, Haolin Chen, Zhongming Zhou, Jianhui Tan, Huihui Zheng, Jiayi Xie, Wei Li, Min Liang, Zhaoze Guo, Zhiyang Li
-
cGAS-STING Pathway Activation and Systemic Anti-Tumor Immunity Induction via Photodynamic Nanoparticles with Potent Toxic Platinum DNA Intercalator Against Uveal MelanomaHui Tao, Jia Tan, Hanchen Zhang, Hong Ren, Ziyi Cai, Hanhan Liu, Bingyu Wen, Jiaqi Du, Gaoyang Li, Shijie Chen, Haihua Xiao, Zhihong Deng


































 京公网安备 11010802027423号
京公网安备 11010802027423号