Nature:被忽视的合成“好”试剂——1,2,3-环己三烯
自1825年法拉第分离出一种化学式为C6H6的未知化合物以来,苯(1,图1A)及其异构体的研究在不同领域取得了巨大进展,包括共振论的发展、芳香性的发现以及无数合成方法的发展。在数百种已知和假定的苯异构体中,环张力异构体(2-4)在有机化学历史中有着重要的地位,例如:杜瓦苯(2)和棱柱烷(4)经常出现在教科书中。相比之下,苯的另一种环张力异构体——1,2,3-环己三烯(5)就不那么受重视了,该化合物直到1990年才通过实验得以验证,后续相关实验研究也少有报道,被普遍认为太不稳定而无法用于有机合成。与苯相比,1,2,3-环己三烯中的三个烯烃相互堆积形成了高张力结构,同时由于缺乏苯的芳香稳定性而具有更高的自由能(DFT计算值为+101 kcal/mol),可发生在动力学和热力学上有利的反应(图1B)。更具体地说,苯由于芳香稳定性的破坏使得1→6的转化是不利的;而1,2,3-环已三烯进行类似反应时(5→7)能够释放相当大的张力,在动力学和热力学上是有利的。
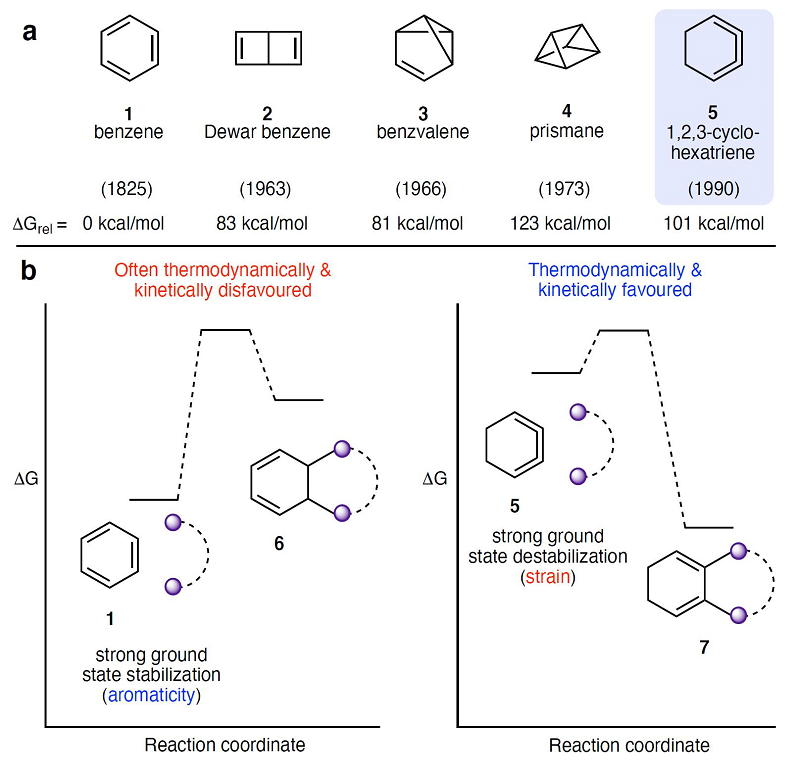
图1. 苯的互变异构体及其对比。图片来源:Nature
从概念上讲,苯张力异构体1,2,3-环己三烯(5)与芳炔、张力环炔(8)和张力环联烯(9,图2A)密切相关。自20世纪60年代以来该化合物一直没有得到充分的探索,迄今为止仅在文献中出现了四项相关研究,例如:1)Johnson和Paquette小组分别在两个Diels-Alder捕获反应中涉及到1,2,3-环己三烯;2)Johnson在线性前体的真空闪热解过程中注意到稠合双环1,2,3-环己三烯的中间作用;3)Saito等人报道了1,2,3-环己三烯和硝酮的[4+2]环加成反应,但形成了重排途径生成的产物。近日,美国加州大学洛杉矶分校(UCLA)的Neil K. Garg教授(点击查看介绍)课题组对1,2,3-环己三烯及其衍生物的反应性进行了深入的研究,证明它们能够参与一系列的反应模式,包括多种环加成、亲核加成和σ键插入(图2B),可用于快速构建不同骨架的产物分子。他们的工作表明,1,2,3-环己三烯及其衍生物是一类被忽视但颇具应用潜力的有机合成试剂。相关成果发表在Nature 上。

图2. 环张力中间体及其研究概述。图片来源:Nature
首先,作者利用DFT计算对比了1,2,3-环己三烯(5)与其异构体苯(1)及苯炔(20)的几何和电子结构(图3A),研究结果表明苯的几何结构特征是等效的120°内角,而同分异构体(5)与苯炔(20)在所示位置上的内角均更宽(分别为131°和127°),这是由于它们将两个形式上sp-杂化的碳原子限制在六元环中,进而导致1,2,3-环己三烯(5)和苯炔(20)的张力能计算值为~50 kcal/mol,并且5的几何形状与Johnson等人早期报道非常一致。另外,作者还发现苯(1)及其异构体1,2,3-环己三烯(5)和苯炔(20)的HOMOs均位于共轭π-体系,但LUMO结构却显著不同。不同于苯的LUMO,5的LUMO主要集中在三烯的平面π键中心,导致能量显著降低了1.5 eV。尽管5和苯之间的LUMO结构和能量明显不同,但其与苯炔(20)的LUMO具有很强的相似性,这表明环己三烯(5)应该具有苯炔的强亲电性和进行环加成反应的倾向性。
随后,作者利用Silyl triflate(21)来制备1,2,3-环己三烯(5)并对其与17的捕获实验进行了探索(图3B)。对反应条件进行优化后,作者发现在CsF为氟源、Bu4NOTf为氟增溶剂、THF为溶剂的条件下于60 ℃进行反应时效果最好。具体而言:1)1,2,3-环己三烯三烯(5)与不同的二烯(如:异苯并呋喃、呋喃和吡咯)能顺利进行反应,并以61-72%的产率获得 (4+2) 环加合物(27-30);2)与亚胺(31)和(32)进行偶极 (3+2) 环加成反应并获得相应产物(35-36);3)与烯酮缩醛(33)进行形式上 (2+2) 环加成反应并获得环丁烷(37);4)与亲核试剂苯酚钠(34)进行反应可直接获得加合物(38)。
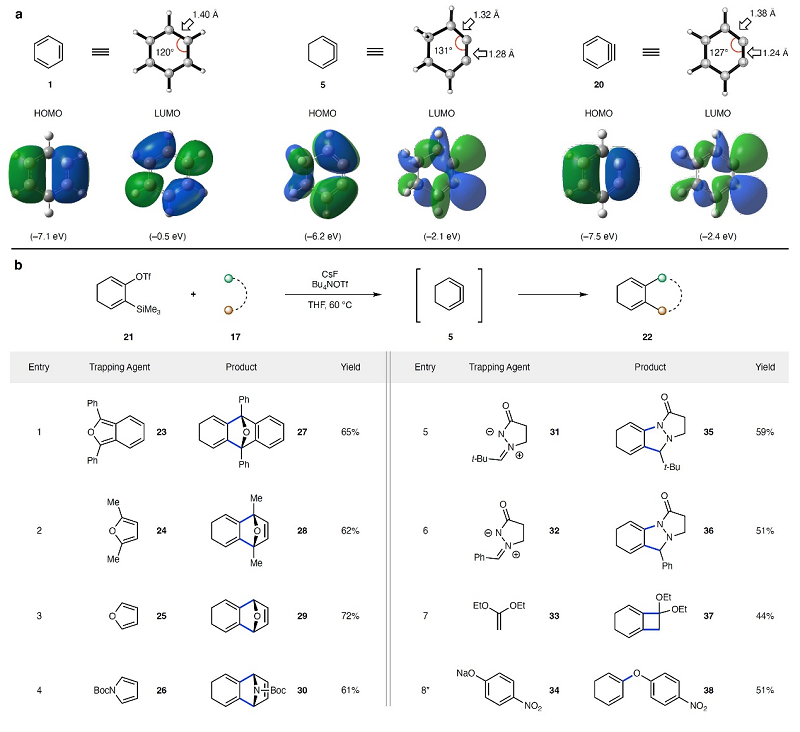
图3. 苯、1,2,3-环己三烯和苯炔的结构分析及张力三烯的捕获实验。图片来源:Nature
鉴于目前仅有一篇文献报道了1,2,3-环己三烯衍生物的合成,但是该过程需要600 ℃的反应温度,并通过假定的三烯中间体的单分子重排产生混合物。基于此,作者对两种新型的1,2,3-环己三烯(二取代和单取代)衍生物的合成及其反应性进行了研究(图4A),即以溴代烯基酯(39)为原料,经retro-Brook重排、1,2-加成、Stork-Danheiser反应、α-甲基化和三氟甲磺酸化五步实现了二取代三烯前体(42)的合成。对反应条件进行稍加修改后,便可实现二取代三烯(43)的一系列反应(图4B),具体而言:1)与富电子或缺电子二烯进行 (4+2) 环加成反应并获得产物(50-52);2)与亚胺(31-32)、硝酮(46-47)、喹啉酰亚胺(48)或异喹啉酰亚胺(49)发生 (3+2) 环加成反应获得相应产物(53-58);3)与氧化吡啶(59)发生 (5+2) 环加成反应构建 [3.2.1]双环化合物(66);4)与烯酮缩醛(33)、烯胺(60)、硫代酮(61)发生形式上 (2+2) 环加成并获得相应产物(67-69);5)与氧、硫、氮或碳亲核试剂(34和62-65)发生亲核加成获得二烯产物(70-74)。值得注意的是,在碳亲核试剂(64-65)与三烯进行的反应中,作者还分离出C-C σ-键插入产物,类似于已知的芳炔插入反应。
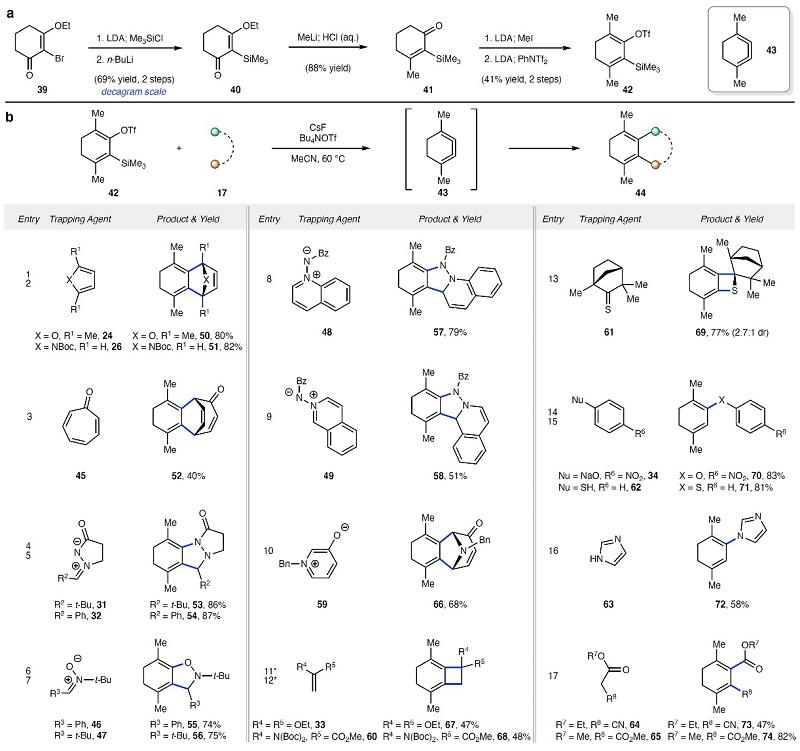
图4. 二取代环三烯前体的制备及反应范围。图片来源:Nature
其次,作者利用DFT计算研究了不对称单取代1,2,3-环己三烯(75)的结构并对其进行优化(图5A)。根据Bent规则,C1-Si键向C1方向的极化会导致三烯75内部sp杂化的碳再次杂化,并强烈地扭曲了基态几何形状,导致其相对于未取代三烯(5,θC2=θC3=131°)而言,C1=C2=C3键角(θC2=146°)明显变平,C2=C3=C4键角(θC3=118°)收缩。事实上,这种几何畸变导致取代三烯的电子分布发生了变化,其中C2带有轻微的正电荷,C3带有轻微的负电荷,因此作者推测可以对75进行区域选择性捕获。为了验证这一假设,作者制备了三乙基硅基取代的silyl triflate(76)并对其进行了捕获实验(图5B),结果显示大位阻烯胺(77)由于立体控制在三烯的C3位(远离大位阻三乙基甲硅烷基)进行选择性加成并获得加合物78,而使用位阻较小的亲核试剂(34)进行反应时则观察到完全相反的C2区域选择性(79)。事实上,DFT计算显示在C2位进行加成(TS-1)要比C3位(TS-2)更有利(ΔΔG‡=3.1 kcal/mol,ΔΔE‡=4.6 kcal/mol),而DIAS模型显示TS-2中三烯80的畸变比TS-1更大(图5C),并且两者的相互作用能存在很大差异(ΔΔE‡int=3.2 kcal/mol)。总的来说,立体构型、畸变和相互作用都有助于控制选择性,这意味着取代的1,2,3-环己三烯可用于具有潜在可预测结果的区域选择性反应。
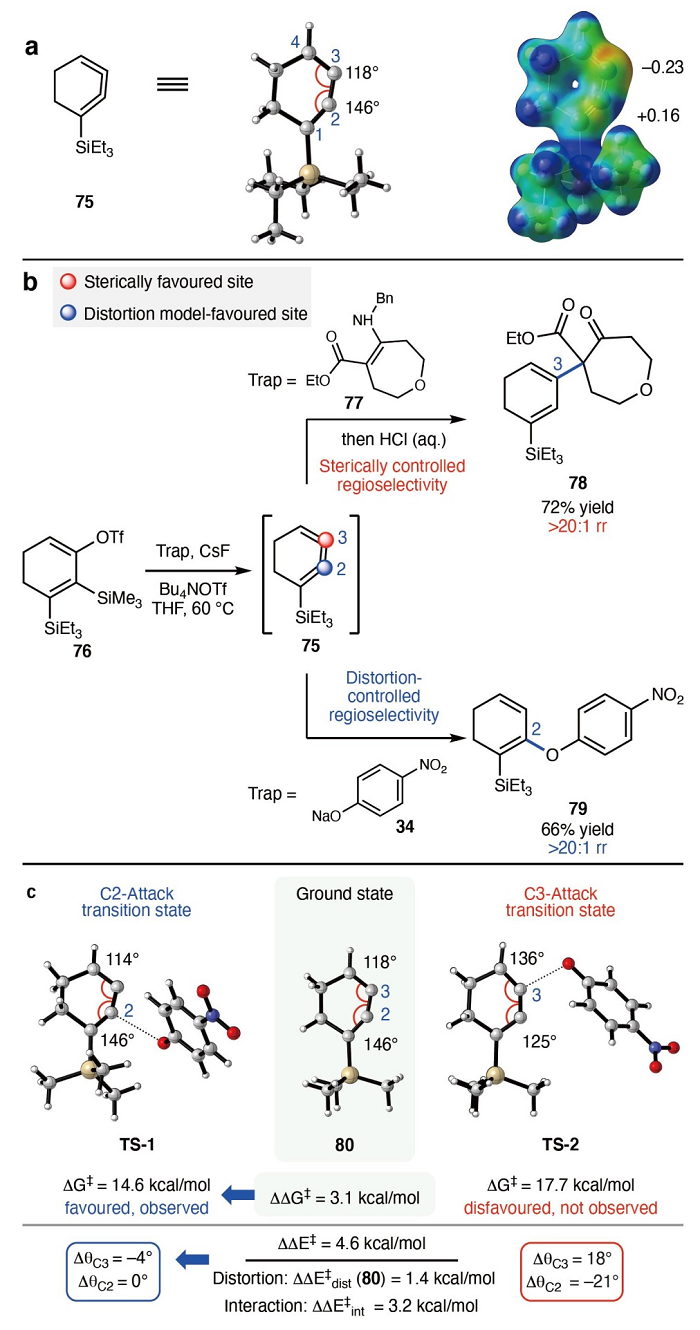
图5. 单取代环三烯的结构及反应性研究。图片来源:Nature
最后,作者进行了一系列衍生化(图6),具体而言:1)三环二烯35分别通过Diels-Alder反应、环加成反应、化学选择性N-N键还原获得相应产物(81-84);2)硅基取代的环己三烯75和烯胺85进行反应以良好的区域和立体选择性得到二烯(+)-78,再经烯丙基化得到中间体(-)-87,接着通过热裂解作用发生Diels-Alder/retro-醛醇/烯烃异构化串联反应,以60%的产率、91% ee值获得结构复杂的产物(+)-19,进一步展现出该方法在构建复杂产物中的实用性。

图6. 张力1,2,3-环己三烯在多步合成中的应用。图片来源:Nature
总结
Garg教授课题组开发了1,2,3-环己三烯及其衍生物参与的一系列反应模式,包括不同的环加成、亲核加成和σ-键插入等。对1,2,3-环己三烯的不对称衍生物的实验和计算研究表明,张力三烯虽然具有高反应活性和短寿命,但它们具有进行高选择性反应的潜力。此外,1,2,3-环己三烯及其衍生物还可应用于多步合成中,进而证实它们其在快速组装拓扑和立体化学复杂分子方面的实用性。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Strain-promoted reactions of 1,2,3- cyclohexatriene and its derivatives
Andrew V. Kelleghan, Ana S. Bulger , Dominick C. Witkowski , Neil K. Garg
Nature, 2023, DOI: 10.1038/s41586-023-06075-8
导师介绍
Neil K. Garg
https://www.x-mol.com/university/faculty/835
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号