新型多肽-硫化氢生物材料介导的酶促反应用于肿瘤的化学动力学治疗
在肿瘤细胞内诱导产生高浓度活性氧 (reactive oxygen species, ROS) 用于治疗癌症称为化学动力学疗法 (chemical dynamic therapy, CDT),它是利用金属(比如Fe2+)与过氧化物发生芬顿/类芬顿 (Fenton/Fenton-like) 反应产生高反应活性的羟基自由基以达到高效杀伤肿瘤细胞的目的。尽管这种新的肿瘤治疗方法具有潜在的选择性和精确靶向性,但其疗效本质上受到胞内过氧化氢(H2O2)水平的限制。因此,美国弗吉尼亚理工大学John Matson教授(点击查看介绍)和上海交通大学王寅教授(点击查看介绍)团队提出了一种利用硫化氢(H2S)抑制过氧化氢酶(catalase, CAT)活性,进而提升胞内H2O2浓度,通过芬顿反应产生大量羟基自由基选择性杀伤癌细胞的新策略。
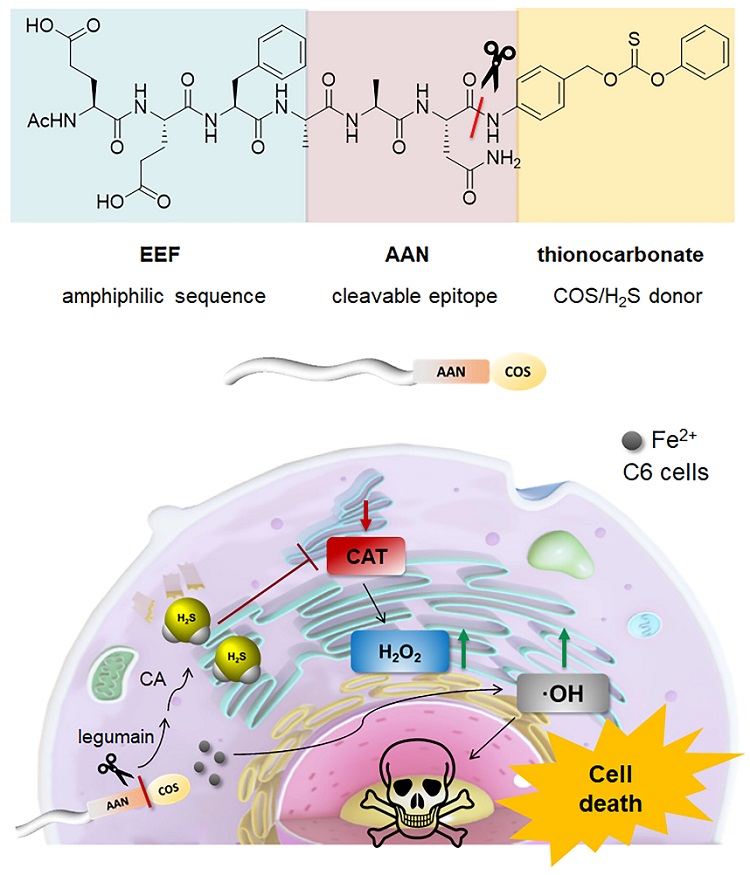
图1. PHDC-Fe2+ 化学结构和用于C6 神经胶质瘤细胞系治疗机制的示意图。
研究人员设计并合成了一种双重响应多肽复合物 AAN-PTC–Fe2+,它在 C6 神经胶质瘤细胞中经Legumain和碳酸酐酶(CA)响应释放 H2S。多肽序列为丙氨酸-丙氨酸-天冬酰胺(AAN),可被legumain识别并裂解产生硫代碳酸酯,通过1,6-消除反应生成羰基硫(COS),进而被CA水解释放CAT 的抑制剂H2S。该多肽可进一步与亚铁离子络合,通过芬顿反应促进大量 ROS 的产生。
研究发现AAN-PTC–Fe2+复合物能在过度表达 legumain 的 C6 神经胶质瘤细胞系中释放H2S。同时,实验证明AAN-PTC–Fe2+能在细胞内诱导产生大量的活性氧,其杀伤 C6 细胞的效果甚至优于一线化疗药物替莫唑胺(temozolomide, TMZ)。这些结果证明了硫化氢在这个系统中的促氧化作用,并突出了这种气体递质的“双面”性质(低浓度时H2S可作为抗氧化剂)。最后,该工作还证明AAN-PTC–Fe2+复合物在各实验浓度时对 H9C2 心肌细胞没有毒性。这些结果共同突出了 AAN-PTC–Fe2+在神经胶质瘤精准治疗中的潜力,证明了通过向癌细胞特异性递送H2S抑制过氧化氢酶活性,进而利用化学动力学疗法杀灭肿瘤细胞的可能性,为高效的肿瘤靶向治疗提供新思路。
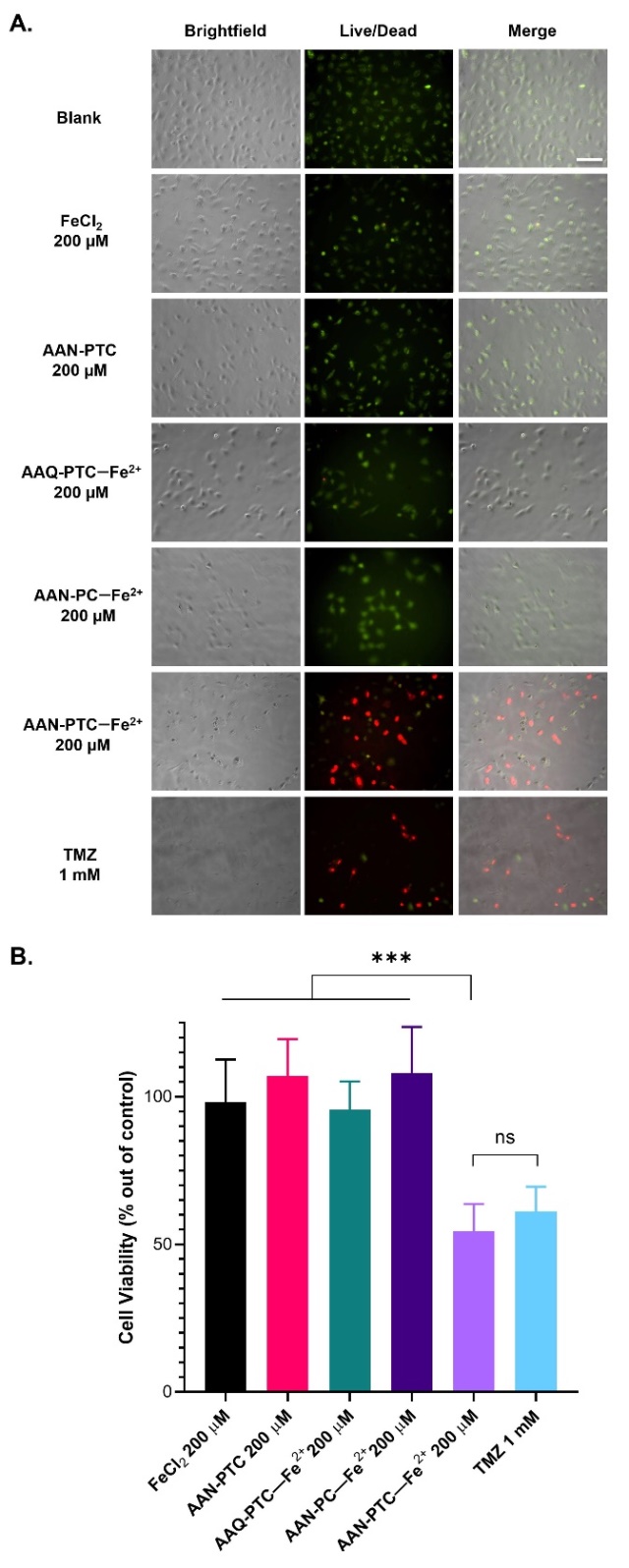
图2. PHDC-Fe2+和其他对照组对C6神经胶质瘤细胞的杀灭效果。
相关研究成果近期发表在《德国应用化学》(Angewandte Chemie International Edition)上,文章的第一作者是美国弗吉尼亚理工大学博士生朱雨朦,通讯作者是美国弗吉尼亚理工大学John Matson教授和上海交通大学王寅教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enzyme-Triggered Chemodynamic Therapy via a Peptide-H2S Donor Conjugate with Complexed Fe2+
Yumeng Zhu, William R. Archer, Katlyn F. Morales, Michael D. Schulz, Yin Wang, John B. Matson
Angew. Chem. Int. Ed., 2023, DOI: 10.1002/anie.202302303
导师介绍
John Matson
https://www.x-mol.com/university/faculty/3988
王寅
https://www.x-mol.com/groups/yinwang
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号