川大郭俊凌教授团队:金属多酚孔道门控系统修饰的免疫细胞用于肿瘤治疗
细胞界面修饰可以对细胞功能进行调控和增强,是细胞治疗的重要技术。细胞基药物递送系统可以借助细胞表面修饰材料,将含有生物活性分子的载体负载于免疫细胞表面,并通过载体控制活性分子的持续释放,协同免疫细胞特性,高效地实现细胞功能的精准调控,达到疾病治疗的目的。该药物递送系统具有组织特异性和靶向渗透病变组织能力。然而,作为一个亚显微尺度界面,细胞表面尺寸微小,结构复杂,含有蛋白、多糖及脂类等多种物质,细胞容易受到外界刺激而失活,并且会通过胞吞等方式摄取表面纳米材料,导致细胞膜改变或干扰细胞正常功能,进而减弱向实体瘤的趋化迁移。
四川大学郭俊凌教授(点击查看介绍)团队主要围绕植物多酚在基础科学和拓展应用开展研究,发展了面向跨领域应用场景的植物多酚基功能材料体系。该团队通过在细胞表面构建纳米化多酚结构,构建了多酚基细胞工程化平台和研究方向。前期的研究通过磷化铟颗粒在酵母细胞表面的组装,构建了磷化铟-酵母人工光和复合体(Science, 2018, 362, 813),多酚也可与各类生物大分子形成多酚纳米复合物,并与免疫细胞的表面结合,建立了全新的细胞治疗平台(Adv. Mater., 2020, 32, 2003492),在肠道菌的表面构筑单细胞金属多酚网络纳米壳,可实现对肠道菌群的有效保护和增强定植(Nat. Commun., 2022, 13, 2117)。
近日,郭俊凌教授团队开发了一种由金属多酚网络构建的纳米多孔门控系统,用于控制微凝胶的药物释放,并将其与巨噬细胞结合,构建了对肿瘤具有靶向富集和药物递送的细胞治疗系统,称为MAGN,该研究成果发表于国际顶级期刊Advanced Science。研究基于纳米海绵丰富的孔隙结构和pH响应功能等物理化学特性,多酚与金属离子可以在纳米海绵表面自组装形成具有分子门控系统,结合巨噬细胞对肿瘤具有靶向富集作用,从而提出了药物封堵和药物递送的新型策略(图1)。该研究发现,在不影响巨噬细胞活性和正常迁移侵袭能力的前提下,MAGN能够携带高剂量抗癌药物DOX富集在肿瘤微环境中更有效地杀死肿瘤细胞,抑制肿瘤生长。MAGN输送DOX至肿瘤部位的效率是游离DOX的三倍,并证实了MAGN的体内安全性。郭俊凌教授和尚娇娇特聘副研究员为该论文通讯作者,第一作者为轻工科学与工程学院2020级硕士研究生廖雪,龚贵东副研究员(专职科研)也参与了科研的指导和论文的撰写。
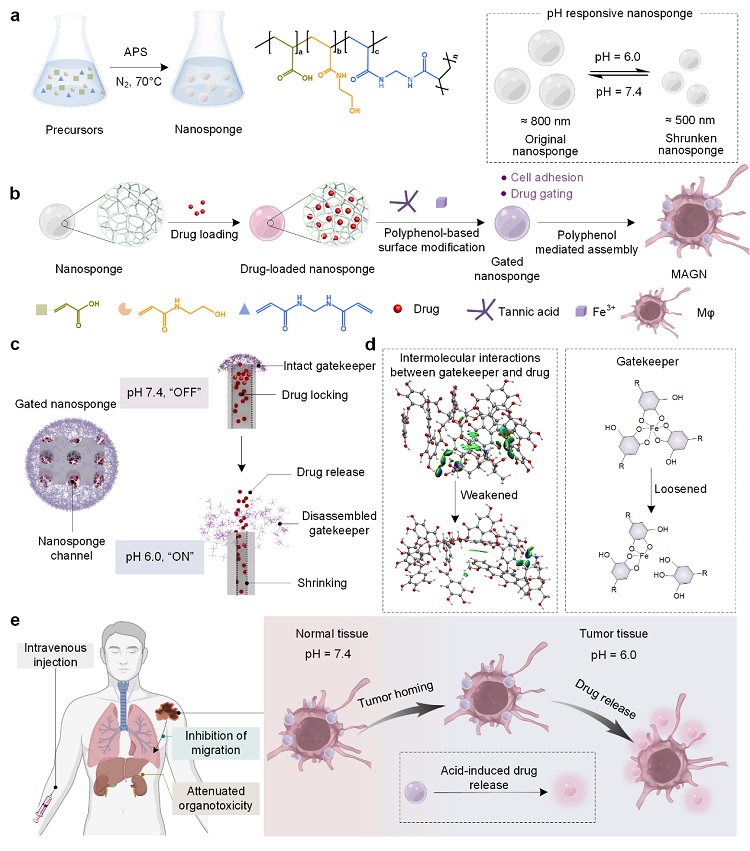
图1. 金属多酚修饰的纳米海绵与巨噬细胞结合可抑制肿瘤生长。
纳米海绵是一种具有pH响应性的多孔微凝胶,将药物分子负载在其三维网络状结构中,然后使用单宁酸(TA)和铁离子(Fe3+)的络合反应在纳米海绵表面形成FeIII-TA包封层,从而起到封堵药物的门控作用。基于纳米海绵的高比表面积和内部网络结构,纳米海绵显示出高效药物负载能力(191 ± 29 mg/g,高达22 wt%)。在不影响巨噬细胞活性和正常迁移侵袭能力的前提下,纳米海绵与巨噬细胞高效率结合,从而使MAGN能够携带高剂量药物(图2)。
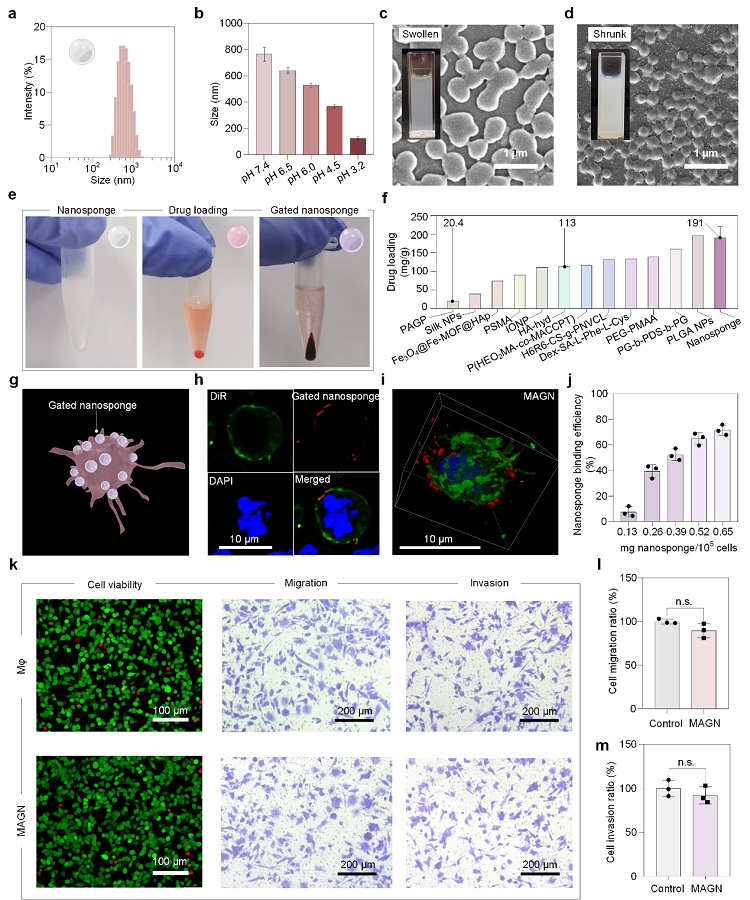
图2. 纳米海绵的药物负载及其与巨噬细胞的结合。
接下来,研究团队进一步揭示了FeIII-TA作为门控对药物的封堵机制(图3)。FeIII-TA门控在pH 7.4环境下通过分子间范德华力和库仑相互作用力抑制药物扩散,从而将药物有效地封锁在纳米海绵内部。纳米海绵表面的FeIII-TA门控可以极大地抑制纳米海绵内药物的扩散,从而起到药物封堵的作用。
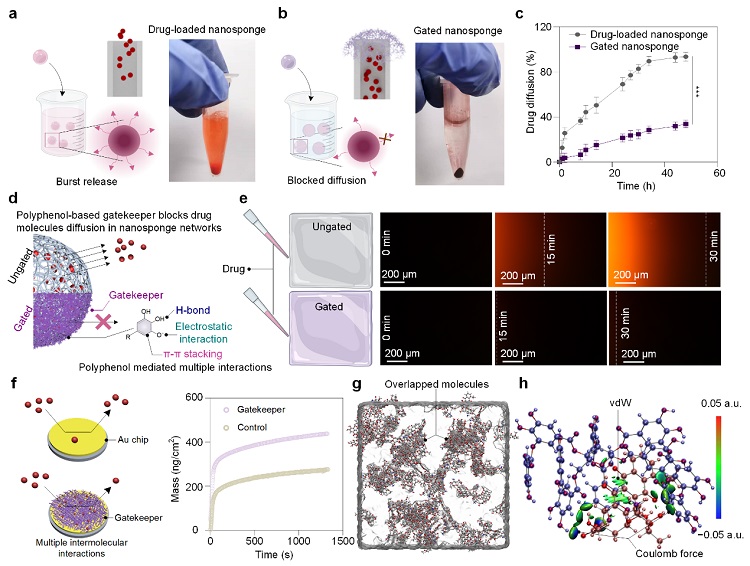
图3. 将药物封装在由FeIII-TA门控覆盖的纳米海绵中。
紧接着,研究团队研究了MAGN在肿瘤微环境中的药物释放机制(图4)。在pH 6.0环境中TA和DOX之间的分子间相互作用,均弱于pH 7.4环境中的作用力。相比于正常组织环境,肿瘤微环境具有弱酸性条件,FeIII-TA门控解离和纳米海绵的孔径收缩,导致MAGN在肿瘤部位释放出更多的化疗药物,从而能更有效地杀死B16F10肿瘤细胞。
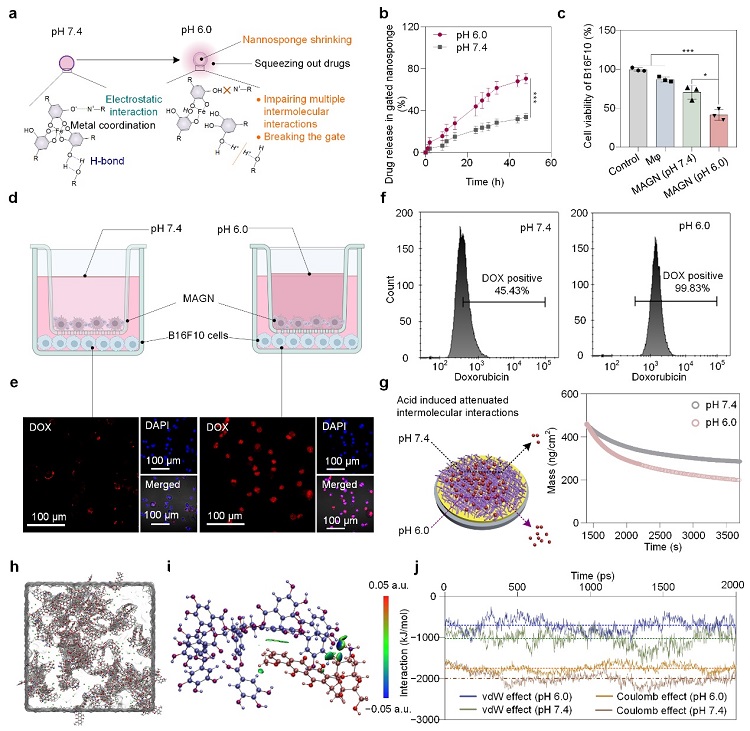
图4. pH刺激MAGN中药物释放的分子行为和机理研究。
最后,该研究通过黑色素肿瘤模型小鼠验证了MAGN的药物靶向效率和肿瘤抑制效果(图5)。结果显示,MAGN不仅具有治疗原发性肿瘤的潜力,也具有抑制肿瘤转移的潜力,而且MAGN无显著生物毒性。这一工作为拓宽复杂环境下细胞治疗提供了新策略,MAGN平台也可以作为一种多功能平台,实现各种治疗药物(如DNA/RNA、单克隆抗体和肽)的高负载和增强药物递送到所需病理部位的效率。

图5. MAGN对黑色素肿瘤小鼠模型的体内综合治疗。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Systemic Tumor Suppression via Macrophage-Driven Automated Homing of Metal-Phenolic-Gated Nanosponges for Metastatic Melanoma
Xue Liao, Guidong Gong, Mengyuan Dai, Zhenyu Xiang, Jiezhou Pan, Xianglian He, Jiaojiao Shang, Anna Maria Blocki, Zongmin Zhao, C. Wyatt Shields IV, Junling Guo
Adv. Sci., 2023, DOI: 10.1002/advs.202207488
通讯作者简介
郭俊凌,四川大学教授,博士生导师,国家高层次青年人才计划入选者,墨尔本大学化学与分子生物学博士,哈佛大学Wyss Fellow。作为项目/课题负责人承担国家重点研发计划、国家自然科学基金面上项目、四川省重点研发计划、四川省天府峨眉领军人才计划,成都市蓉漂计划,成都市高新区产业教授等,现任英属哥伦比亚大学客座教授,成都市委统战部“欧美同学会”专委会副主任,教育部轻工学科评估专家,四川省皮革协会理事,Chinese Chemical Letters、皮革科学与工程等期刊编委等。研究主要围绕植物多酚在基础科学和拓展应用等方面,建立了以植物多酚为母体分子的功能材料设计策略,揭示了多酚官能团多重分子间作用特性与材料构效关系的机理,发展了面向跨领域应用场景的植物多酚基功能材料体系,共发表论文120余篇,其中以通讯作者发表在Science、Sci. Adv.、Nat. Commun.、Chem. Soc. Rev.、Matter、Angew. Chem. Int. Ed.、Adv. Mater.、Energy Environ. Sci.等国际顶级期刊,总引用超4100次(H指数34),申请及授权专利32项,关键技术已实现千万级产业转化。
团队网站:
https://www.x-mol.com/university/faculty/65705
研究团队招聘及要求:
岗位:优秀博士、硕士研究生多名。具有海外博士学历/博士后并在高水平期刊发表论文的申请人,将协助申请四川大学特聘教授(研究员)、特聘副教授(副研究员)加入BMI团队。请将简历及自荐信发送至:junling.guo@scu.edu.cn。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
















































 京公网安备 11010802027423号
京公网安备 11010802027423号