基于磁性DNA逻辑探针触发的荧光杂交链式反应对循环肿瘤细胞器官来源的识别
循环肿瘤细胞(CTCs)是一类从实体肿瘤中脱落并在外周血液中循环的肿瘤细胞,被认为是癌症转移的主要原因。因此对CTCs的富集和检测在癌症的早期诊断和疗效监测上具有重要意义。然而,由于CTCs在血液中丰度低、样本环境复杂且细胞表型具有异质性等特点,使得目前缺乏简单有效的策略来同时对CTCs进行富集并便捷检测其不同亚型或与肿瘤转移密切相关的不同器官来源信息,极大限制了其在临床上的广泛应用。
近日,四川大学“生物材料表界面及体外诊断”研究团队在纳米材料领域权威学术期刊Nano Today 上发表研究论文,通过构筑EpCAM适配体修饰的磁性探针,首先对广谱上皮型表达的CTCs进行高效捕获。随后通过加入两组靶向器官来源标志物(肝组织来源GPC3与肺组织来源TTF1)的DNA逻辑探针,在细胞表面触发逻辑“与”反应和杂交链式反应(HCR)而形成放大的荧光信号,达到识别CTCs器官来源的目的。此外,该研究所设计的两组磁性DNA逻辑探针在复杂样本中能够同时工作而不发生干扰,为CTCs的高效富集和细胞上多种标志物的检测提供了一种简单有效的策略(图1)。
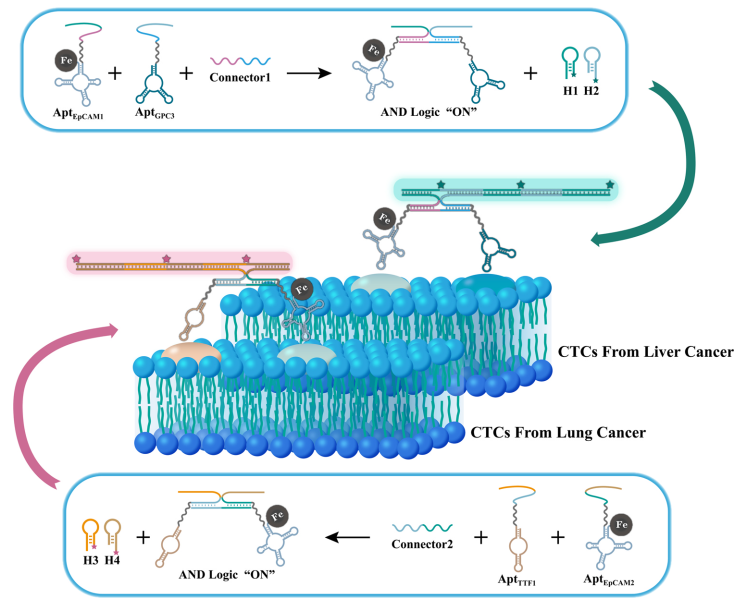
图1. 研究工作示意图。
通过将两组磁性DNA逻辑探针投入到具有HepG2细胞(人肝癌细胞)与A549细胞(人肺癌细胞)的混合样本中,能够在对应的细胞表面分别形成两种荧光信号,从而标记出肿瘤细胞的器官来源(图2)。同时,该策略还在三种荷瘤小鼠(肝癌、肺癌和肝转肺癌模型小鼠)的血液样本以及临床患者血液样本中,准确识别出CTCs器官来源,甚至能追溯转移性癌症的相关器官。
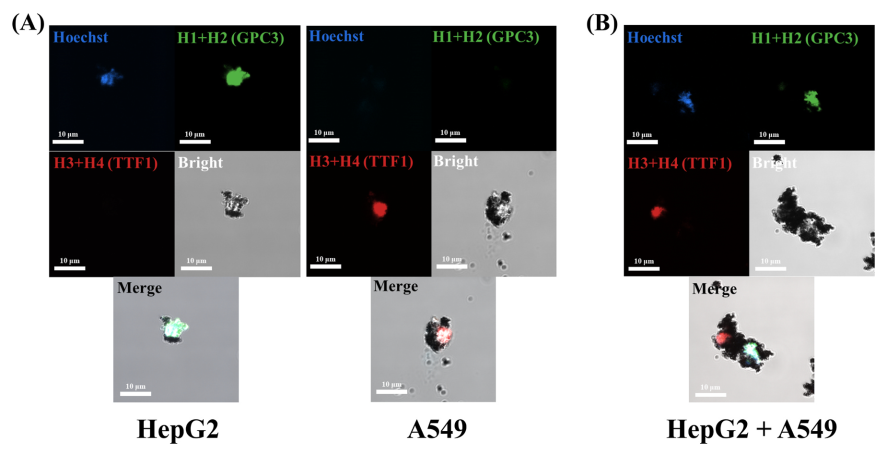
图2. 应用两组磁性DNA逻辑探针对HepG2细胞与A549细胞(A)分别和(B)同时进行器官来源的检测。其中,HepG2细胞为蓝色(+)/绿色(+)/红色(-);A549细胞为蓝色(-)/绿色(-)/红色(+)。
这一成果近期发表在Nano Today 上,文章的第一作者是四川大学国家生物医学材料工程技术研究中心博士研究生张宇佳,通讯作者是易强英研究员和吴尧研究员。该研究团队长期从事通过磁性功能纳米材料的设计和构建制备新型体外诊断试剂载体材料,以实现重大疾病(肿瘤、传染性疾病等)相关新型生物标志物(核酸、CTCs、异常蛋白质、外泌体等)的快速高效检测,为疾病的临床早期诊断、药效评价以及预后检测等建立有效的体外检测方法和技术,进行相关试剂盒研发的应用研究。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Nano-magnetic aptamer sensor incorporating AND logic recognition-launched hybridization chain reaction for organ origin identification of circulating tumor cells
Yujia Zhang, Yue Yu, Ke Kang, Xuekang Wang, Nanhang Zhu, Xingyou Wang, Qiangying Yi, Yao Wu
Nano Today, 2023, 49, 101817. DOI: 10.1016/j.nantod.2023.101817
导师介绍

吴尧:四川大学研究员,博士生导师。四川大学“生物材料表界面及体外诊断”研究团队组长。教育部新世纪优秀人才,四川省学术和技术带头人,中国生物材料学会理事兼组织委员会委员,四川省生物医学工程学会常务理事兼秘书长,中国知识产权学会常务理事,中国科学基金第七届编委会编委。获教育部自然科学一等奖。围绕磁性功能纳米材料的可控构筑,致力于解决骨缺损修复以及重大疾病的临床诊治需求等挑战工作。主持国家自然科学基金面上项目、973项目子课题、四川省科技厅重点研发项目等16项,横向项目2项。累计获批经费近3000万元。授权中国发明专利约30项。发表SCI论文120余篇。论文总引用超过3200次,h-index=31。
https://www.x-mol.com/groups/Wu_Yao
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
基于三螺旋-双螺旋分子开关驱动的DNA逻辑自组装用于肿瘤细胞外pH的成像分析 2018-09-23
-
杂交链式反应在生物传感、生物成像、生物医药领域中的应用 2017-11-17
-
南京大学生命分析化学国家重点实验室JACS:基于DNA跨膜逻辑运算的精准治疗 2021-09-25
-
可控环境蛋白冠伪装的免疫磁珠用于高效富集循环肿瘤细胞 2022-03-14
-
基于DNA框架结构的CRISPR三重自放大策略用于多重核酸分析 2023-04-02
































 京公网安备 11010802027423号
京公网安备 11010802027423号