用于靶向光动力抗癌治疗的酶响应双锁分子信标
光动力疗法(PDT)具有微创、耐药性低、治疗区域选择可控等优点。但是,临床上应用的光敏剂存在选择性差的问题,光敏剂“always on”的特征使得它们非常容易对正常组织产生副作用。基于肿瘤微环境设计的可激活型光敏剂成为近年来光动力领域内的研究热点之一。但是由于肿瘤异质性等特征,传统的“单因素”控制激活策略往往存在释放率不稳定、脱靶等潜在风险。为了实现可激活光敏剂更可靠,精准的释放,香港中文大学吴基培教授团队和香港城市大学卢沛芝副教授团队通过巧妙设计,构建了一种“双因素”激活的光敏剂,在保留其对肿瘤细胞的光毒性的同时,大大降低了对正常细胞的副作用。
作者以经典的光敏剂二苯乙烯基-氟硼荧(BODIPY)为骨架,通过含有PLGVR和GFLG肽序列的环肽连接黑洞淬灭剂-3 (Black Hole Quencher 3, BHQ-3),构建光动力分子信标(photodynamic molecular beacon, PMB)分子 1(图1)。由于BODIPY骨架和淬灭剂3之间存在高效的荧光共振能量转移(FRET)过程,使得PMB分子处于“失活”状态,从而降低其对正常组织细胞的毒副作用。相比于正常细胞,肿瘤细胞过表达的基质金属蛋白酶-2(MMP-2)和组织蛋白酶B(cathepsin B),能够分别特性地识别和水解PLGVR 和GFLG肽序列,从而激活PMB分子,恢复其荧光成像和单线态氧产生能力,进而在光照条件下促使肿瘤细胞死亡。
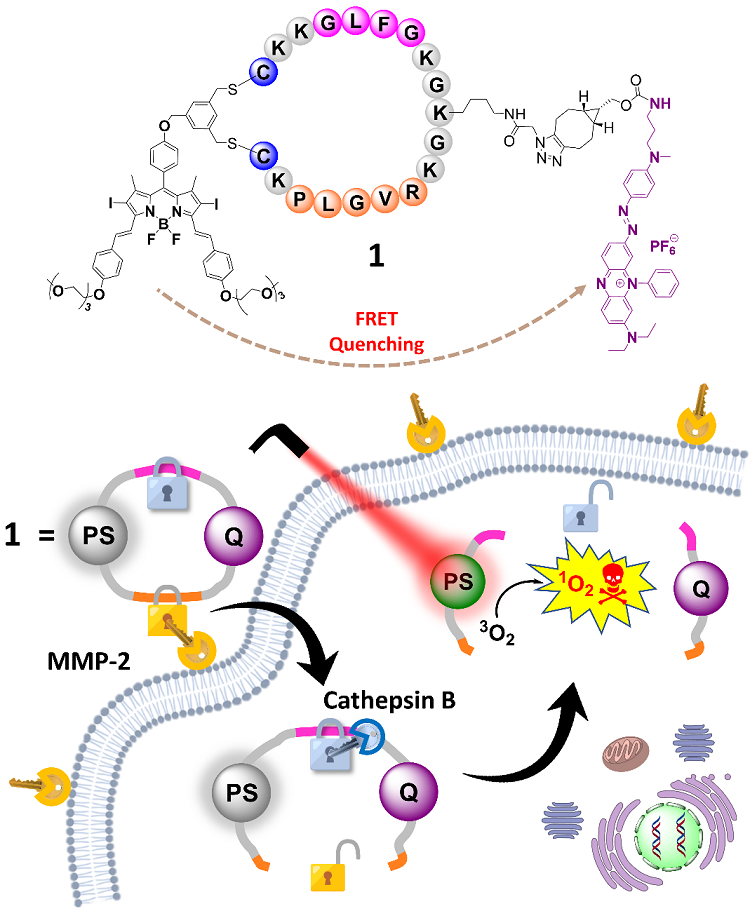
图1. “双锁”PMB的分子结构及其双酶响应的解锁机制。图片来源:J. Am. Chem. Soc.
动物实验进一步表明,PMB分子能够通过PDT,有效地抑制A549肿瘤的生长(图2),同时降低对正常组织的毒副作用,如皮肤的光敏毒性,显示出“双因素”控制的可激活光敏剂优越的安全性和有效性,为实现PDT的精准治疗提供了借鉴意义。
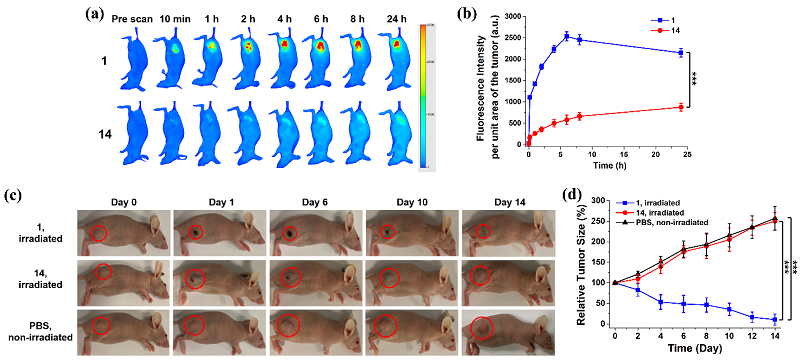
图2. PMB 1 在A549荷瘤小鼠体内解锁及其PDT治疗效果。图片来源:J. Am. Chem. Soc.
这一成果近期发表在Journal of the American Chemical Society 上,文章的第一作者是香港中文大学谈家宝博士。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enzyme-Responsive Double-Locked Photodynamic Molecular Beacon for Targeted Photodynamic Anticancer Therapy
Leo K. B. Tam, Jacky C. H. Chu, Lin He, Caixia Yang, Kam-Chu Han, Peter Chi Keung Cheung, Dennis K. P. Ng,* and Pui-Chi Lo*
J. Am. Chem. Soc., 2023, DOI: 10.1021/jacs.2c13732
吴基培教授简介

吴基培,香港中文大学化学系教授,英国皇家化学学会院士及特许化学家,以及英国科学委员会特许科学家。1993年获英国牛津大学博士学位,1993年至1994年在美国加州理工学院工作,1994年9月起就职于香港中文大学,曾获香港中文大学青年学者研究成就奖。
近年来主要致力于功能染料的分子设计及其生物医学应用研究,并在相关领域发表SCI论文250余篇,主要研究成果发表在J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、Adv. Funct. Mater.、J. Controlled Release等。
https://chem.cuhk.edu.hk/people/academic-staff/nkp/
卢沛芝教授简介

卢沛芝,香港城市大学生物医学系副教授。2005年于香港中文大学获博士学位,2007年至2009年在加拿大安大略省癌症研究所工作,2009年至2015年在香港中文大学担任研究助理教授,2015年9月起就职于香港城市大学,曾获 SPP/JPP青年研究员奖及香港高等研究院青年新星讲师奖。
主要致力于癌症诊疗的新型分子和纳米药物的开发,先后在Chem. Soc. Rev.、J. Am. Chem. Soc.、Angew. Chem. Int. Ed.、J. Controlled Release、Acta Biomater.、Biomater. Sci.、J. Med. Chem等期刊以第一作者或通讯作者身份发表SCI论文90余篇。
https://www.cityu.edu.hk/bms/profile/gigilo.htm
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!





















































 京公网安备 11010802027423号
京公网安备 11010802027423号