南大戈惠明Angew Chem:酶促全合成揭示氧杂蒽环形成新机制
细菌多环芳香聚酮类天然产物不仅活性良好,且其生物合成途径中蕴含着丰富的酶学机制,因而一直是生物学和化学领域的研究热点之一。在II型聚酮合酶(PKS)、酮基还原酶、芳香化酶、环化酶等协作下,丙二酰单元形成规则的多环芳香骨架,在某些情况下,该骨架可进一步由氧化还原酶进行后修饰。其中,特别令人感兴趣的是一类黄素蛋白单加氧酶(FPMO)参与的II型PKS的氧化后修饰,可催化羟基化、Baeyer-Villiger氧化、环氧化、磺氧化和卤化等广泛的氧化还原转化,通常大幅改变最初形成的多环主链,例如,通过收缩、膨胀或氧化重排到新的环系统,极大地增加了天然产物结构的复杂性和多样性,形成成熟的生物活性分子。近日,戈惠明(点击查看介绍)研究团队通过体内表征和体外重构揭示了mutaxathene的完整生物合成途径以及多功能蛋白MtxO4(FPMO)催化多步转化生成氧杂蒽环的过程。
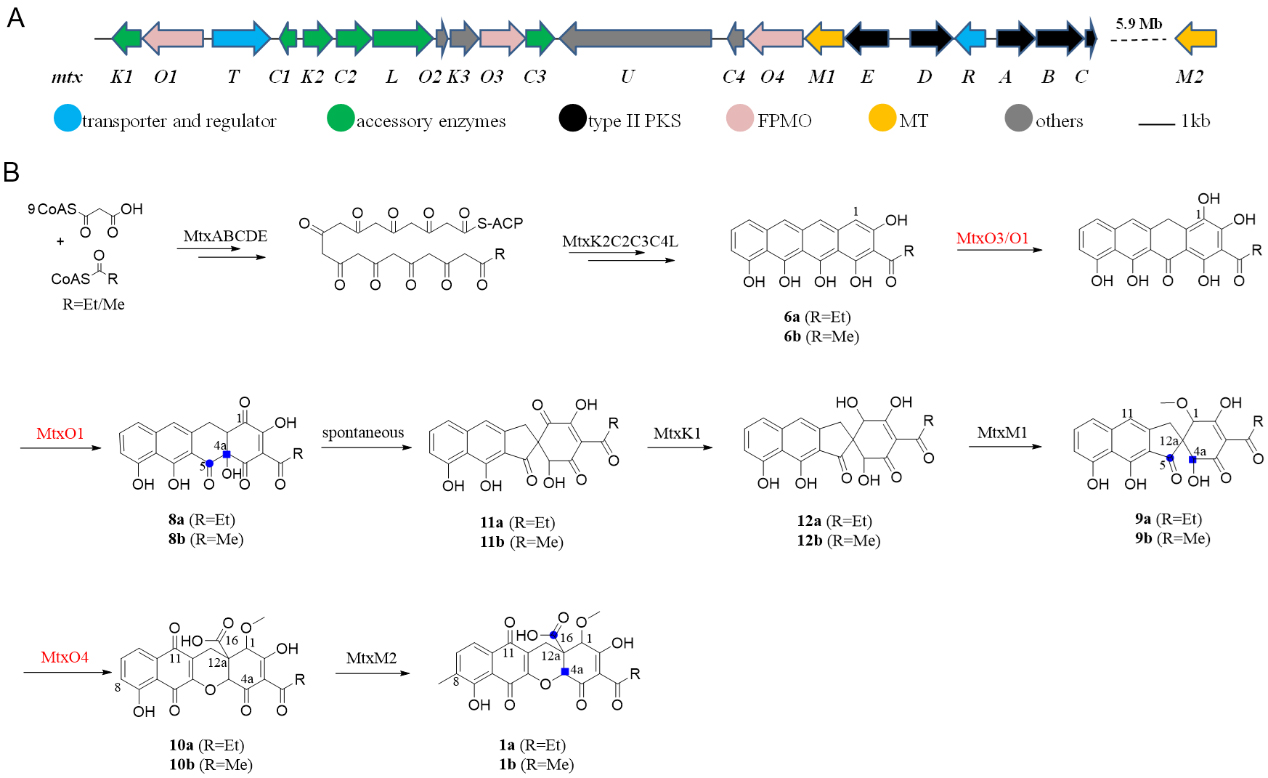
图1. Mutaxanthenes F和G(1a和1b)的生物合成。(A)来自S. setonensis NAK80的mutaxanthenes的生物合成基因簇。(B)推测的1a/1b的生物合成途径。图片来源:Angew. Chem.
为了深入了解FPMO家族的多功能性,作者专注于编码多个FPMO的未知II型PKS基因簇。基于基因组信息挖掘策略,作者在实验室测序菌基因组库中发现了一条来自Streptomyces setonesis NAK80的 II型PKS基因簇mtx,该基因簇包含一组编码最小PKS和辅助酶的基因,以及编码 FPMO 的三个基因,其与簇外甲基转移酶协作形成一类新的mutaxathene类似物,命名为mutaxanthenes F和G(1a和1b)。
Mutaxanthenes中12,12a-二氢-1H-苯并[b]氧杂蒽骨架在芳香族聚酮中较为罕见,除醋酸钠标记实验外还未有对其生物合成研究的报道。全碳标记的13C醋酸钠投喂实验表明,未偶联的C4a和C16很可能通过未知的氧化裂解机制从一个完整的醋酸单元衍生而来。然而,mutaxanthene的详细生物合成途径以及骨架重排机制尚不清楚。
首先,作者在体内逐个敲除mtx基因簇上相关基因,初步确定了1a/1b的相关合成蛋白功能,其中,从MtxO4(FPMO)突变株中分离鉴定了关键中间体9a/9b。为了明确阐明生物合成途径并分配相关酶的功能,作者随后采用多种方式表达纯化并获得酶促全合成所需的全部蛋白,通过ACP的活化、延伸单元的识别验证以及酶反应体系的调整,成功实现了关键中间体以及终产物的一锅法体外酶促全合成,再次验证了mutaxanthene的生物合成途径。最后,基于异源表达、体外酶催化、中间体的捕捉以及氧标记实验,作者推测了黄素蛋白单加氧酶MtxO4催化含螺[4.5]癸二酮的四环中间体9a/9b氧化重排成12,12a-二氢-1H-苯并[b]氧杂蒽骨架的过程。
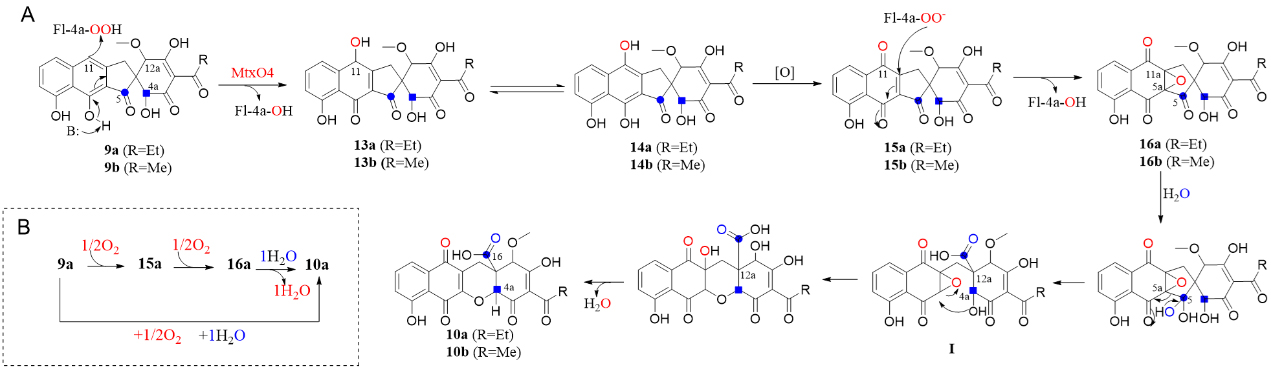
图2.(A)推测的MtxO4催化过程。(B)9a至10a的氧掺入路线简化图。图片来源:Angew. Chem.
总结
黄素蛋白单加氧酶MtxO4催化的氧化重排反应有助于我们理解A族FPMO的催化多功能性,并扩展FPMO在天然产物生物合成中的功能库。随着天然产物生物合成知识的积累,体外重构是高效率以及高精度生产复杂分子的有效方法。Mutaxanthene的体外一锅法酶促全合成为进一步酶促全合成其它II型PKS天然产物奠定了基础。相关工作以VIP文章发表在Angew. Chem. Int. Ed.,博士研究生向浪为论文第一作者,史净副研究员、谭仁祥教授和戈惠明教授为论文通讯作者,该工作得到国家自然科学基金,科技部重点研发计划等经费的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total Biosynthesis of Mutaxanthene Unveils a Flavoprotein Monooxygenase Catalyzing Xanthene Ring Formation
Lang Xiang, Jing Shi, Ao Zhu, Zi Fei Xu, Shuang He Liu, Yi Shuang Wang, Zhi Kai Guo, Rui Hua Jiao, Ren Xiang Tan, Hui Ming Ge
Angew. Chem. Int. Ed., 2023, DOI: 10.1002/anie.202218660
导师介绍
戈惠明
https://www.x-mol.com/university/faculty/49835
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号