成都生物研究所李光勋/唐卓JACS:通过去对称对映选择性水解合成手性氯代砜亚胺及其它手性六价硫衍生物
有机硫化合物在有机化学以及药物化学中具有举足轻重的作用。由于硫原子独特的化学性质,多种价态的含硫化合物存在,并广泛应用于有机催化、医药、农药等领域。如图1所示,具有潜手性的二价硫:硫醚、次磺酰胺等;具有手性的四价硫:亚砜、亚磺酰胺、亚磺酸酯、亚磺酸硫酯、硫亚胺等;具有手性的六价硫:砜亚胺、卤代砜亚胺、砜亚胺酰胺、砜亚胺酯等。
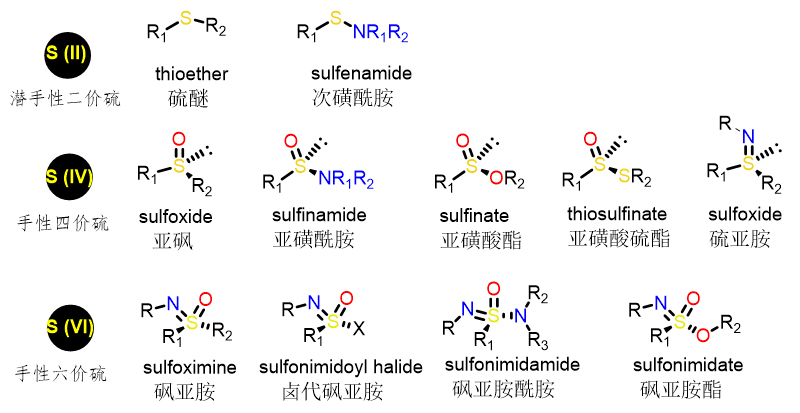
图1. 各种价态有机硫结构示例
中国科学院成都生物研究所李光勋(点击查看介绍)研究团队一直致力于各种有机硫化合物的制备。在前期的研究中,他们实现了手性亚磺酰胺的不对称催化合成(ACS Catal. 2019, 9, 1525-1530),以及亚磺酰胺的光催化合成(ACS Catal. 2022, 12, 15334-15340)。近日,他们在不对称催化合成手性六价硫衍生物方面取得新进展。目前,手性六价硫衍生物得制备方法主要包括以下几类:(1)以手性亚砜、手性亚磺酰胺,或者手性硫亚胺为底物进行不对称转化;(2)以对称性的砜亚胺为底物,通过催化对映选择性去对称化策略,制备各种类型手性砜亚胺衍生物。这些方法受限于手性底物的制备,或者对称性砜亚胺底物的制备,因此缺少比较通用的制备手性六价硫衍生物(包括砜亚胺、氯代砜亚胺、氟代砜亚胺、砜亚胺酰胺、砜亚胺酯)的方法。作者设想以潜手性次磺酰胺为底物,通过连续两次氧化氯代生成对称性的二氯代砜亚胺阳离子中间体,该中间体与手性磷酸根形成离子对,通过对映选择性地去对称水解,得到手性氯代砜亚胺。手性氯代砜亚胺可以作为通用的合成子,制备各种手性六价硫衍生物,如图2所示。该方法的难点在于二氯代砜亚胺阳离子中间体的产生与对映选择性去对称水解。
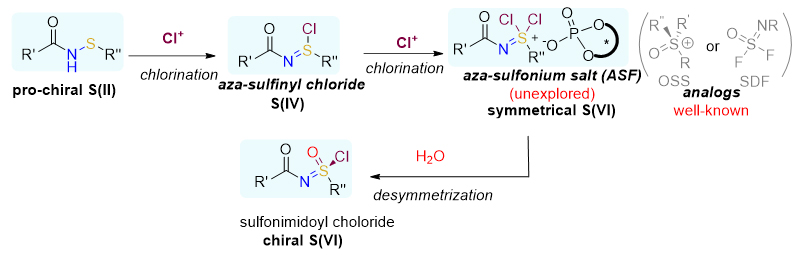
图2. 氯代砜亚胺不对称催化合成策略
首先,作者通过密度泛函理论(DFT)计算,比较不同氯代试剂对于反应过渡态的影响,如图3a所示,结果发现亲电性越强的氯代试剂,能显著降低反应的过渡态能垒,氯代试剂的亲电性判断可以通过相应的35Cl-NQR值,数值越高,则亲电性越强。随后,通过高分辨质谱佐证了阳离子中间体的产生以及氯代砜亚胺产物的产生,如图3b所示。接着,他们对反应条件进行优化,筛选出反应的最优条件为:以三氯异氰尿酸(TCCA)作氯代试剂,5 mol% (S)-TRIP为催化剂,一定范围的水,-25 ℃,1,2-二氯乙烷作溶剂,反应36 h,以95%收率,98%对映选择性获得氯代砜亚胺产物,图3c所示。
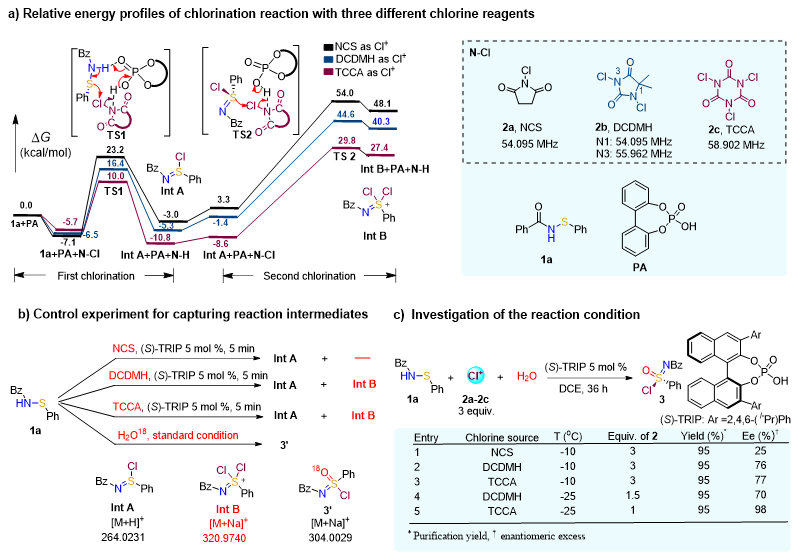
图3. 氯代砜亚胺不对称催化合成探索
在最优反应条件下,首先考察了反应的底物普适性,如图4a、4b所示,各种类型的次磺酰胺底物在最优反应条件下,均能以较好的收率(87-97%)与对映选择性(90-98%)得到相应的手性氯代砜亚胺6-29,证明该方法具有较好的通用性。同时,反应可以放大到克级规模,制备手性氯代砜亚胺,如图4c所示。接着,作者提出了反应的机理:次磺酰胺通过一次氧化氯代生成四价硫中间体Int A,接着通过第二次氧化氯代形成二氯代砜亚胺正离子中间体Int B,手性磷酸根与二氯代砜亚胺正离子形成离子对。当水与该中间体反应时,手性磷酸根通过氢键固定参与反应的水分子(TS),以SN2反应方式脱去氯负离子,掉下来的氯负离子与新生成的手性硫盐正离子形成离子对中间体Int C,手性磷酸根摘掉水分子上的氢后实现手性磷酸催化剂的循环。最后Int C 释放一分子盐酸得到产物氯代砜亚胺。通过详细的DFT计算,佐证了反应的机理以及立体选择性产生的原因。
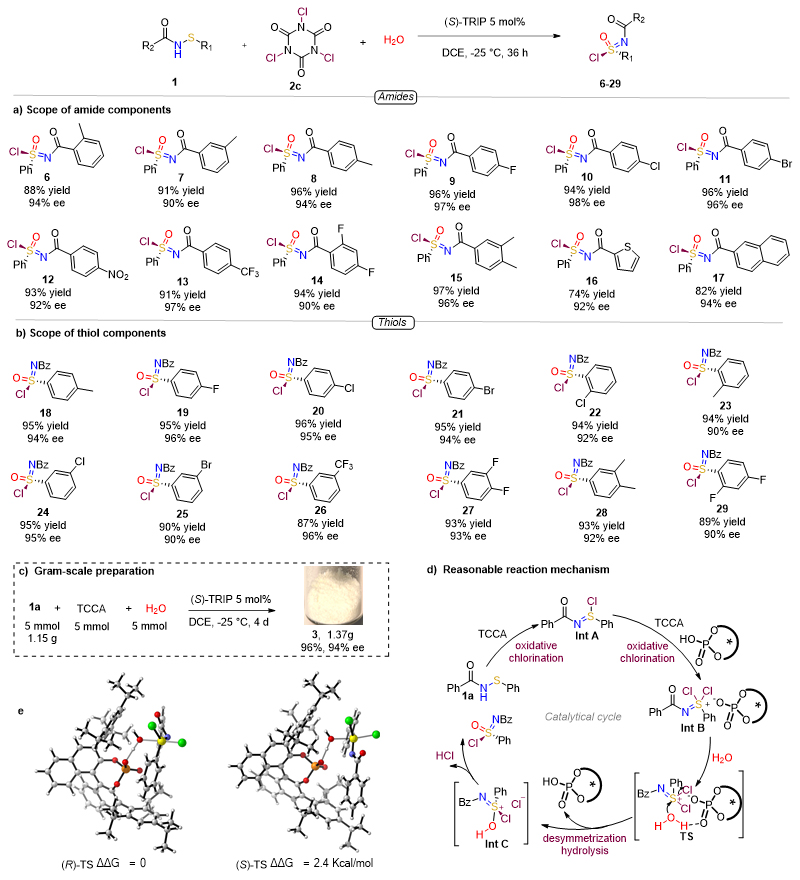
图4. 反应底物拓展与机理研究
随后,作者对手性氯代砜亚胺的转化进行详细的研究,发现氯代砜亚胺可以作为有效的合成子制备砜亚胺酰胺、砜亚胺酯、砜亚胺等手性六价硫衍生物。首先,以各种不同的伯胺、仲胺为亲核试剂,通过取代反应制备各种手性砜亚胺酰胺30-54,反应的立体选择性得到保持(91-98%),收率为46-96%,如图5a,5b所示。对于含有伯胺,或者仲胺的药物,该方法可以有效地将相应氨基转化为砜亚胺酰胺官能团,为药物的活性改造提高更多可能性,如图5c所示。其次,以各种芳基酚钠作亲核试剂,可以将氯代砜亚胺转化成砜亚胺酯60-69,反应的收率为36-93%,对映选择性为91-97%,如图6a所示。同时,该方法也可以将药物中酚羟基官能团转化为砜亚胺酯。最后,作者研究了如何将氯代砜亚胺转化为砜亚胺。当选择格氏试剂与氯代砜亚胺直接反应时,并不能得到相应地砜亚胺产物,而是得到亚磺酰胺,而且立体选择性得到保持。当选择格式试剂与砜亚胺酯反应时,可以得到砜亚胺产物70-74,反应的立体选择性得到较好地保持(81-96%),收率为36-90%,如图6b所示。
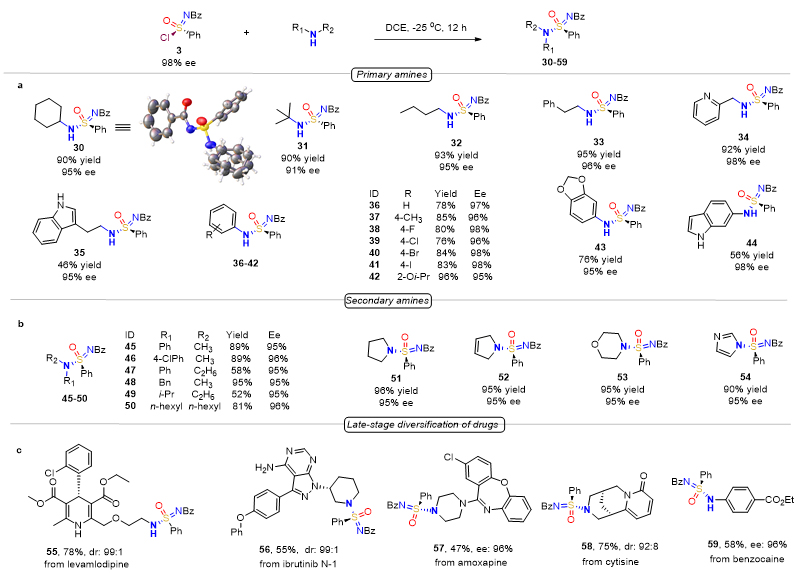
图5. 氯代砜亚胺衍生合成砜亚胺酰胺研究
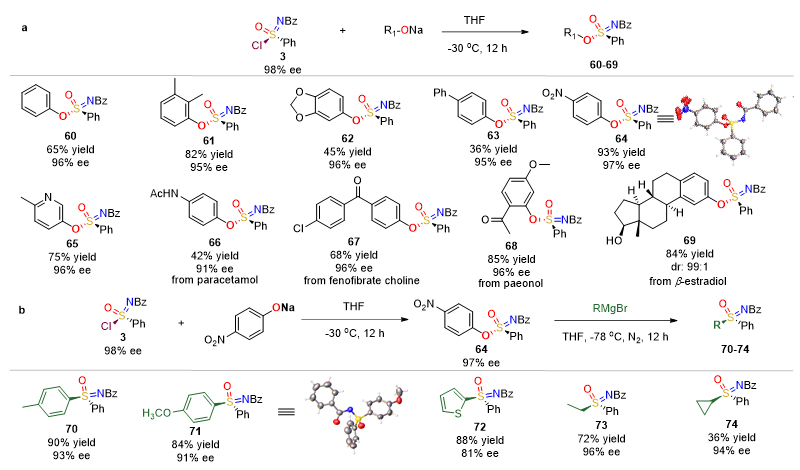
图6. 氯代砜亚胺衍生合成砜亚胺酯与砜亚胺研究
最后,作者对所获得的手性六价硫衍生物进行活性筛选,结果发现砜亚胺酰胺具有广泛的生物学活性,抑制多种肿瘤细胞的生长,同时,不同构型的砜亚胺产物具有明显的活性差异,如图7所示。
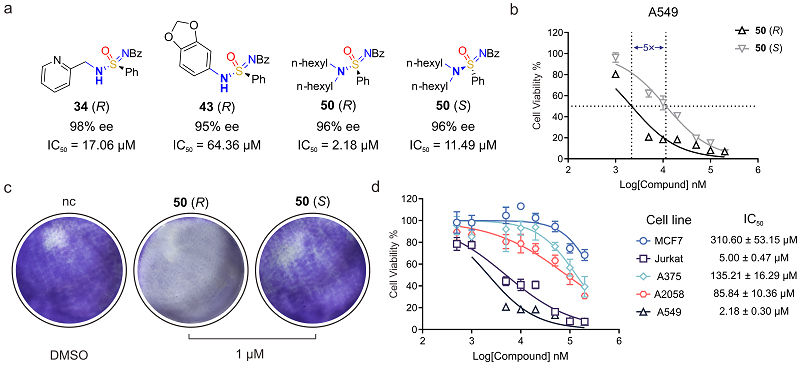
图7. 砜亚胺酰胺生物学活性筛选研究
总结
中国科学院成都生物研究所李光勋团队报道了首例氯代砜亚胺的不对称催化合成,利用潜手性次磺酰胺为底物,通过连续氧化氯代产生具有对称性的二氯代砜亚胺阳离子中间体,再利用手性磷酸作催化剂,与该氧离子中间体形成离子对,通过对映选择性地去对称水解策略,制备了手性氯代砜亚胺产物。该反应能放大到克级规模,并且得到的氯代砜亚胺能有效地转化为砜亚胺酰胺、砜亚胺酯、砜亚胺等手性六价硫衍生物。
该研究成果近期发表在国际学术期刊J. Am. Chem. Soc.,成都生物研究所硕士研究生杨高峰为本文第一作者,助理研究员袁奕为共同一作,李光勋副研究员和唐卓研究员为共同通讯作者。感谢成都中医药大学田寅老师计算化学方面工作的大力帮助,感谢成都生物研究所公共技术平台周燕老师、夏兵老师在质谱分析方面的技术支持。该研究得到中国科学院青年创新促进会(2018402)、西部之光(25E0C30)、四川省科技厅中央引导地方项目(2021ZYD0061)的支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Synthesis of Chiral Sulfonimidoyl Chloride via Desymmetrizing Enantioselective Hydrolysis
Gao-feng Yang, Yi Yuan, Yin Tian, Shi-qi Zhang, Xin Cui, Bing Xia, Guang-xun Li*, and Zhuo Tang*
J. Am. Chem. Soc., 2023, DOI: 10.1021/jacs.2c13758
导师介绍
李光勋
https://www.x-mol.com/university/faculty/178471
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号