给Rh(I)催化剂找“硼”友:Nat. Chem.报道糖类位点选择性官能团化新策略
位点选择性官能团化可在不同的立体化学环境中区分化学等效官能团,是有机合成中具有广泛应用价值的强大策略。与对映选择性合成相比(通过手性催化剂在前手性底物上产生新的立体中心),位点/区域选择性方法更注重区域控制并且在生物反应中具有更广泛的相关性。糖类是四大生物分子之一,不过它们的结构和立体化学往往比较复杂,要想立体选择性获取糖类化合物在很大程度上仍是不小的挑战。如图1a所示,大多数手性催化体系仅限于手性铜配合物和有机催化,这严重限制了糖类官能团化的选择性成键;而使用非手性过渡金属配合物进行位点选择性控制时,仍然无法同时对映选择性控制新生成的手性中心。迄今为止,已报道的只有两个反应尝试解决外部前手性亲电试剂的手性生成与位点选择性糖类官能团化同时产生的多重立体选择性问题,包括钮大文等人使用铜和硼酸协同催化的位点选择性炔丙基化以及唐维平等人通过carbenoid插入进行的Rh(II)-催化位点选择性烷基化(图1b),但是这些反应仅限于外源形成一个手性中心。
芳基氢化萘糖苷骨架是棉花或芦荟等植物中一类重要的天然产物(图1c),特别是类似物10具有重要的抗肿瘤活性,feroxins A和B(11)显示出泻药特性。然而,任何针对相关骨架的立体选择性催化策略都会涉及到颇具挑战性的对映体、非对映体和区域控制以及来自外部亲电试剂的手性生成。此前,Miyaura、Hayashi 等人的开创性工作中将有机硼化物(如硼酸)广泛应用于Rh(I)催化,但目前报道的只可作为cis-碳铑化反应的转金属试剂(图1d)。近期,德国马克斯•普朗克分子生理研究所的Charles C. J. Loh研究团队利用手性Rh(I)/有机硼协同催化策略,高立体选择性地实现了芳基氢化萘糖苷化合物的合成(图1e)。该策略通过手性Rh(I)和硼酸的协同催化实现了四重立体控制:1)在一系列多羟基糖类化合物上实现了位点选择性官能团化;2)Rh(I)与meso-oxanorbornadienes的桥头C-O键氧化加成时的对映选择性控制;3)在异头氧官能团化过程中实现动态动力学拆分;4)在氢化萘骨架上实现了trans-非对映选择性控制。作者表示,该策略成功的关键是明智地选择合适的有机硼催化剂。相关成果发表在Nature Chemistry 上。
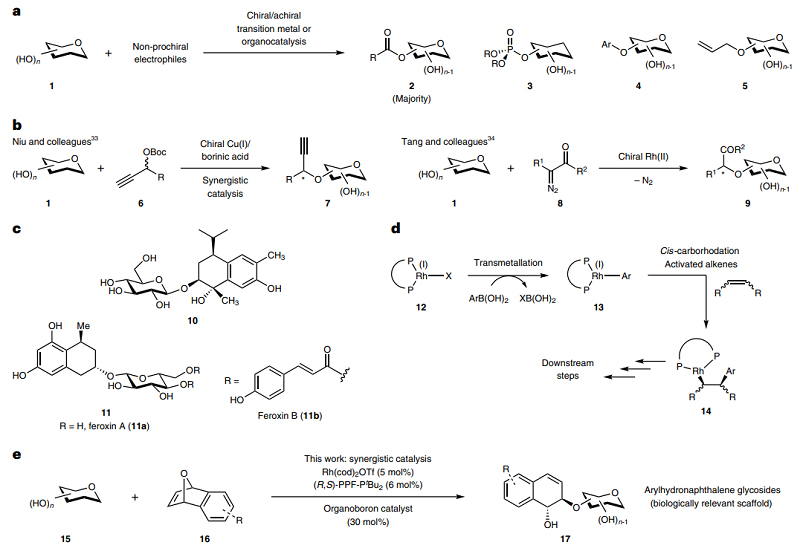
图1. 研究背景及本文工作。图片来源:Nat. Chem.
首先,作者选择甘露糖三醇衍生物15a和氧杂苯并降冰片二烯16a为模型底物对反应条件进行筛选(图2),并获得最佳反应条件:即15a(1.0 equiv)和16a(2.0 equiv)在Rh(cod)2OTf(5 mol%)为催化剂、2-环己基乙烯硼酸26(30 mol%)为助催化剂、(R,S)-PPF-PtBu2(L12,6 mol%)为配体、THF(2 mL)为溶剂的条件下于50 °C反应24 h,可以92%的产率、>20:1 r.r.值和>20:1 d.r.值得到C3区域异构体17a。
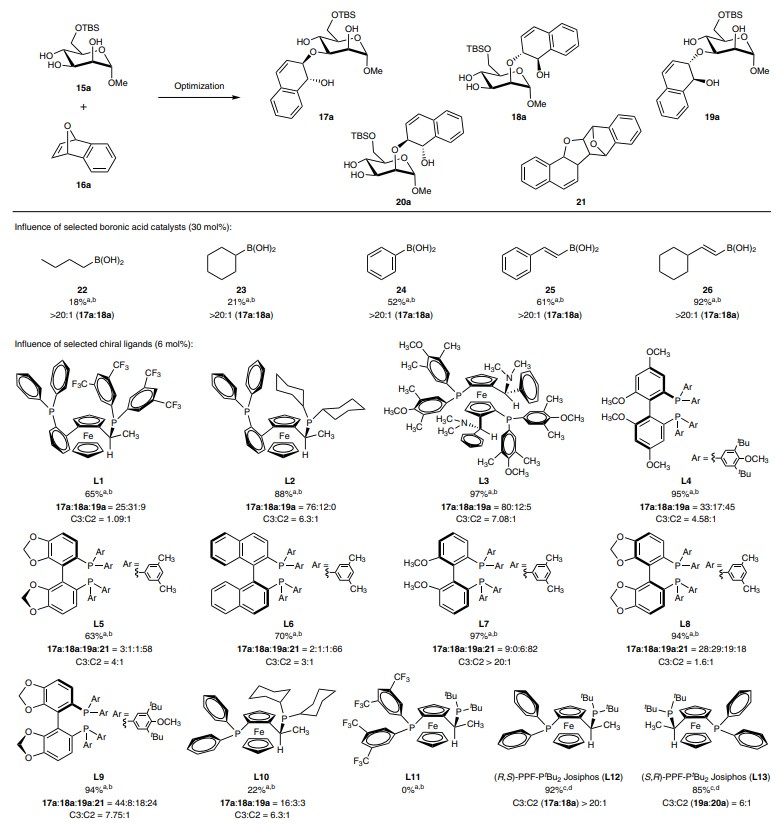
图2. 反应优化。图片来源:Nat. Chem.
有了最佳反应条件,作者对该反应的底物范围进行了考察(图3)。结果表明甘露糖、半乳糖、鼠李糖、阿拉伯糖、半乳醛、海藻糖、来苏糖、1,6-脱水甘露糖、景天庚酮糖以及异头碳上无保护的糖类化合物均可兼容该反应,以中等至良好(45-92%)的产率和立体控制实现了产物17a-17u的合成。值得一提的是,通过使用有机硼催化剂27、N,N-二异丙基乙胺(DIPEA)为碱便能以良好的对映、非对映、位点和异头选择性实现底物15s-u的官能团化并获得1,2-cis产物17s-u。另外,作者还通过X-射线衍射分析(17a、17l和17n)和振动圆二色谱(VCD,17a、17s、17u、19a和20a)分析证实了这些产物的绝对构型和区域异构体构型。总而言之,这些结果表明配体的手性、糖类多元醇的三维结构以及有机硼试剂的电子效应共同决定了反应的立体选择性和产率。
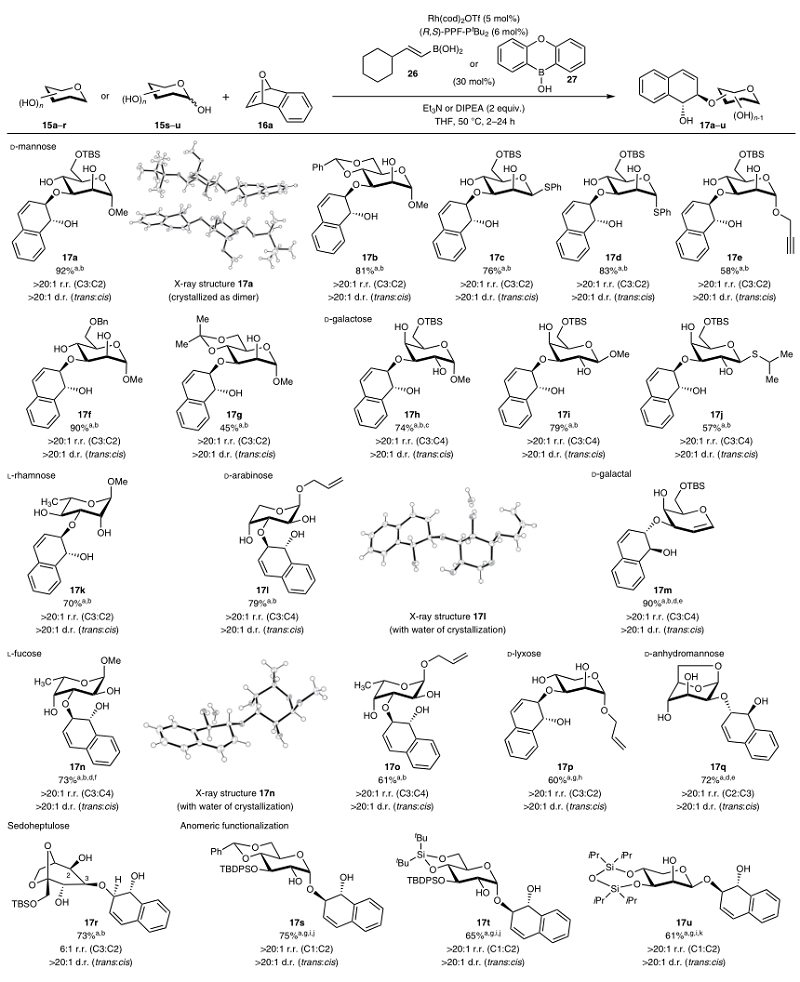
图3. 底物范围研究。图片来源:Nat. Chem.
其次,作者考察了亲电试剂的底物范围(图4),结果显示不同供/吸电子基团(如:甲基、甲氧基、二氧戊环、氟原子、溴原子等)取代的氧杂苯并降冰片二烯衍生物均可顺利实现这一转化,并以良好的产率和立体控制获得相应产物17aa-17ah。此外,作者还将该策略扩展到结构相关的脂肪族、环状脂肪族和芳香族取代的烯丙基碳酸酯底物16j-16m,通过对配体((S)-NPN)和溶剂(CH3CN)进行优化后,能以60-81%的产率和良好的区域选择性、非对映选择性获得相应产物17v-17za(图5)。
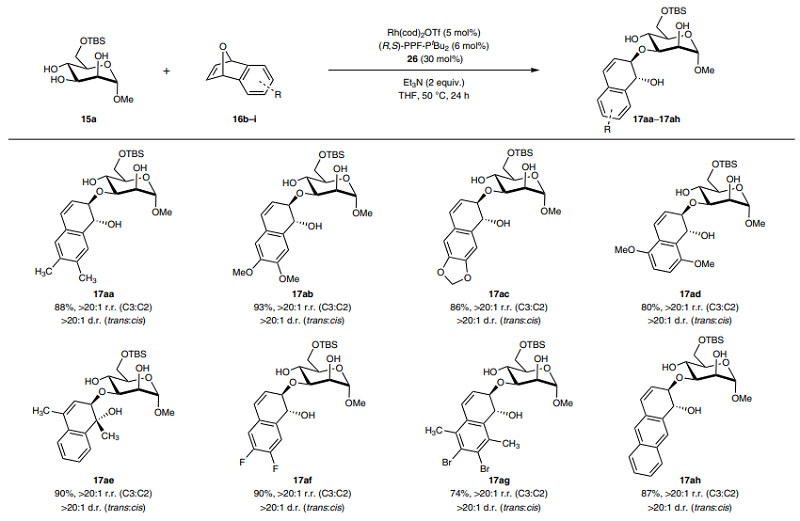
图4. 底物范围研究。图片来源:Nat. Chem.
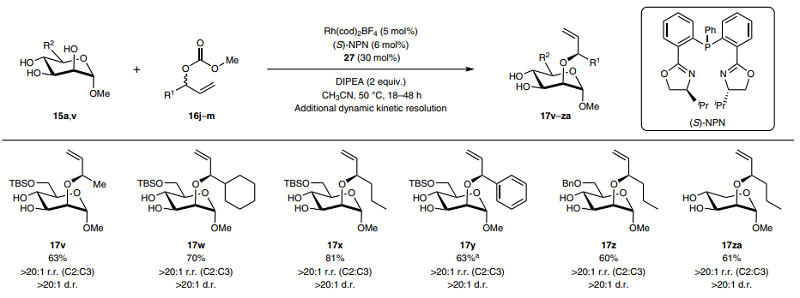
图5. 底物范围研究。图片来源:Nat. Chem.
为了进一步探究反应机理,作者进行了一系列控制实验。具体而言:1)当用DPPF代替 (R,S)-PPF-PtBu2在标准条件下进行反应时,产率、区域选择性和非对映选择性均有所降低(图6a);2)当体系中无硼酸催化剂时,产率和立体控制均受到影响,这表明两种催化剂对反应的立体控制至关重要;3)对照实验表明多元醇原位生成硼酸酯过程中所释放的催化量水对反应过程至关重要(图6b、6c);4)动力学实验表明Rh催化剂的浓度和硼酸的浓度均呈正相关(图6e、6f),进一步证实了作者提出的两种催化剂的协同作用对反应的决速步至关重要,同时利用Burés等人报道的图解法得出Rh催化剂和硼酸均与反应呈一级动力学相关(图6g、6h)。在此基础上,作者提出了铑/硼酸协同催化机理(图6i):首先,阳离子Rh(cod)2OTf络合物28՛与(R,S)-PPF-PtBu2发生配体交换得到铑络合物28,后者与氧杂苯并降冰片二烯16发生进一步的配体交换得到exo-配位的中间体29。随后,Rh(I)发生氧化加成得到静态Rh(III)中间体30a,而且30a存在两种共振式——30b和30c。与此同时,有机硼催化循环始于硼酸26与糖类化合物15a的cis-邻二醇发生可逆缩合得到硼酸酯32,后者在三乙胺的作用下与一分子水反应生成更具亲核性的硼酸盐络合物33,这即是作者提出的有机硼催化剂的静息态。接下来,硼酸盐络合物33的O3以SN2՛方式对Rh(III)中间体30a的endo-面进行高立体控制的位点选择性外球型进攻,最后经还原消除得到硼酸半酯31,后者水解后便可得到产物17,同时再生催化剂28和26。
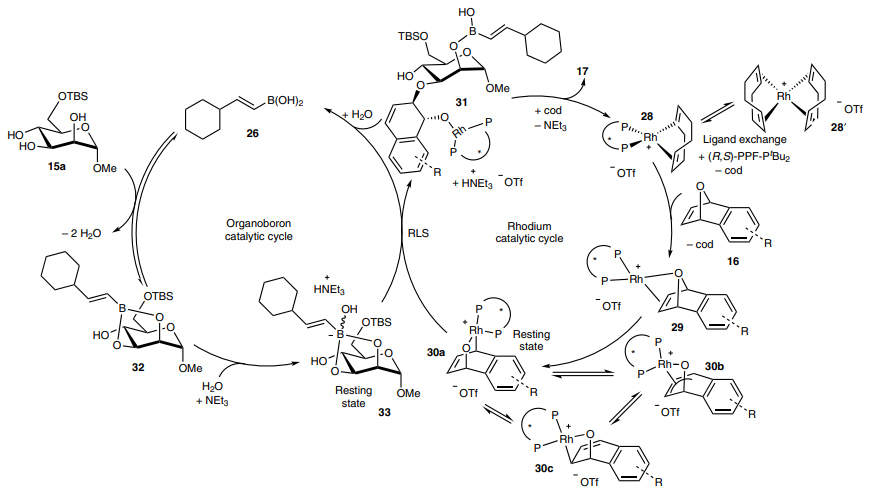
图6. 反应机理。图片来源:Nat. Chem.
为了证明此转化的实用性,作者还进行了一系列合成应用转化(图7)。具体而言:1)在降低铑催化剂负载量(4 mol%)的条件下实现1 mmol规模反应,并以90%的产率、>20:1 r.r.值和>20:1 d.r.值得到产物17a(图7a);2)17a在室温下经Pd/C还原以当量的产率得到氢化产物34,或者在TBAF作用下脱除TBS保护基,并以92%的产率得到产物35(图7b);3)炔基连接的糖产物17e与叠氮化物通过点击化学分别实现了糖的三唑衍生物36(产率:96%)和37(产率:63%)的合成(图7c);4)半乳糖衍生物17k可以与38进行酸催化的2-脱氧糖基化,并以高度α-选择性的方式得到二糖产物39(图7d)。
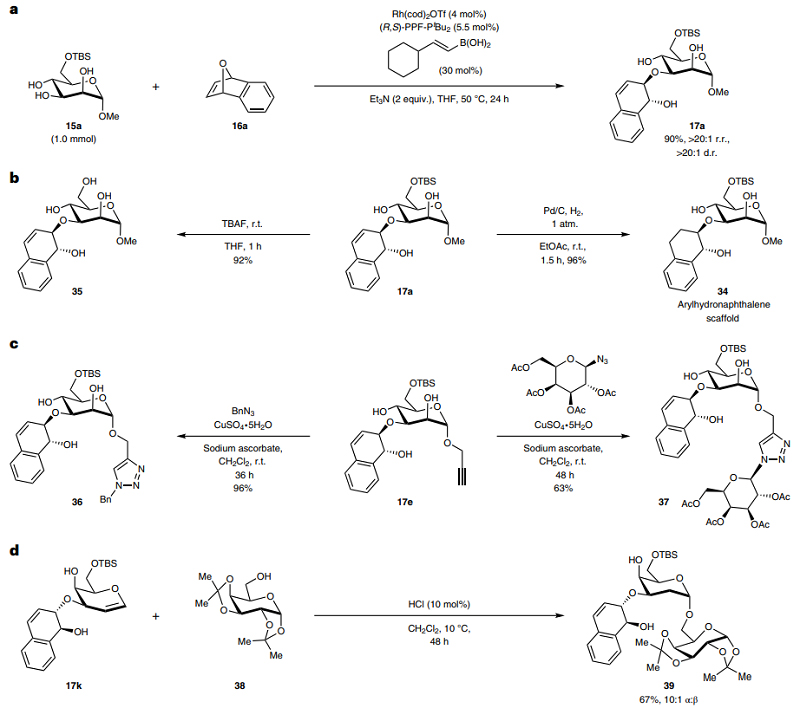
图7. 合成应用。图片来源:Nat. Chem.
总结
Charles C. J. Loh团队利用铑/有机硼协同催化策略,高立体选择性地实现了具有生物学活性的芳基氢化萘糖苷化合物的合成。选择合适的有机硼作为共催化剂是成功的关键。该策略也为具有生物活性的芳基氢化萘糖苷骨架的立体选择性合成提供了新思路。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A synergistic Rh(I)/organoboron-catalysed site-selective carbohydrate functionalization that involves multiple stereocontrol
V. U. Bhaskara Rao, Caiming Wang, Daniel P. Demarque, Corentin Grassin, Felix Otte, Christian Merten, Carsten Strohmann, Charles C. J. Loh
Nat. Chem., 2022, DOI: 10.1038/s41557-022-01110-z
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号