南科大刘心元团队Nat. Synth.:铜催化的立体汇聚式自由基Michaelis–Becker C(sp³)–P交叉偶联反应
α-手性的烷基膦化合物是有机合成中重要的分子砌块,也是在活性分子、农药以及材料中得到广泛应用的关键功能单元(图1a)。因此发展不对称催化构建手性C(sp3)–P键的方法十分重要。Michaelis–Becker反应最早在19世纪末被发现,迄今为止已经被应用长达一个多世纪,是最有效的快速构建C(sp3)–P键的方法之一。然而,由于其立体专一的SN2机理特点,该方法始终无法被用于构建手性的C(sp3)–P键(图1b)。近年来,随着3d过渡金属催化的发展,实现这类反应的不对称转化迎来了契机。3d过渡金属可以通过单电子还原将外消旋的烷基卤代物转化为潜手性的烷基自由基物种,通过这种反应机理,可以实现立体汇聚式的不对称Michaelis–Becker反应(图1c)。
刘心元教授团队一直以来致力于发展铜催化的不对称自由基反应,他们在先前的工作中发现手性阴离子配体可以提高一价铜的还原性,从而可以将外消旋的烷基卤代物还原为潜手性的烷基自由基。在这样一种催化体系下,该团队已经实现了一系列立体汇聚式的自由基C(sp3)–C/N交叉偶联反应(J. Am. Chem. Soc. 2022, 144, 17319 (Perspective); Nat. Chem. 2019, 11, 1158; J. Am. Chem. Soc. 2021, 143, 15413; Nat. Chem. 2022, 14, 949; etc.)。在这些工作基础上,刘心元团队设想利用此类手性的铜催化剂是否可以实现立体汇聚式的Michaelis–Becker C(sp3)–P交叉偶联反应。然而,实现这一反应也面临一定的难题:首先是前面提到的SN2背景反应难以抑制;其次是亚磷酸酯对铜的强配位能力可能造成对催化剂的毒化;另外一价铜的还原能力不足导致反应启动困难;最后在铜催化的体系下,不可避免的会产生P–P偶联的副产物。针对上述挑战,找到合适的配体从而使反应中间体int-I和int-II可以发生设想的立体汇聚式交叉偶联反应并克服竞争性的副反应就显得非常关键(图1c)。在这一思路的指导下,刘心元团队实现了铜催化的立体汇聚式自由基Michaelis–Becker C(sp3)–P交叉偶联反应。该反应具有非常高的化学和立体选择性,能很好的兼容苄基、炔丙基以及羰基位卤代物。更重要的是,产物可以经过简单转化得到多种多样的手性含磷砌块和先导药物,为合成α-手性烷基膦类化合物提供了多样化便捷的合成平台,充分说明了这一方法的实用性(图1d)。相关研究成果在《自然•合成》(Nature Synthesis)期刊上发表。

图1. 反应的背景和设计
作者首先对背景反应进行测试,找到合适的可以抑制背景反应的溶剂。接着作者通过对配体筛选发现金鸡纳碱骨架的N,N,P配体可以有效提高反应的产率和对映选择性,经过对配体进一步的改造以及铜催化剂、温度等反应参数的优化,最终能以较高产率和对映选择性得到目标产物(图2)。

图2. 配体对反应的影响
在拿到最优反应条件之后,作者测试了这一立体汇聚式C(sp3)–P偶联反应的普适性。作者发现,不同取代基的亚磷酸酯均可兼容这一反应,以较高产率和ee值得到目标产物。另外,反应还兼容一系列不同取代基的苄基卤代物,包括各类含杂芳环以及烷基端有不同活性官能团的烷基卤代物。值得一提的是,当底物中同时存在一级和二级卤代物时,反应能高化学选择性地发生在苄位的二级位点。
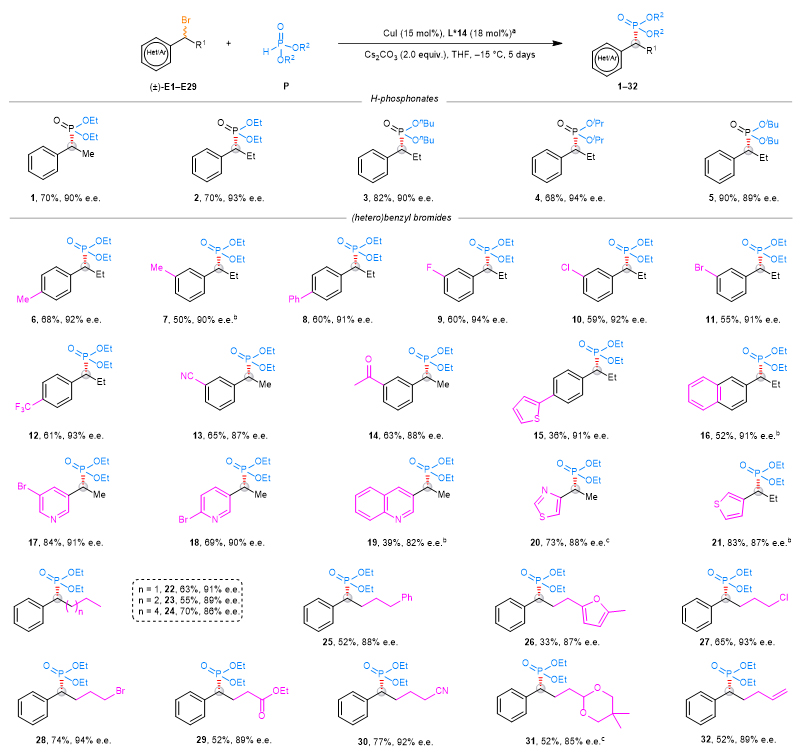
图3. 苄基卤代物底物适用范围
为拓宽反应的适用范围,作者测试了更多类型的烷基卤代物(图4)。首先以炔丙基的溴代物作为底物,在经过对反应条件简单的优化之后,作者发现反应依然能很好地兼容各类亚磷酸酯。当在烷基链端引入不同官能团或者更换不同的炔基保护基时,反应依然可以能以较高产率和对映选择性得到产物。如果使用活性更低的炔丙基氯代物进行反应,反应产率略微下降,但是对映选择性与溴代物类似。这一现象可能与P–P偶联副产物的生成增加以及亚磷酸酯底物的分解有关。
羰基β位的手性膦化合物是一些先导药物的关键功能单元(图1a),因此作者用羰基α位烷基卤代物进行反应的尝试(图4)。在模板条件下,反应的产率和立体选择性都非常差,作者推测可能是因为这一类底物的活性比较高,因此将配体更换为电子密度更低的N,N,N-配体,最终可以以较好的对映选择性得到目标产物。另外,对于三级的氯代物,上述配体均不适用,作者经过配体筛选发现空间位阻更低的一类N,N,N-配体可以使反应以中等对映选择性发生,后续工作仍在进行中。

图4. 炔丙位以及羰基α位底物适用范围
为了表明该方法的应用潜力,作者通过简单的反应将得到的产物手性保持地转化为其他的手性官能团,例如纯烷基的手性膦、三价膦硼烷(图5a)。除此之外,作者经过设计,采用他们的方法以及其他简单的合成步骤,成功对一类先导药物fosmidomycin类似物进行了合成(图5b)。这种化合物有非常好的抗疟效果,然而对于它的催化不对称合成方法报道非常少,本研究的方法为构建这类手性fosmidomycin衍生库提供了一个多功能平台,有利于发现有前景的先导药物。
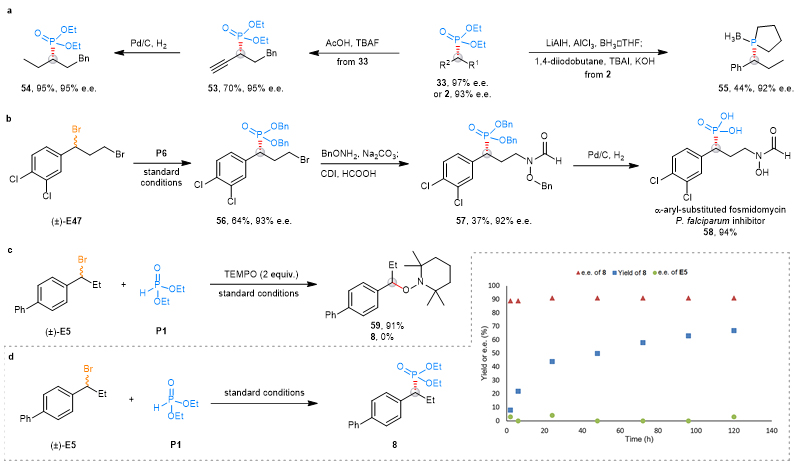
图5. 反应适用性和机理研究
机理研究发现,当向反应体系中加入自由基捕获试剂(TEMPO)时,主反应被明显抑制,同时可以观察到TEMPO捕捉烷基自由基的产物(图5c)。这表明了反应经过了作者预想的烷基自由基历程。将反应在不同时间淬灭,没有观察到回收烷基溴代物的对映体富集现象,表明反应不是一个动力学拆分的过程。随着反应的进行,产物的ee值是始终不变的,表明反应过程的机理是始终如一的(图5d)。这一系列机理实验均可以佐证作者提出的反应机理设想。
总结
南方科技大学刘心元团队使用亚磷酸酯作为亲核试剂,使用外消旋的烷基卤代物作为亲电试剂,实现了铜催化的自由基不对称Michaelis–Becker C(sp3)–P交叉偶联反应。反应能成功实现的关键是使用合适的手性阴离子配体,抑制SN2的背景反应和P–P偶联的副反应,从而使反应有较好的化学选择性和立体选择性。反应有非常广的底物适用范围,产物可以经过简单转化得到多种多样的手性含磷砌块和先导药物。该研究成果为不对称自由基交叉碳–杂偶联反应提供了可行策略和新思路。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

A general copper-catalysed enantioconvergent radical Michaelis–Becker-type C(sp3)–P cross-coupling
Li-Lei Wang, Huan Zhou, Yu-Xi Cao, Chi Zhang, Yang-Qing Ren, Zhong-Liang Li, Qiang-Shuai Gu, Xin-Yuan Liu*
Nat. Synth., 2023, DOI: 10.1038/s44160-023-00252-3
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号