Nature:不用手性配体,不对称过渡金属催化怎么做?
过渡金属催化的不对称转化是获取手性分子的强有力策略,其中手性配体是调控催化剂活性和立体选择性的关键因素。然而,传统的手性配体在过渡金属催化的不对称转化中却存在许多潜在的问题,包括:1)由金属中心决定的配位几何结构可能使手性配体组分与远离形成的立体中心,从而导致较差的立体化学;2)Lewis碱性手性配体的结合可能会抑制金属催化剂的反应性;3)金属配合物反应性所需的配体可能并不能进行手性设计。为此,化学家开发了一种替代策略(即利用与阳离子金属配合物结合的手性阴离子),例如:Toste和List分别利用手性联萘酚衍生的磷酸盐阴离子实现了Au(I)催化丙二烯加成反应和钯催化醛的α-烯丙基化,Matsunaga则是利用手性二磺酸盐阴离子实现了(Cp*)Rh(III)配合物催化的吡啶基导向芳烃的对映选择性C-H键官能团化。尽管手性抗衡阴离子在过渡金属催化中具有潜在的应用价值,但因其自身强配位能力或碱性因素导致其在不对称催化中的应用十分有限。近年来,在涉及带电中间体的有机反应中,阴离子结合(anion-binding)催化已被证明是实现不对称诱导的有效策略。特别是手性双氢键供体(hydrogen-bond donor, HBD),例如脲类、硫脲类或方酰胺类,可结合与阳离子有机中间体缔合的多种阴离子以产生手性离子对。目前,化学家已经证明小分子HBD催化剂可通过选择性参与与底物之间的非共价相互作用来控制反应的对映选择性,而且手性HBD也可以通过阴离子结合与非手性催化剂(如Brønsted酸或主族Lewis酸)协同相互作用来调节反应性并促进对映选择性反应。
近日,美国哈佛大学Eric N. Jacobsen教授(点击查看介绍)课题组开发了一种在过渡金属催化反应中诱导对映选择性的新方法(图1b),即利用中性氢键供体来结合阳离子过渡金属配合物的阴离子,并通过与其它非共价相互作用协同的离子配对实现对映控制和速率提升。机理研究表明,该反应中手性双硫脲HBD的协同阴离子结合效应是钌催化的分子内炔丙基取代反应中高对映选择性(高达99% ee)的主要原因。相关成果发表于Nature 上。
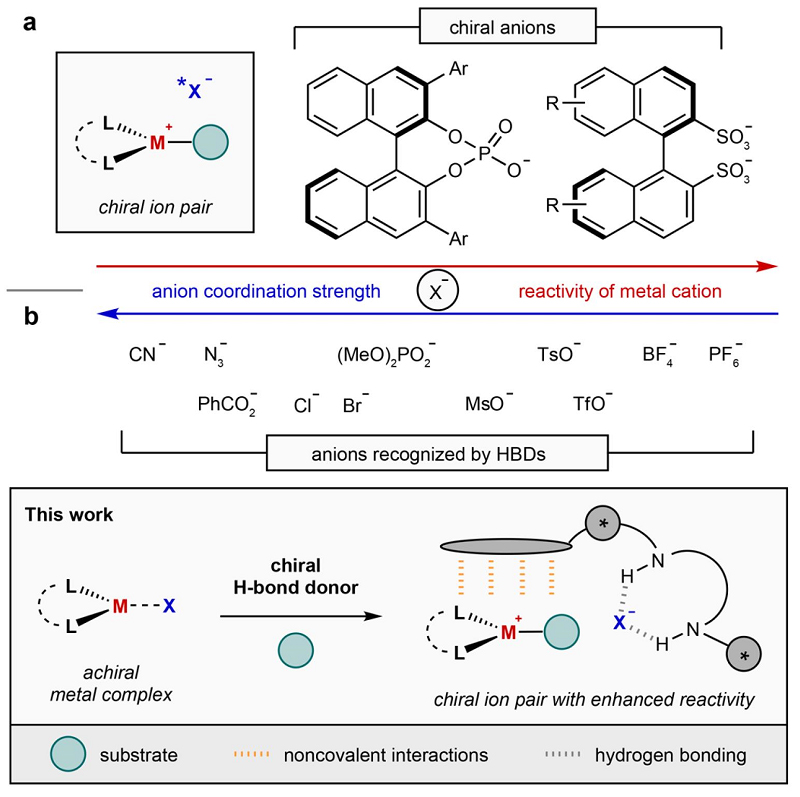
图1. 过渡金属催化的不对称反应策略。图片来源:Nature
近年来,Nishibayashi等人利用Thiolate-桥联的二钌配合物(3)活化炔丙醇以形成离子型钌-亚联烯基中间体,可与多种亲核试剂进行反应,但是空间位阻配体的加入会降低二钌催化剂的反应性。为此,作者尝试利用手性HBD(4)结合二价钌配合物中的阴离子以增加金属中心的反应性,并通过离子对的非共价相互作用诱导反应的对映选择性。如图2a所示,作者选择钌催化外消旋炔丙基醇(1)的分子内取代反应来探索手性HBD和过渡金属配合物之间的协同催化,初步研究表明HBD 4a与市售的二氯化二钌配合物3a能以低产率和对映选择性获得手性色烷产物2a,而离子型tosylate-二钌配合物3b与4a可有效促进环化,尽管对映选择性仍较低。有趣的是,使用双硫脲HBD 4b作为助催化剂可以显著提高反应的产率和对映选择性,而改变双硫脲HBD催化剂骨架上芳基取代基也可提高反应效果,例如:双硫脲HBD 4d能以95% ee和36:1 dr获得产物2a。此外,降低反应温度并使用混合溶剂可进一步提高反应的对映选择性(98% ee)和非对映选择性(63:1 dr),同时还能降低催化剂3b与4d的负载量。值得一提的是,对照实验表明催化剂3b和4d之间的协同作用对反应性至关重要。在最优条件下,作者对底物范围进行了探索(图2b),结果显示苯环4-6位含有多种取代基的芳基炔基甲醇均可顺利实现环化,并以优异的对映选择性(94~99% ee)和非对映选择性(dr≥20:1)获得相应的色烷衍生物(2a-2i)。类似地,(Z)-烯烃部分含有苯基的底物也能以良好的产率和高选择性获得产物2j,而其它类型链烯基炔丙醇(2k和2l)则能有效地环化为所需产物。
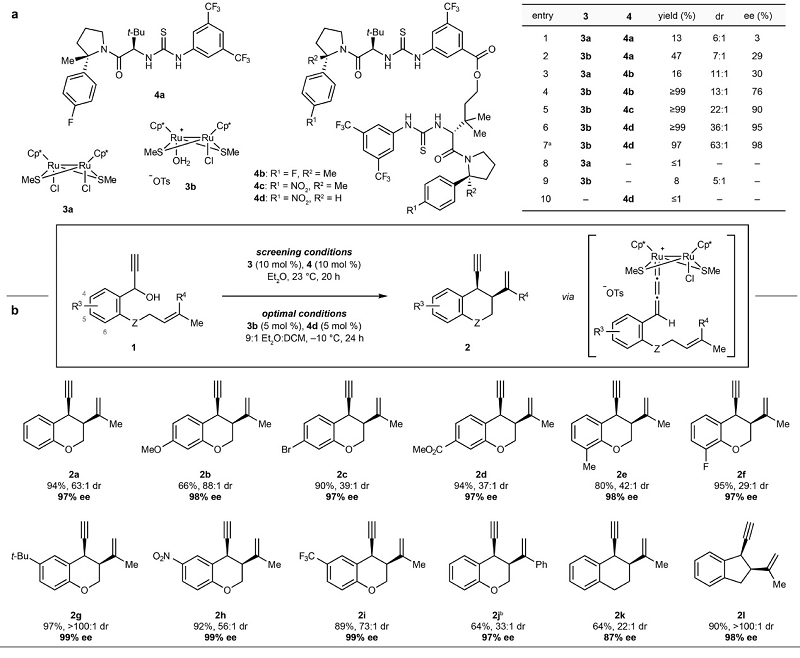
图2. 条件筛选和底物拓展。 图片来源:Nature
接下来,作者对双硫脲HBD和二钌配合物之间的高对映选择性协同机制进行了研究(图3a),结果显示含有多种不同阴离子的二钌配合物与双硫脲HBD 4d结合后均能有效地促进反应,这表明该协同催化策略有可能扩展到其它含有多种常见阴离子的过渡金属配合物。然而,含有四(3,5-二(三氟甲基)苯基)硼酸盐(BArF4)阴离子的二钌配合物3c共催化时却获得了外消旋产物。为此,作者利用1H NMR对4d与tosylate-二钌配合物(5a)和BArF4-二钌配合物(5b)的相互作用进行了研究(图3a,I和II),结果表明HBD与二钌配合物之间的结合直接取决于阴离子的种类,并且两者之间的相互作用会直接控制炔丙醇取代反应的立体效应。此外,作者还利用NMR分析对金属配合物的磺酸根阴离子与HBD之间的相互作用进行了研究,以甲磺酸盐5c和构象受限的双硫脲HBD 4e为研究对象,其光谱数据清楚地表明5c的甲磺酸阴离子和4e的两个硫脲基团的位置十分接近,这与 HBD和5c阴离子之间的协同氢键相互作用一致(图3b)。另一方面,溶剂也会影响反应的对映选择性(图3a,右),并且对映选择性与反应介质的介电常数呈负相关,这表明HBD结合的tosylate阴离子与阳离子二钌配合物之间形成紧密的离子对可以诱导反应的对映选择性。进一步在DCM-d2体系下对5a和4e 之间的1H NMR滴定实验表明二钌配合物与双硫脲HBD之间的相互作用主要依靠阴离子结合(图3a,III),并不涉及任何配位键相互作用。
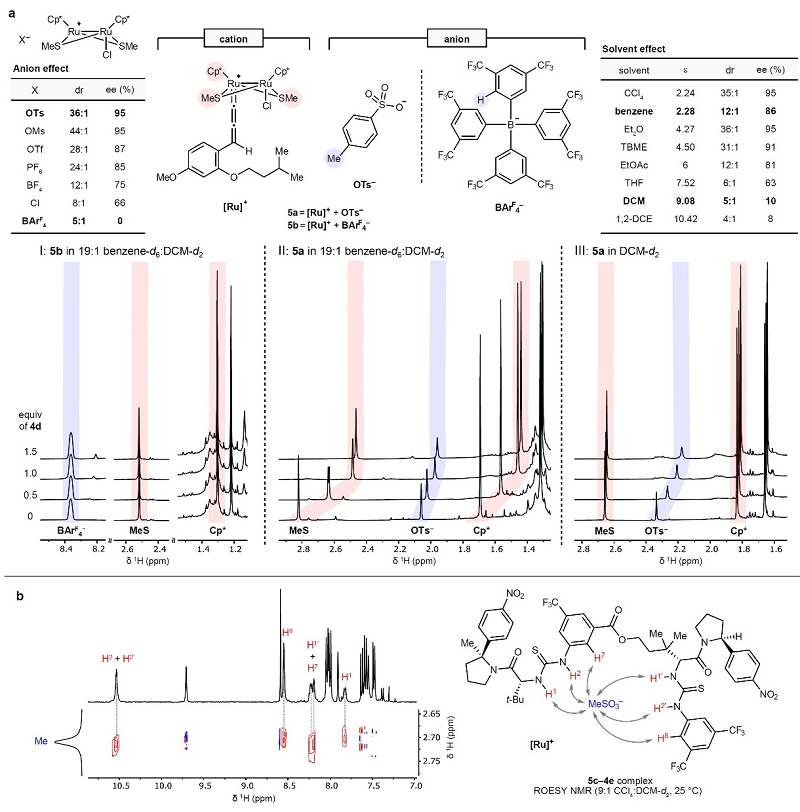
图3. 炔丙基取代反应中氢键供体与钌金属配合物相互作用模式的研究。图片来源:Nature
如图4a所示,作者发现双硫脲4d在二钌络合物3b催化炔丙基取代反应中可诱导20倍的反应速率提升,而对二钌-BArF4配合物3c催化的反应速率却没有影响,这些结果说明阴离子结合对反应的对映选择性和反应速率至关重要。尽管在4d存在下3b的催化效率明显高于含有非配位BArF4阴离子的催化剂3c,但是这不能简单地归因于tosylate阴离子与HBD结合时配位能力减弱,而且决速步中4d与二钌-底物络合物之间存在稳定的非共价相互作用。为了研究非共价相互作用的性质及其在对映选择性诱导中的作用,作者使用结构修饰的HBD共催化剂对炔丙基取代反应进行了动力学分析,发现双硫脲的芳基-吡咯烷组分对反应的对映选择性有显著影响,其中含有缺电子芳烃的双硫脲催化剂具有最高的对映选择性(图4b)。对HBD催化剂上的芳基诱导效应进一步分析后,发现对映选择性与含有不同取代基芳烃的HBD共催化炔丙基取代反应的速率呈正相关。将观察到的速率分解为两种对映体产生的贡献,发现对映选择性的增加源于主要对映体途径的加速和次要对映体途径的减速(图4b),这些结果表明在钌催化炔丙基取代反应中,双硫脲催化剂的芳基对稳定决速步的过渡态起到了重要作用,从而产生了主要对映体。另一方面,desmethyl-HBD 4d对反应的对映选择性和速率具有类似的相关性,这表明空间位阻较小的芳基吡咯烷也可以通过芳基来稳定过渡态。此外,5c-4e 1:1络合物的ROESY NMR分析表明4e的两个对硝基苯基都位于5c的富电子Cp*配体附近(图4c),同时密度泛函理论(DFT)计算表明4e的缺电子芳烃与5c的Cp*配体之间至少存在一种面对面的堆叠相互作用。
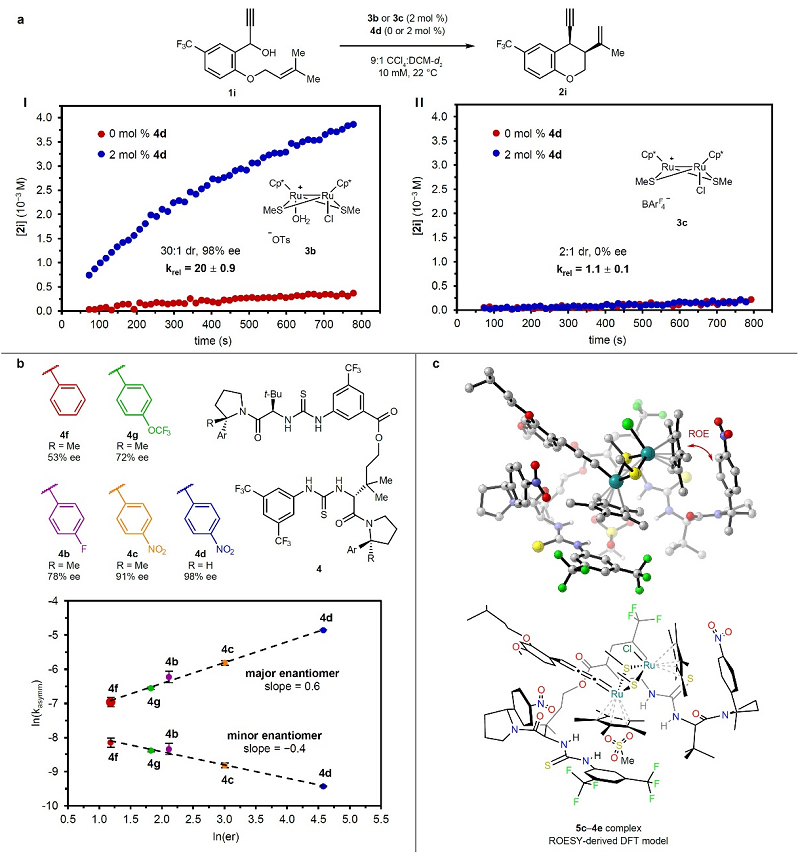
图4. 非共价相互作用对反应的对映选择性和速率的影响。图片来源:Nature
总结
Eric N. Jacobsen教授开发了一种在过渡金属催化反应中诱导对映选择性的新方法,即利用中性氢键供体结合阳离子过渡金属配合物的阴离子,并通过与其它非共价相互作用协同的离子配对实现对映体控制和速率提升。鉴于HBD识别的阴离子种类繁多,本研究中探索的阴离子结合协同策略将有望在过渡金属催化的不对称反应中得到广泛应用。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Enantioselective Transition-Metal Catalysis via an Anion-Binding Approach
John M. Ovian, Petra Vojáčková, Eric N. Jacobsen
Nature, 2023, DOI: 10.1038/s41586-023-05804-3
导师介绍
Eric N. Jacobsen
https://www.x-mol.com/university/faculty/26725
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号