基于生物传感器的微液滴筛选实现差向异构酶的高效催化
D-阿洛酮糖(D-allulose)是一种理想的低能量甜味剂替代品,同时其具有抗高血糖、抗动脉粥样硬化、降低血脂水平、神经保护和清除活性氧等多种有益的生理功能。生物酶法合成D-阿洛酮糖可以通过酮糖3-差向异构酶(KEase)特异性催化D-果糖C3位的差向异构实现,其具有高特异性、高催化活性等优势,在D-阿洛酮糖的生产应用中得到广泛认可。然而,目前已报道鉴定的该家族酶在工业生产条件下催化活性不足且耐受性差,严重阻碍了其在生物转化中的广泛应用。因此,开发高活性、高耐受性的KEase是实现D-阿洛酮糖工业化生产的关键。同时,基于传统微孔板筛选的模式通常耗时且效率低下,无法满足酶分子大规模突变体库高效筛选的需求,因此开发高效的筛选新策略以加速酶分子定向进化进程具有重要的意义。针对上述面临的问题,天津科技大学路福平教授、秦慧民教授研究团队设计并优化了基于生物传感器的微液滴超高通量筛选平台,结合结构指导的理性设计及定向进化,实现了合成D-阿洛酮糖的差向异构酶的高效催化。相关成果发表于Angewandte Chemie上。
研究团队首先利用特异性响应D-阿洛酮糖的转录调控因子PsiR及其调控的启动子系统搭建了可以检测体系中D-阿洛酮糖含量的生物传感器系统,利用绿色荧光蛋白(mEmerald)作为信号输出模块,将体系中D-阿洛酮糖的含量与宿主菌荧光信号强度相耦联。进一步地,通过设计基于微孔板的筛选策略,该研究对调控因子PsiR进行了功能改造,大大改善了生物传感器系统对D-阿洛酮糖的响应灵敏度。同时,基于结构模型分析,揭示了调控因子改善对D-阿洛酮糖响应灵敏性的分子机理。
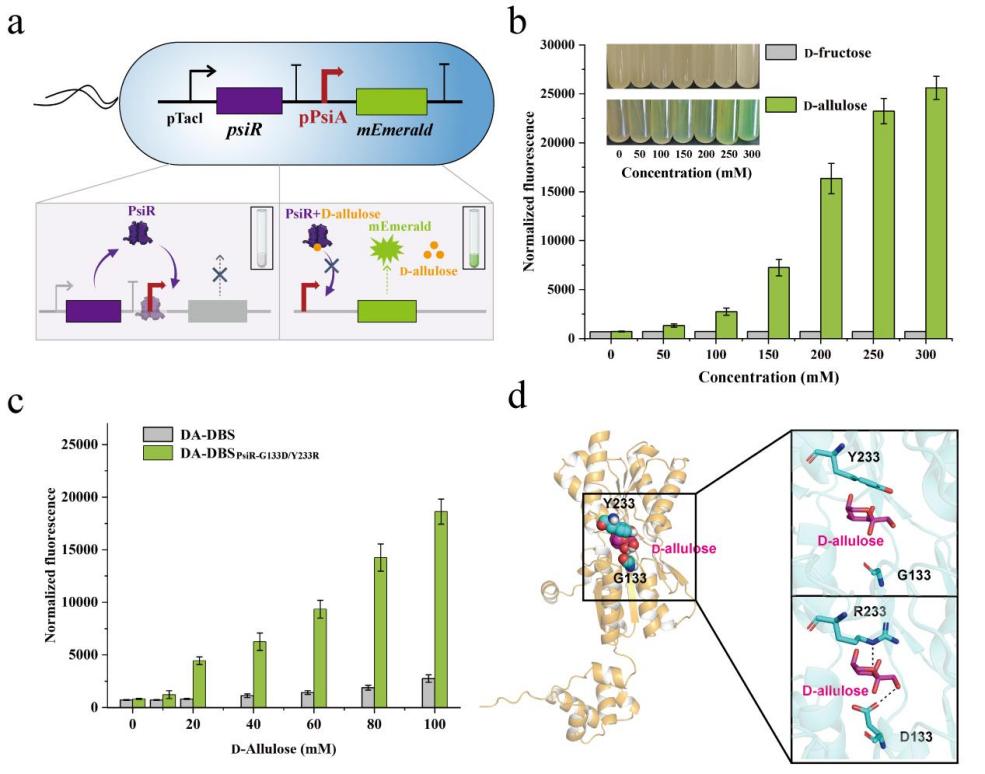
图1. D-阿洛酮糖生物传感器的设计及优化
进一步地,该研究将上述传感器系统与KEase表达系统相耦合,实现了目标酶催化活性与宿主菌荧光信号的关联,搭建了基于荧光检测的目标酶筛选系统。为了避免目标检测分子D-阿洛酮糖在筛选反应池中的串扰,本研究借助液滴微流控平台优秀的单细胞分离及分选能力,结合上述体内酶筛选传感器系统,构建了KEase酶的微液滴高通量筛选策略:1)目标酶突变体库的构建;2)突变体库单细胞及相关试剂液滴共包裹;3)单细胞液滴适温培养;4)基于液滴内细胞荧光信号的液滴分选,收集阳性液滴;5)回收阳性变体,进行活性分析。
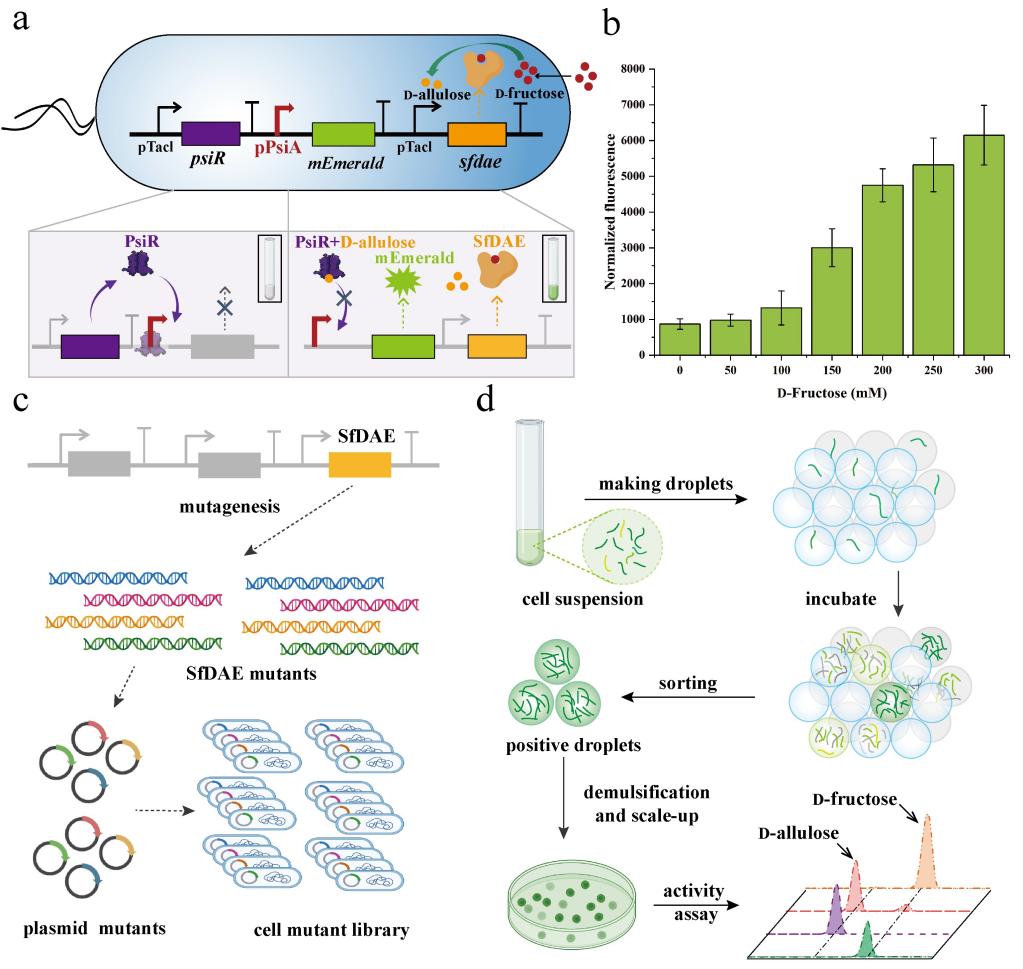
图2. 基于生物传感器的微液滴高通量筛选策略
该研究以来自于Sinorhizobium fredii CCBAU 83666的D-阿洛酮糖3-差向异构酶(SfDAE)为研究对象,通过蛋白晶体结构衍射获取酶分子结构信息,鉴定了酶分子催化活性口袋重要氨基酸位点(催化残基、金属离子结合残基等),同时运用结构生物学和分子动力学模拟的方法首次识别了该家族酶位于底物结合口袋处的高灵活性盖子结构,其在底物分子进入酶分子活性口袋的过程中呈现有规律的“打开”和“关闭”两种主要构象,揭示了其在底物进入酶分子活性口袋的过程中发挥着至关重要的调控作用。
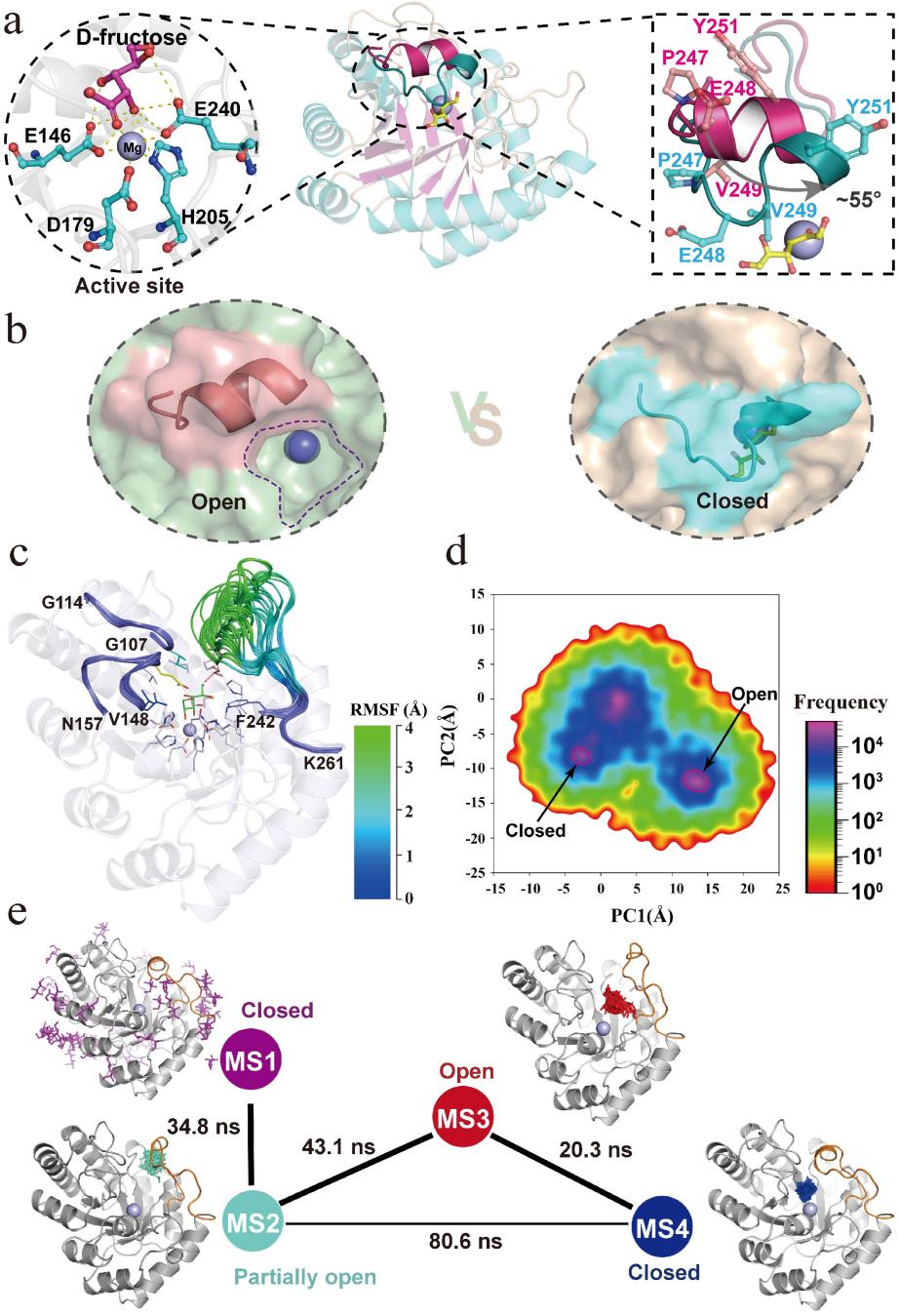
图3. SfDAE结构分析及分子动力学模拟
基于酶分子结构信息,该研究利用上述微液滴高通量筛选平台对酶分子进行设计,以优化活性中心及高灵活盖子区域关键氨基酸残基,同时结合定向进化理论从酶分子全局出发进行高通量定向筛选,在维持其高热稳定性的同时,将目标酶SfDAE的催化效率提升了17倍。基于结构分析及分子动力学模拟,揭示关键氨基酸残基突变的引入重塑了酶分子活性位点的结构构象和底物口袋的大小,同时改善了盖子区域的灵活性及摆动范围,进而阐明了酶分子催化效率提升的分子机理。
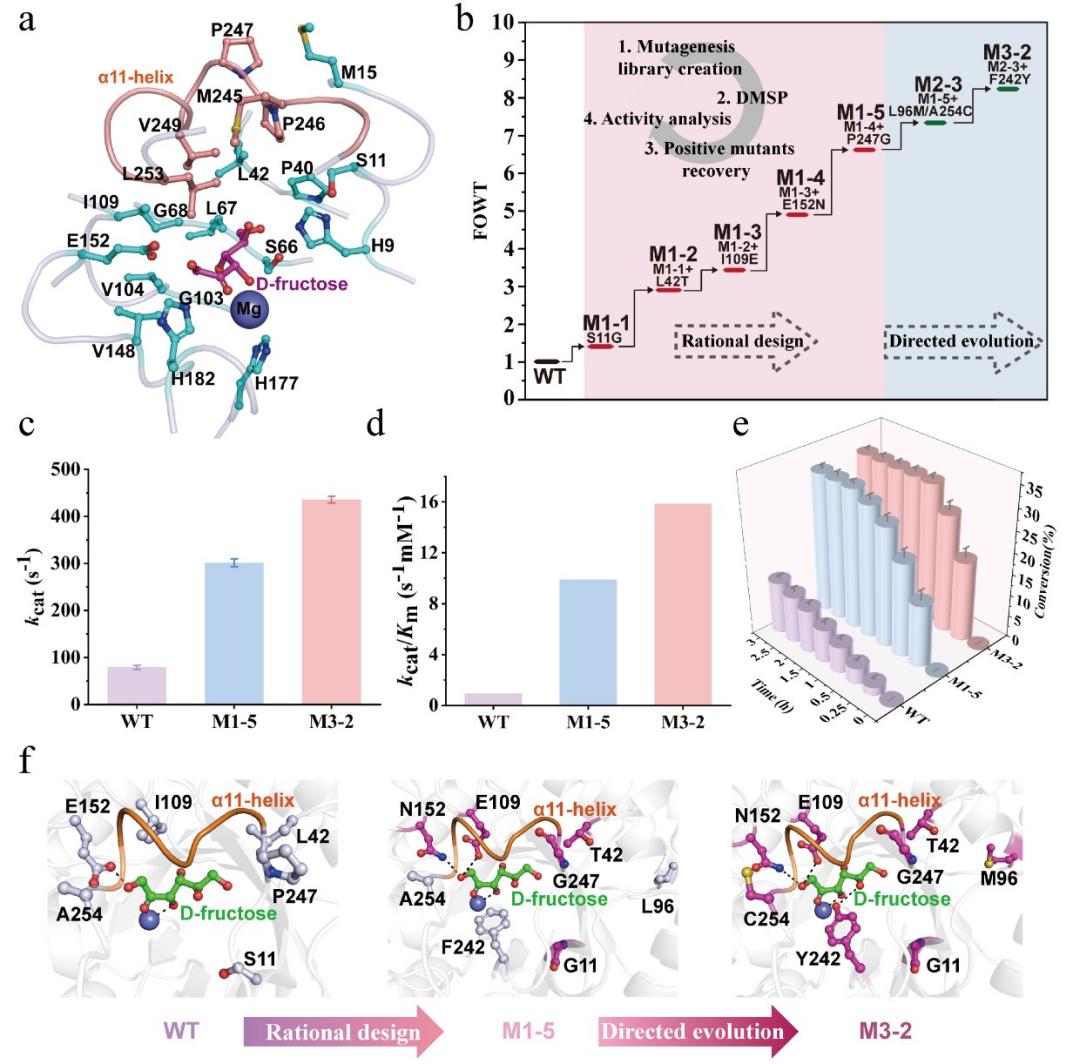
图4. 基于结构的SfDAE理性设计及定向筛选
小结
该研究工作成功设计并优化了基于生物传感器的微液滴高通量筛选系统,以作为一种低成本、高通量的酶筛选工具,用于定向进化KEase及其他D-阿洛酮糖转化相关酶。基于酶分子结构信息的解析,首次识别了KEase家族酶位于底物结合口袋处对底物识别具有重要调控作用的盖子结构,以结构信息为导向的理性设计结合随机突变的高通量定向筛选,开发了高性能KEase,用于D-阿洛酮糖的高效合成。本研究对D-阿洛酮糖转化相关酶的功能改造具有指导意义,同时为酶功能改造提供一种高效筛选的新方法。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Substantial Improvement of an Epimerase for the Synthesis of D-Allulose by Biosensor-Based High-Throughput Microdroplet Screening
Chao Li, Xin Gao, Hongbin Qi,Wei Zhang, Lei Li, Cancan Wei, Meijing Wei, Xiaoxuan Sun, Shusen Wang, Liyan Wang, Yingbin Ji, Shuhong Mao, Zhangliang Zhu, Masaru Tanokura, Fuping Lu, Hui-Min Qin*
Angew. Chem. Int. Ed., 2023, DOI: 10.1002/anie.202216721
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号