NUS陈小元教授和福州大学林立森教授Angew:通过调节细胞膜不饱和度促进脂质过氧化进程来提高化学动力学疗法
化学动力学疗法 (chemodynamic therapy, CDT) 是一种新兴的治疗策略,通过将细胞内过表达的过氧化氢转化为高毒性的羟基自由基 (hydroxyl radicals, •OH) 来抑制肿瘤生长。其中,脂质过氧化是CDT治疗中最具破坏性的过程之一。多不饱和脂肪酸 (Polyunsaturated fatty acids,PUFAs) 是一类具有两个或多个碳碳双键的膜脂,与亚甲基相邻的双键的存在削弱了亚甲基碳-氢键,从而使氢更容易被抽提,因此PUFAs比饱和或单不饱和脂肪酸更容易受到活性氧引发的脂质过氧化影响,但目前还没有研究探讨细胞膜不饱和程度对CDT疗效的影响。
为了进一步提高化学动力学疗法的疗效,新加坡国立大学(NUS)陈小元教授和福州大学林立森教授在Angew. Chem. Int. Ed.期刊上发表文章,报道了一种化学动力学纳米剂,通过调节细胞膜的不饱和度诱导脂质过氧化,进而实现了增强型的化学动力学疗法。该纳米系统由红细胞膜 (erythrocyte membrane,EM) 包被已负载齐墩果酸 (oleanolic acid,OA) 的铁单原子催化剂 (Fe single-atom catalyst,Fe-SAC) 组成。OA@Fe-SAC@EM NPs被肿瘤细胞摄取后,内源性过表达的H2O2可自由穿过EM壳来参与Fe-SAC介导的催化反应。催化生成的•OH不仅启动CDT过程,还导致EM的破裂和随后的OA释放。释放的OA上调蛋白-酰基辅酶a合成酶长链家族成员4 (Acyl-CoA synthetase long-chain family member 4, ACSL4) 的表达来改变细胞膜的不饱和度,诱导脂质过氧化发生来增强CDT疗效。
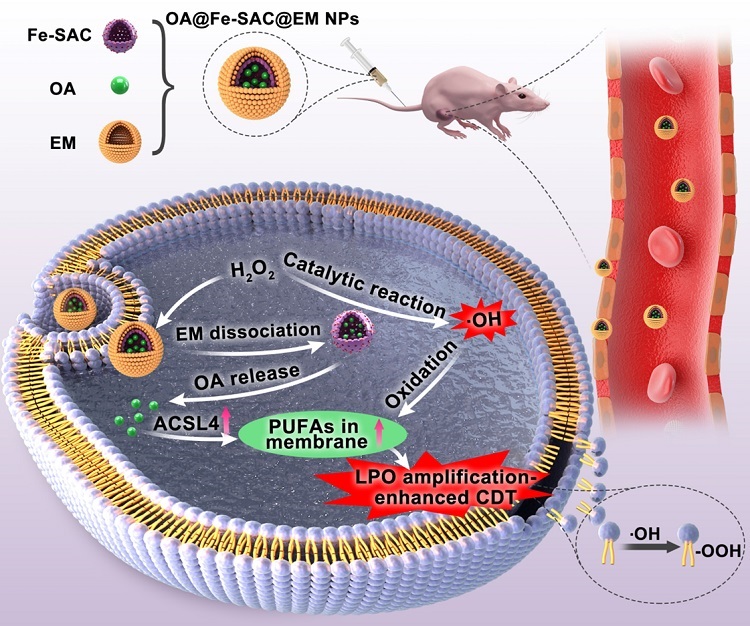
图1. OA@Fe-SAC@EM NPs在增强抗肿瘤CDT中的应用。
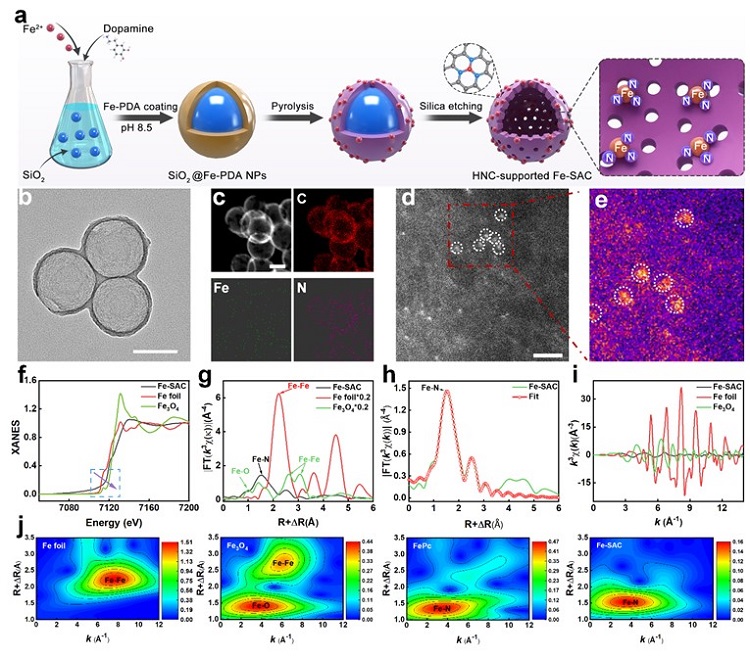
图2. Fe-SAC纳米颗粒的合成示意图,形貌和结构表征。(a) Fe-SAC的合成步骤。(b) S-N/Ni SAE的TEM图像。(c) Fe-SAC的EDX映射图像。(d) Fe-SAC的HAADF-STEM和 (e) 原子重叠高斯函数拟合映射图像。(f) Fe-SAC的XANES光谱和 (g) 傅里叶变换EXAFS光谱。(h) Fe-SAC在R空间的EXAFS拟合光谱。(i) Fe-SAC在k空间的EXAFS拟合光谱。(j)Fe-SAC的EXAFS拟合光谱的小波变换图像。
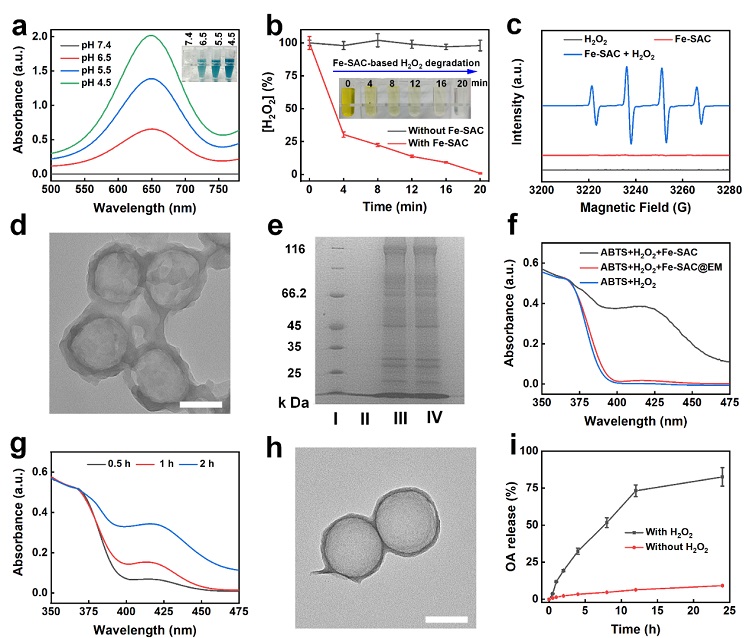
图3. Fe-SAC的催化反应活性研究。(a) Fe-SAC在不同pH条件下催化TMB的UV-vis光谱和照片。(b)硫酸钛比色法测定Fe-SAC介导的H2O2降解。(c) ESR测定羟基自由基。(d) OA@Fe-SAC@EM NPs的TEM图像。(e) SDS-PAGE蛋白分析。I、II、III、IV分别为标记物Fe-SAC、EM和OA@Fe-SAC@EM NPs。(f) Fe-SAC@EM NPs或Fe-SAC催化ABTS的紫外-可见光谱。(g) Fe-SAC@EM NPs处理ABTS不同时间的紫外-可见光谱。(h)H2O2处理24 h后OA@Fe-SAC@EM NPs的TEM图像。(i) OA@Fe-SAC@EM NPs中的OA在不同条件下的释放曲线。
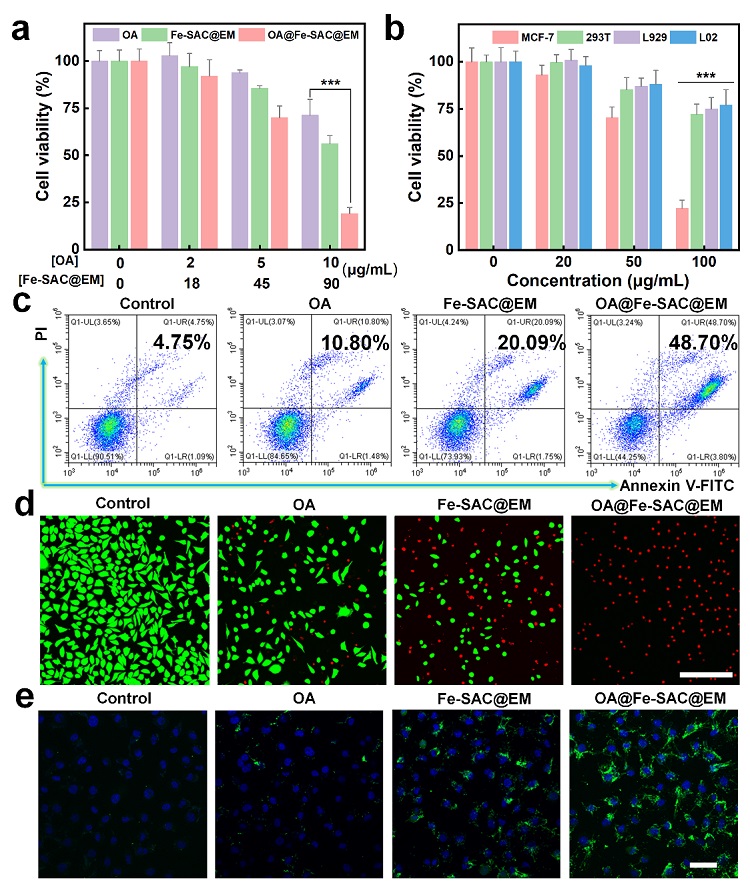
图4. OA@Fe-SAC@EM NPs对肿瘤细胞产生的化学动力学毒性分析。(a) OA、Fe-SAC@EM NPs或OA@Fe-SAC@EM NPs处理24 h后MCF-7细胞的活力。(b) CCK-8法测定OA@Fe-SAC@EM NPs对不同细胞活力的影响。(c) 流式细胞术分析不同配方处理后MCF-7细胞的凋亡率。(d) 死活细胞染色成像分析不同配方处理后MCF-7细胞。(e) 不同处理MCF-7细胞后的DCF荧光
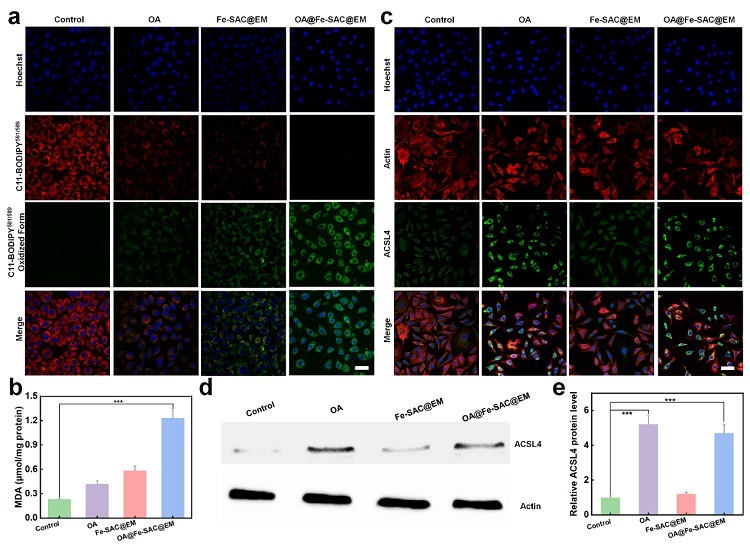
图5. OA@Fe-SAC@EM NPs产生化学动力学毒性的机理。(a) 不同配方处理24 h后C11-BODIPY581/589染色MCF-7细胞的CLSM图像。(b) 不同配方处理24 h后细胞内的MDA水平变化。(c) 不同配方处理MCF-7细胞中ACSL4(绿色)和actin (红色)的CLSM图像。(d) Western blot分析和(e) 定量分析不同配方处理后ACSL4在MCF-7细胞中的表达。
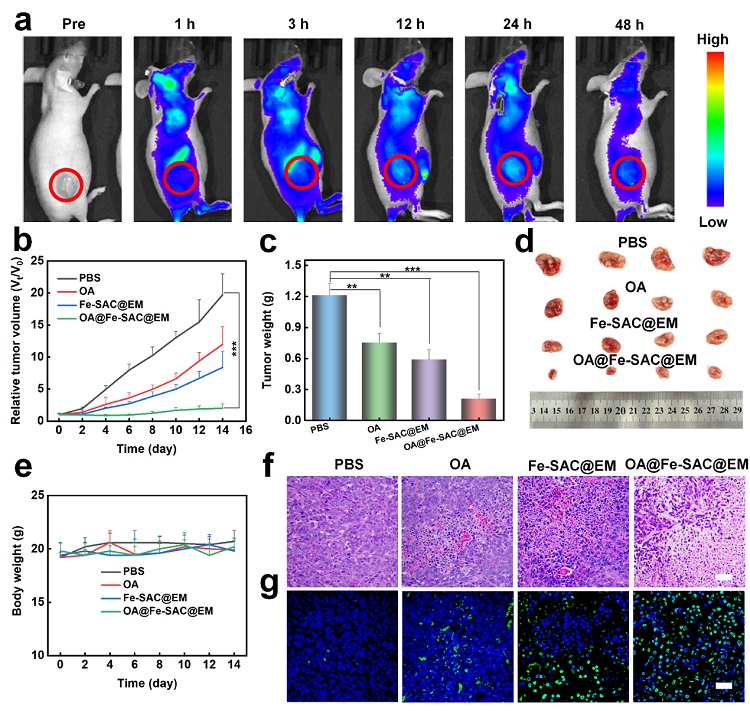
图6. OA@Fe-SAC@EM NPs的抗肿瘤效果。(a) 静脉注射cy5.5标记的OA@Fe-SAC@EM NPs后MCF-7荷瘤小鼠的体内荧光图像。(b) 静脉注射不同配方小鼠的肿瘤生长相对曲线。(c) 治疗后14天各组小鼠肿瘤的平均体重和 (d) 照片。(e) 治疗期间小鼠体重曲线。(f) 各组肿瘤切片的H&E染色和(g) TUNEL染色。
新加坡国立大学和福州大学联合培养博士后朱阳为该研究的第一作者,通讯作者为新加坡国立大学陈小元教授和福州大学林立森教授。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Amplification of Lipid Peroxidation by Regulating Cell Membrane Unsaturation to Enhance Chemodynamic Therapy
Yang Zhu, Peng Gong, Jun Wang, Junjie Cheng, Wenyu Wang, Huilan Cai, Rujiang Ao, Hongwei Huang, Meili Yu, Lisen Lin, Xiaoyuan Chen
Angew. Chem. Int. Ed., 2023, DOI: 10.1002/anie.202218407
研究团队简介
陈小元教授,1999年获美国爱达荷大学博士学位,随后于雪城大学和华盛顿大学圣路易分校开展博士后研究。2002年进入南加州大学放射学系任助理教授,2004年转入斯坦福大学,2008年升为副教授。2009年加入美国国立卫生研究院生物医学影像及医学工程所任终身资深研究员,分子影像及纳米医学实验室主任。现任新加坡国立大学杨潞龄医学院/工程学院终身Nasrat Muzayyin讲席教授。其科研方向主要涉及体外诊断、体内成像、基因/药物的纳米载体以及诊疗一体化。目前已发表900多篇同行评议论文和书籍章节, 截至2022年11月10日,Google Scholar的总引用量>113,000 (H-index: 176)。陈教授优秀的研究使其曾被选为AIMBE Fellow(2017)和SNMMI Fellow(2020),获得SNMMI Michael J Welch奖(2019年)、ACS Bioconjugate Chemistry Lecturer Award(2016年)、NIH主任奖(2014年)、NIBIB导师奖(2012年)在内等多个荣誉。当前,陈教授还是美国华裔核医学与分子成像学会(CASNMMI)前任会长,美国核医学与分子成像学会(SNMMI)放射性药物科学理事会(RPSC)前任会长,美国华裔纳米医学与纳米生物技术学会(CASNN)前任会长。
https://www.x-mol.com/university/faculty/38289
林立森教授:福州大学博士生导师,闽江学者特聘教授。围绕生物分析、分子影像、纳米医学等领域开展研究。在学术期刊上共发表SCI论文40余篇。近几年来,以第一作者或通讯作者在J. Am. Chem. Soc., Angew. Chem. Int. Ed., Adv. Mater., ACS Nano,Adv. Funct. Mater.等杂志上发表SCI论文10余篇,热点论文1篇,高被引论文3篇。
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号