ACS Nano | 重庆大学王亚洲:基于树突状细胞抗原提呈构建仿生纳米药物递送系统增强抗胶质瘤效应
英文原题:Tumor–Antigen Activated Dendritic Cell Membrane-Coated Biomimetic Nanoparticles with Orchestrating Immune Responses Promote Therapeutic Efficacy against Glioma

通讯作者:王亚洲,重庆大学医学院;尹铁英,重庆大学生物工程学院
作者:Xiaoyue Ma(马晓悦), Lei Kuang(旷磊), Ying Yin(殷瑛), Lin Tang(唐淋), Yu Zhang(张渝), Qin Fan(樊沁), Bingyi Wang(王冰怡), Zhufeng Dong(董驻峰), Wei Wang(王威), Tieying Yin*(尹铁英), and Yazhou Wang*(王亚洲)
背景介绍
胶质瘤(Glioma)是中枢神经系统(Central Nervous System,CNS)常见恶性肿瘤,其预后差、复发高和死亡率高,目前临床治疗手段有限,胶质瘤病患中位生存期仅有15个月。血脑屏障(Blood Brain Barrier, BBB)和肿瘤微环境(Tumor microenvironment,TME)的免疫抑制是造成这一困境的主要原因。随着仿生纳米医学的快速发展,树突状细胞(Dendritic cell, DC)可以通过体外刺激使其活化成熟,从而调控T细胞活化,促进抗肿瘤免疫,基于此,构建活化成熟的DC细胞膜(aDCM)包覆修饰的仿生纳米载药平台,aDCM@PLGA/RAPA (Scheme1),该递送体系能够通过aDCM激活CD8+ T细胞,重塑胶质瘤肿瘤免疫微环境,增加NK细胞浸润比例,减少外周免疫器官中衰竭的T细胞,同时,联合抗肿瘤药物的递送,协同增强肿瘤杀伤效应,为个性化免疫治疗及靶向药物递送提供了新策略和潜在的简便高效的技术平台。

Scheme 1. Sequential process of aDCs and the synergistic effect of aDCM@PLGA/RAPA drug delivery nanoplatform, directly or indirectly to activate immunotherapy.
文章亮点
近日,重庆大学医学院王亚洲教授课题组报道了将DC在体外进行刺激活化,仿生设计与构建了一种肿瘤抗原活化成熟的DC膜(aDCM)修饰的纳米药物递送系统,该系统具有以下优势: 1) aDCM具有抗原递呈活性,可激活天然CD8+ T细胞直接杀伤肿瘤细胞和辅助免疫治疗,从而促进肿瘤免疫效应; 2) aDCM可以保留DC细胞相关膜蛋白的原位活性,实现非侵入式的BBB穿越,到达中枢神经系统; 3) DC可通过提呈的肿瘤抗原被同源肿瘤细胞进行识别摄取,增强体系主动靶向特性; 4) 该体系可改善肿瘤微环境,抑制和预防肿瘤复发或转移; 5) 免疫微环境激活协同药物靶向递送增强抗胶质瘤效应。
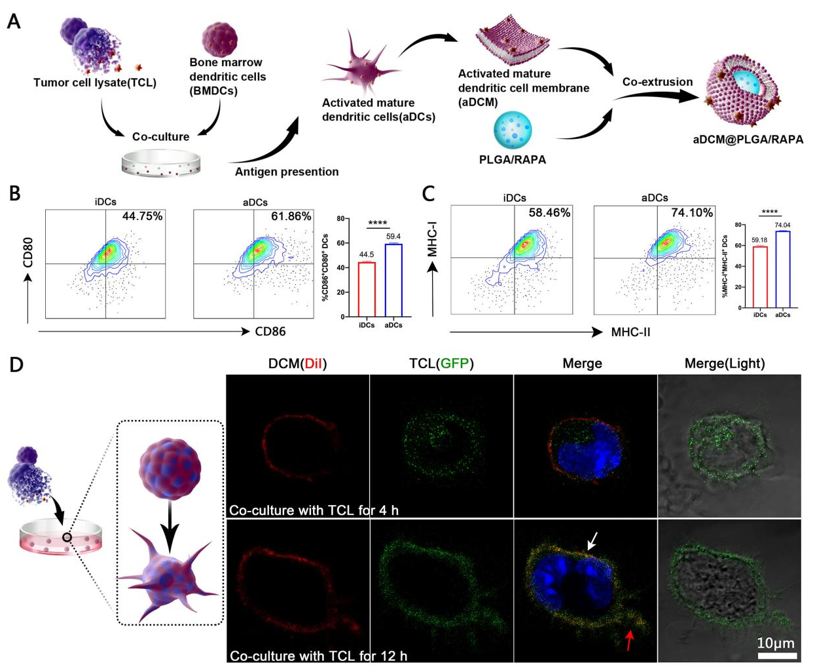
Figure 1. Characterization of DCs activation and aDCs membrane-coated PLGA/RAPA.
Figure 1中,将肿瘤细胞裂解蛋白(Tumor cell lysate, TCL)加入到DCs培养液中,刺激DCs进行抗原提呈得到活化成熟DCs(aDCs),通过流式细胞仪,以CD11c、MHC-II、CD80及CD86为标志物检测负载TCL后的成熟及分化程度, 同时通过激光共聚焦显微镜(Confocal laser scanning microscope,CLSM)直观表征了TCL体外激活DC的动态过程。
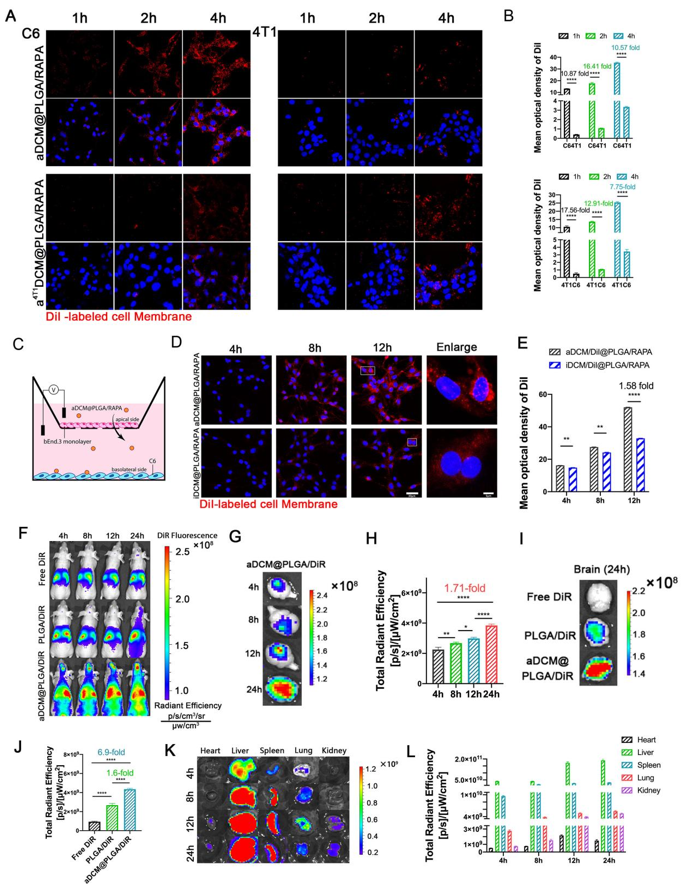
Figure 2. Cell homologous absorption and evaluation of blood-brain barrier.
Figure2中,通过体内外模型证明了aDCM@PLGA/RAPA可以透过BBB到达肿瘤部位,同时,细胞摄取结果结合体外透BBB结果进一步证明了同源肿瘤细胞裂解液活化成熟的aDCM@PLGA/RAPA更容易被此肿瘤细胞摄取,表现出aDCM@PLGA/RAPA的体外同源靶向性。
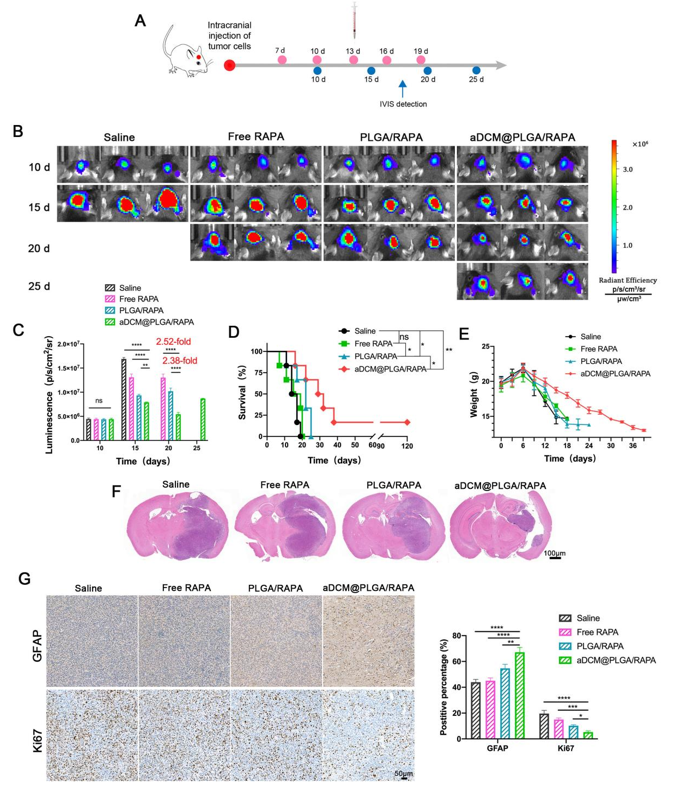
Figure 3. The anti-tumoral effects of aDCM@PLGA/RAPA in glioma-bearing mice.
Figure 3中,建立C6-Luc原位胶质瘤模型,通过观察C6-Luc生物发光强度变化,生存曲线,体重变化及免疫组化等方式探究了aDCM@PLGA/RAPA对原位胶质瘤模型的肿瘤抑制情况,如图所示,aDCM@PLGA/RAPA治疗后,小鼠肿瘤体积显著减小,生存期延长,肿瘤恶性程度及增值能力降低。
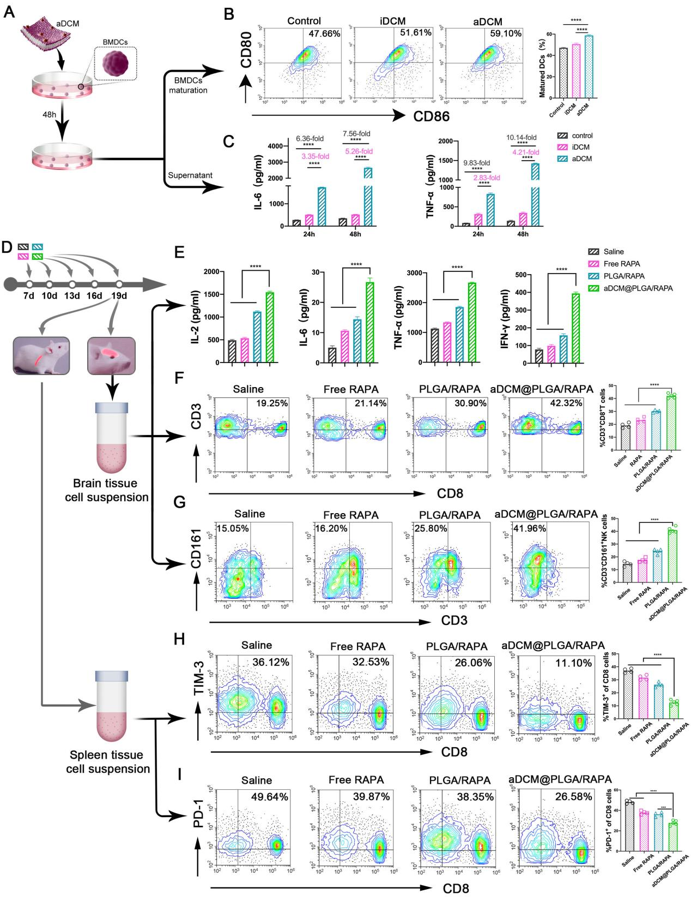
Figure 4. In vitro and in vivo immune cells activation by aDCM@PLGA/RAPA.
基于前述抗肿瘤效应实验结果,在Figure 4中,深入探讨了aDCM体内外间接激活免疫反应的评价,首先使用C6肿瘤细胞裂解液激活的aDCM与BMDCs共培养之后BMDCs成熟程度增加,同时分泌的免疫刺激细胞因子增加。进而在体内直接激活免疫反应实验表明:aDCM@PLGA/RAPA治疗组小鼠原位胶质瘤组织中浸润T细胞比例显著提高。同时,通过ELISA检测分泌的细胞因子,aDCM@PLGA/RAPA给药组明显高于其它治疗组,说明其能够一定程度上激活体内免疫反应,协同增强抗肿瘤效应。
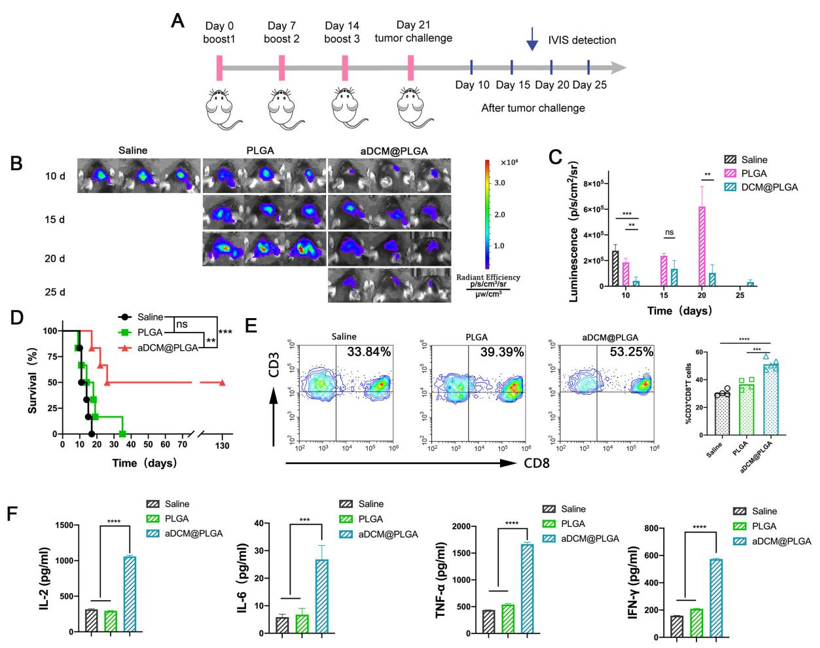
Figure 5. In vivo prophylactic efficiency of aDCM@PLGA.
基于aDCM良好的体内外免疫激活效应,在Figure. 5中,进一步分析探讨了aDCM@PLGA在预防肿瘤定植、生长的抑制效应。C6-Luc原位植入前第21、14和7天分别用Saline、PLGA、aDCM@PLGA进行干预处理,肿瘤浸润T细胞比例、细胞因子分泌以及C6-Luc生物发光强度变化,生存曲线等证明了aDCM@PLGA具有一定的个性化预防性癌症疫苗作用,从而使得其具有抑制胶质瘤术后复发的潜力。
总结/展望
本文报道了一种活化成熟DC膜包被的仿生纳米粒(aDCM@PLGA/RAPA)应用于原位胶质瘤模型的免疫微环境响应与重塑的药物递送。一方面,aDCM@PLGA/RAPA可以协助RAPA穿透血脑屏障在肿瘤微环境靶向积聚;另一方面,aDCM@PLGA/RAPA可以通过直接和间接两种方式激活T细胞。同时该研究为调节DC细胞的抗原提呈和开发针对多种肿瘤类型的个性化免疫治疗提供了一个简单有效的技术平台。
相关论文发表在ACS NANO上,论文通讯作者为重庆大学医学院王亚洲教授,论文第一作者为重庆大学生物工程学院硕士研究生生马晓悦;重庆大学生物工程学院尹铁英教授是论文的共同通讯作者。
通讯作者信息:

王亚洲 重庆大学医学院
王亚洲,中美联合培养博士,重庆大学医学院教授/博导,副院长;主要围绕组织微环境响应生物医用材料的仿生构建与生物学效应开展研究,并聚焦于中枢神经系统肿瘤免疫微环境响应药物递送,以及匹配损伤修复病理生理过程血管内支架构建等两个领域,近三年在ACS nano、Nano letters、Biomaterials、Bioactive materials、NPG asia materials、Journal of controlled release、Chemical engineering journal、Nanoscale等期刊上发表了一系列研究论文,在上述研究领域形成了较为鲜明的研究特色。

尹铁英 重庆大学生物工程学院
尹铁英,重庆大学生物工程学院副教授、博士、博士生导师;致力于在心血管生物力学、心血管植介入器械方面开展研究,重点关注血管损伤后功能恢复的机理研究以及血管植入物的仿生纳米功能涂层改性。现任中国生物材料学会材料生物力学分会委员及副秘书长、中国生物医学工程学会康复工程分会委员。
出版信息:

ACS Nano 2023, ASAP
Publication Date: January 23, 2023
https://doi.org/10.1021/acsnano.2c09033
Copyright © 2023 American Chemical Society
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!

































 京公网安备 11010802027423号
京公网安备 11010802027423号