ACS Cent. Sci. | 含氮立体中心的Tröger’s Base(特勒格碱)类似物的催化不对称合成
英文原题:Catalytic Asymmetric Synthesis of Tröger’s Base Analogues with Nitrogen Stereocenter

通讯作者:张俊良、郭浩、杨俊锋
作者:马纯、孙悦
背景介绍
近些年来,构建碳立体中心和杂原子立体中心已经得到广泛的发展,相比之下,氮立体中心的对映选择性合成却一直停滞不前。由于氮上的孤对电子在室温下可以自由翻转,快速发生消旋化,给氮手性的合成带来巨大挑战。而根据文献调研,氮手性的对映选择性合成策略通常采用季铵化(胺类N-氧化物、N-中心金属配位和N-中心季铵盐),除此之外,还有一种策略则是通过形成刚性叔胺骨架约束氮上孤对电子的翻转。而这些刚性的叔胺结构通常存在于许多生物碱、药物分子和手性路易斯碱催化剂中。在这些刚性手性叔胺化合物中,一个特别迷人的结构是Tröger’s Base。它有两个相互垂直的芳环,与中心的双环[3.3.1]骨架相融合,能够形成一个刚性的裂缝状V形支架,并且拥有两个氮的立体中心。Tröger’s Base在自组装研究、分子识别、DNA相互作用的探针以及有机合成中的路易斯碱催化剂等方面的应用而备受关注。然而,手性的Tröger’s Base很少被大量使用,这是因为它在酸性条件下构型不稳定,限制了其广泛应用。为此,人们通过修饰裂隙状支架以增加其稳定性,开发了各种具有刚性裂隙状骨架的Tröger’s Base类似物,其中大多数涉及多步合成或后期拆分。因此,设计合成出更加稳定的Tröger’s Base类似物,并且通过催化不对称合成来实现,已经成为一种挑战。
文章亮点
1
提供了一种简单的策略实现Tröger’s Base类似物的催化不对称合成
2
开发了有机小分子催化剂和手性金属催化剂的广泛应用
3
DFT计算揭示了对映选择性产生的根源
图文解读
首先,对市售的商业化配体(如双齿膦配体、氮磷配体以及单齿膦配体)进行考察。大多数商业配体(L1,L3-L8,L10-L11)未能促进这一反应的发生。尽管(R,R)-QuinoxP(L2)和(S,S)-PHOX(L9)可以达到中等至良好的对映选择性,但反应性很差。相反(R)-MOP(L12)能很好地促进反应,但对映选择性几乎没有。这些结果表明,配体的选择对于反应的活性和选择性至关重要。最近,张俊良课题组开发的Sadphos在金属催化的偶联反应中表现出优异的性能,于是接下来研究了Sadphos在该反应中的表现。在Sadphos的基本版本中,只有PC-Phos(PC1,PC2)在对映选择性控制方面取得了优异的结果,尽管收率很低。值得注意的是,如果PC2的氮上用甲基保护(PC3),对映选择性就会急剧下降。考虑到这一结果,随后对不同的R2基团(PC4-PC10)进行了研究,只有PC10作为配体时,该反应以31%的产率和96% ee获得目标产物。在大多数情况下,检测到副产物3a,这可能是在还原消除之前的β-氢消除或氧化加成之后的发生HAT产生的。当使用CsOAc时,检测到大量的副产物4a,它是通过相邻的sp2 C-H芳基化产生。这时想到,在筛选(R)-MOP配体的过程中,用更富电子的二环己基膦代替二苯基膦可以提升产率。鉴于这一结果,于是尝试了更富电子的GF-Phos,正如预期的一样,获得了更好的结果。通过微调其他条件,如溶剂、反应温度和催化剂负载量等,可以进一步提高产率。最后,在最佳的反应条件下,以良好的产率(80%)和高对映选择性(96% ee)得到了目标产物2a。
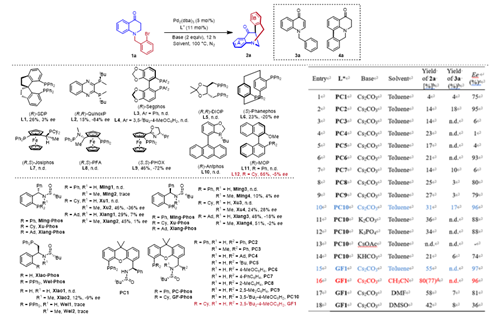
图1. 条件优化
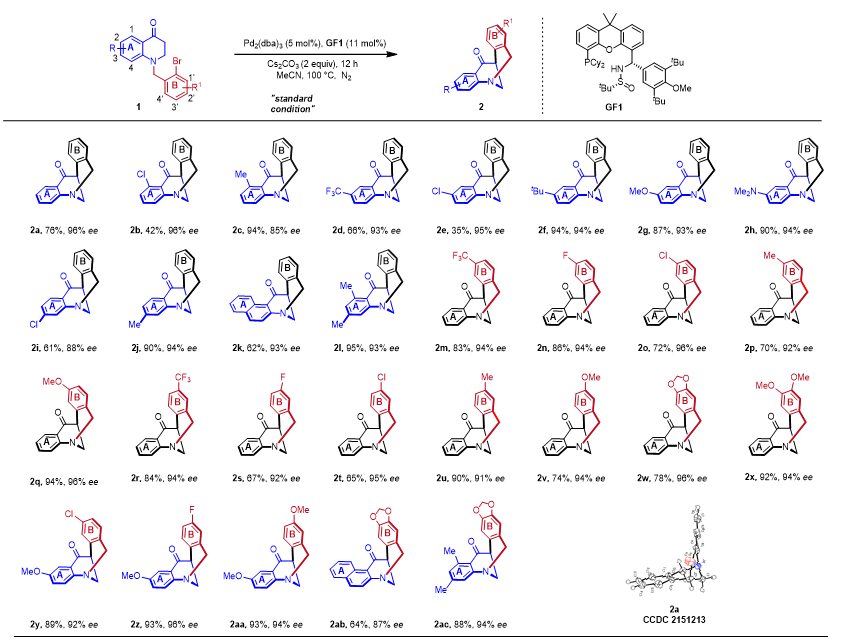
图2. 底物拓展.
有了最佳的反应条件在手,于是对N-苄基取代的二氢喹啉酮衍生物1的底物范围进行了研究。多种带有不同R/R1基团的N-苄基取代的二氢喹啉酮衍生物1可以有效地进行分子内芳基化反应,生成结构多样的含有氮手性的八元氮桥[3.3.1]环状产物2,其产率为中等至良好,且具有较高的对映选择性(35%~95%,85%~96% ee)。具体来说,我们研究了A和B的芳环上的一系列取代基,无论是吸电子还是给电子的取代基都可以很好地兼容。在底物拓展过程中发现苯环上的立体位阻对反应很敏感。因此,底物中4,1'-或4'-位存在取代基时,结果不太理想。
为了显示该反应的实用性,进行了克级规模制备和产物衍生,合成了一系列手性保持的刚性八元氮桥[3.3.1]环状衍生物。接着还做了竞争性实验和非线性效应,竞争性实验的结果表明吸电子基团是有利该反应的发生,非线性实验的结果表明单分子手性配体控制反应的立体化学。
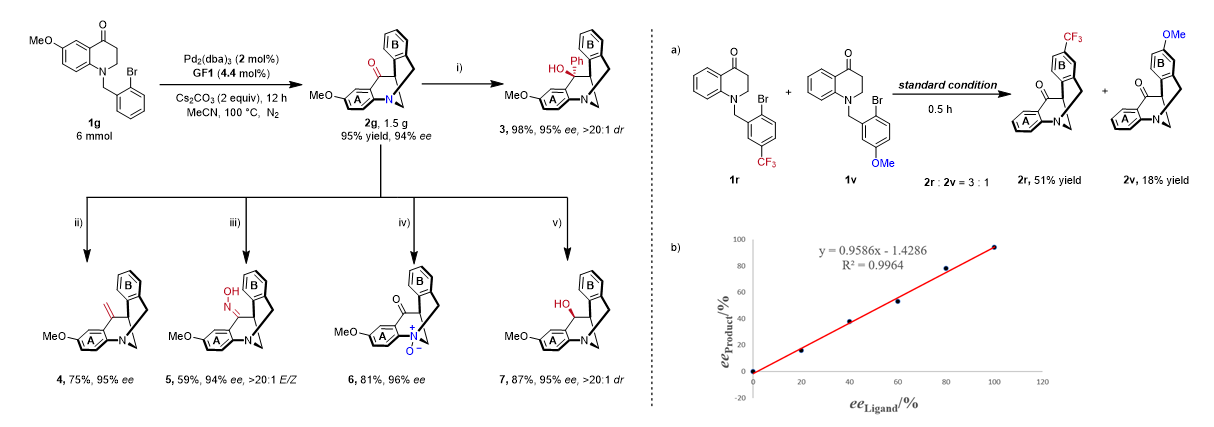
图3. 克级规模反应、产物衍生化、竞争性实验与非线性效应
为了进一步说明产物的有用性,将产物转化成手性有机催化剂和手性金属金属络合物,将产物简单转化便可合成手性季铵盐和手性金属铱和钯络合物,利用季铵盐作为相转移催化剂,实现乙氧基保护的联萘酚的催化动力学拆分,利用手性金属铱络合物催化实现2-甲基吡咯与消旋二级醇的借氢串联反应,利用手性金属钯络合物催化实现硼酸了对亚胺的1,2-加成反应,尽管结果不是很理想,但这足以说明这些催化剂在催化不对称转化中展示出的巨大潜力。
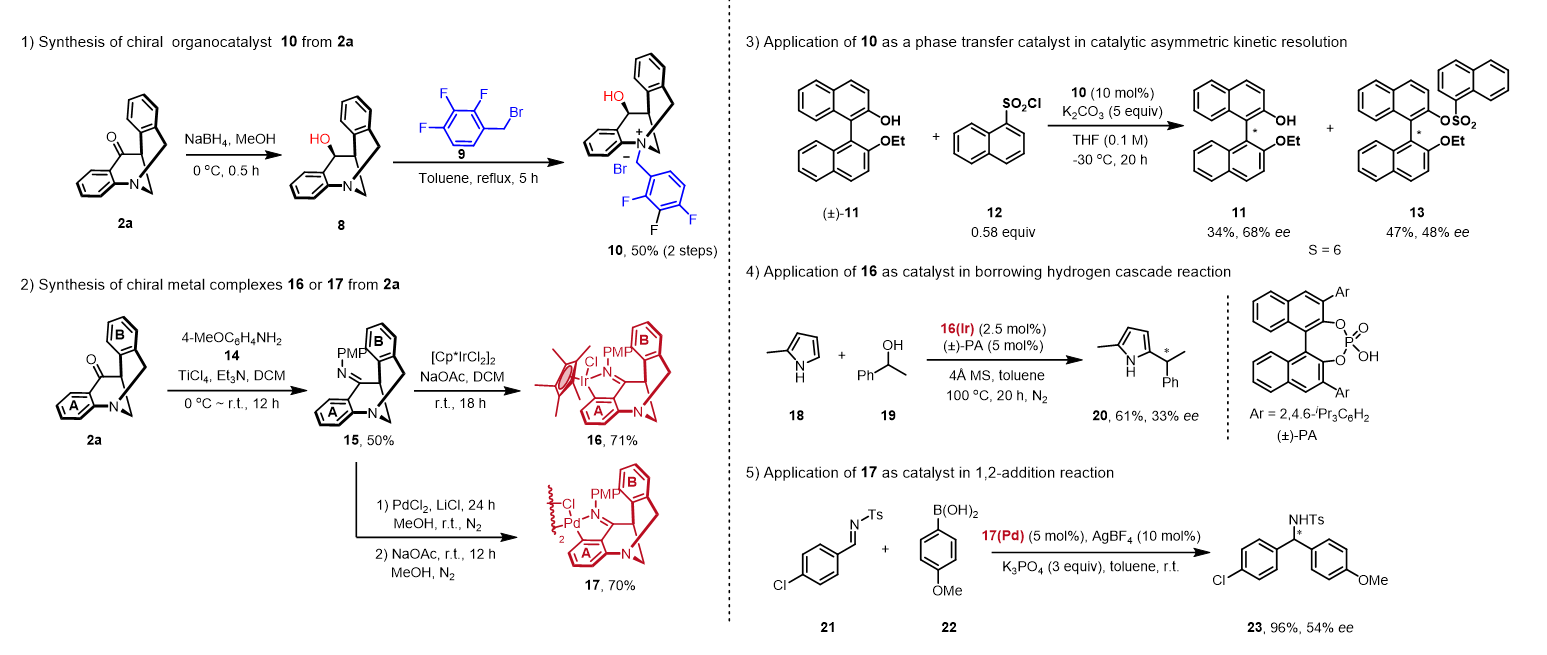
图4. 产物衍生和应用
为了阐明配体在控制对映选择性方面的作用,还对C-C还原消除进行了DFT计算。计算结果显示,两个过渡态的活化能相差2.0 kcal/mol,有利于(S,S)-构型产物的生成,这与实验结果一致。对计算出的还原消除过渡态结构的进一步研究表明,底物片段的羰基中的氧原子与配体中的NH基团之间存在NH···O氢键。除了氢键,通过独立梯度模型(IGM)也观察到底物C-H与配体芳环之间的弱相互作用,在上述底物C-H键和芳环片段之间显示出蓝绿色的等值面,表明有吸引力的相互作用。为了进一步验证DFT计算的结果,进行了一些简单的控制实验。当在反应中加入3当量的甲醇时(已知甲醇会干扰氢键),所得产物的对映选择性则会发生下降(96%~82% ee),而当加入5当量的甲醇时,产物的对映选择性则会进一步发生下降(96%~76% ee)。其次,当使用甲基掩盖配体上的氮原子时,观察到产物的对映选择性发生急剧的下降(96%~<5% ee)。这些实验说明配体与底物之间的氢键在控制对映选择性中起到了关键作用。
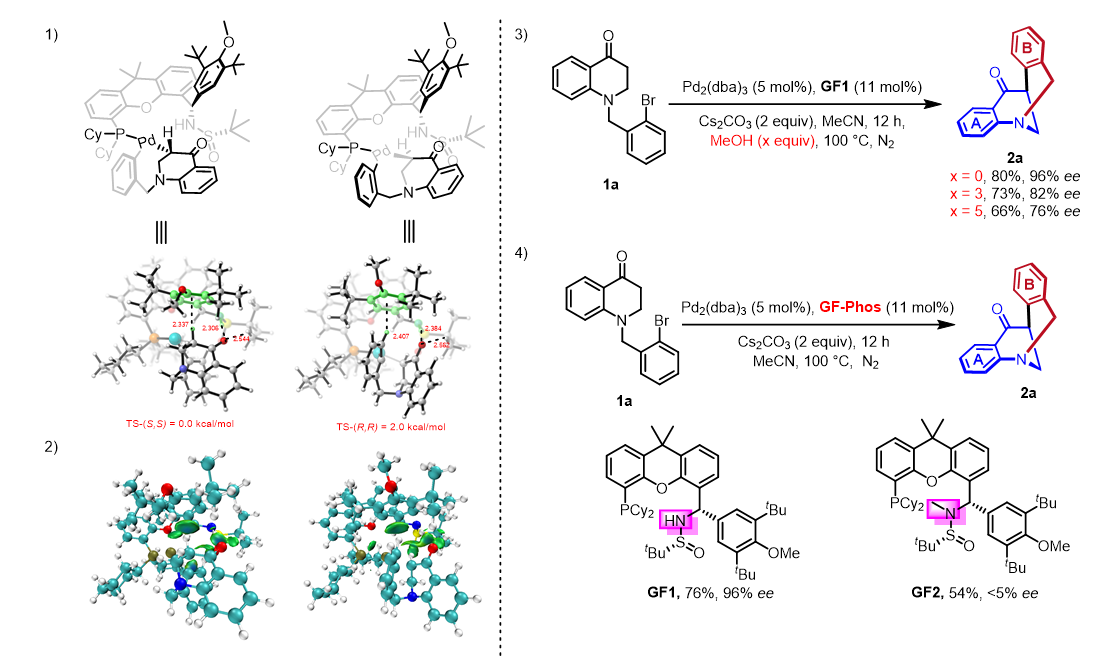
图5. DFT计算和验证实验
总结与展望
作者开发了一种高效的方法,利用钯/GF-Phos催化分子内羰基α位的芳基化反应,高产率、高选择性地实现了带有氮立体中心Tröger’s base类似物的催化不对称合成,并且该骨架具有高度稳定性。通过简单的产物转化可进一步发展成一类新的手性有机催化剂和手性过渡金属络合物,并且在催化反应中证明了其存在的巨大潜力。通过DFT计算表明,底物与配体之间的NH···O氢键和弱相互作用是造成高对映选择性的原因,而该独特的手性刚性骨架分子有望在分子识别和材料科学中的得到进一步应用。
相关论文发表在ACS Central Science上,复旦大学博士生马纯为第一作者,张俊良教授、郭浩教授和杨俊锋青年研究员为通讯作者。
通讯作者信息
复旦大学张俊良课题组主要致力于烯炔与小环化学,不对称催化和新催化剂的设计与开发等方面的研究。张俊良教授于天津大学和中科院上海有机所获得学士学位(1997年)与博士学位(2002年)。分别于2003年和2005年在德国科隆大学化学系和美国芝加哥大学化学系从事博士后研究。2006-2017年于华东师范大学担任教授、博士生导师,2017年加入复旦大学担任教授、博士生导师。已经在Chem, Nat. Commun.,J. Am. Chem. Soc., Angew. Chem. Int. Ed. 等国际知名杂志上发表文章100余篇,其课题组发展的Sadphos家族配体已经成为一类商业化的配体,也已在多个课题组取得丰硕的成果。
扫描二维码免费下载全文

ACS Cent. Sci. 2023, ASAP
Publication Date: January 4, 2023
https://doi.org/10.1021/acscentsci.2c01121
Copyright© 2023 American Chemical Society

ACS Central Science是ACS最具包容性的交叉学科期刊,发表以化学为中心的多学科领域最前沿,最重要的研究成果。旨在为全球学者提供交流平台,文章即时发表,全球免费获取,作者也无需付费。

点击“阅读原文”
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号