普渡大学黄蓉团队报道α-N-末端甲基转移酶NTMT1的体内活性小分子抑制剂
蛋白质甲基转移酶是调节蛋白质甲基化水平的主要酶类,对许多生物过程至关重要,包括基因转录、DNA 修复、信号转导和 RNA 代谢。扰乱蛋白质甲基转移酶的活性与癌症、代谢、炎症和神经退行性疾病有关。因此,蛋白质甲基转移酶被视为一类新型治疗靶点。
蛋白质α-N-末端甲基转移酶1 (NTMT1) 主要甲基化具有典型X-P-K/R(X 代表 D/E 以外的任何氨基酸)氮端序列的蛋白质。NTMT2也识别相似的多肽序列,但它主要在心脏和肌肉组织中表达。研究表明 NTMT1 与调节有丝分裂、DNA 损伤修复、神经发生和干细胞维持有关联。降低NTMT1水平能抑制细胞和动物模型中宫颈癌的增殖和迁移。此外,NTMT1 也是神经母细胞瘤的致癌基因,降低其水平可抑制肿瘤生长并增加对顺铂治疗的敏感性。最新研究发现NTMT1 在干细胞调节中发挥了重要作用。在小鼠中敲除 NTMT1 会导致过早衰老。C2C12 小鼠成肌细胞中 NTMT1 的缺失导致成骨标记物的表达。然而,NTMT1 调控的详细机制和途径尚未完全了解。因此,高细胞活性和特异性抑制剂对于探索 NTMT1/2 的生理和药理功能具有重要的意义。
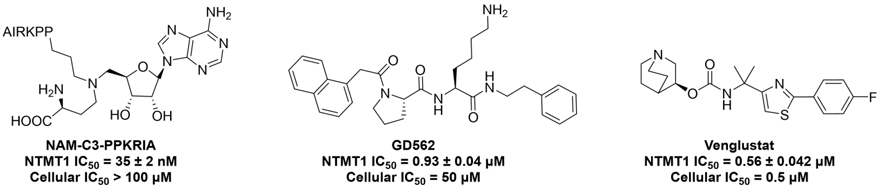
图1. 已经报道NTMT1抑制剂结构。
截止目前,已有多种NTMT1/2 抑制剂被报道(图1)。其中,双底物抑制剂在 140 pM 时选择性抑制NTMT1,但不能通过细胞膜。与双底物抑制剂相比,NTMT1/2拟肽抑制剂抑也仅表现出微摩尔级别的细胞活性。最近,普渡大学黄蓉(点击查看介绍)课题组报道了首个具有细胞活性的NTMT1小分子抑制剂 venglustat(J. Med. Chem., 2022, 65, 12334–12345, 点击阅读详细)。在此基础上,该课题组在本工作中对venglustat进行了系统性的构-效关系 (SAR) 研究,最终发现了活性和选择性都明显提高的阳性类似物GD433 (IC50 = 27 ± 1.1 nM),以及没有活性的阴性类似物YD2160 (IC50 > 100 μM)。GD433不仅在生物化学、生物物理和细胞学试验中显示出比先导化合物venglustat更高的活性和选择性。GD433还具有良好的口服生物利用度,可作为一种体内化学探针来研究NTMT1甲基化的药理学作用。因此,这一对阳性(GD433)及阴性(YD2160)化合物将是研究NTMT1生物学功能的重要工具。
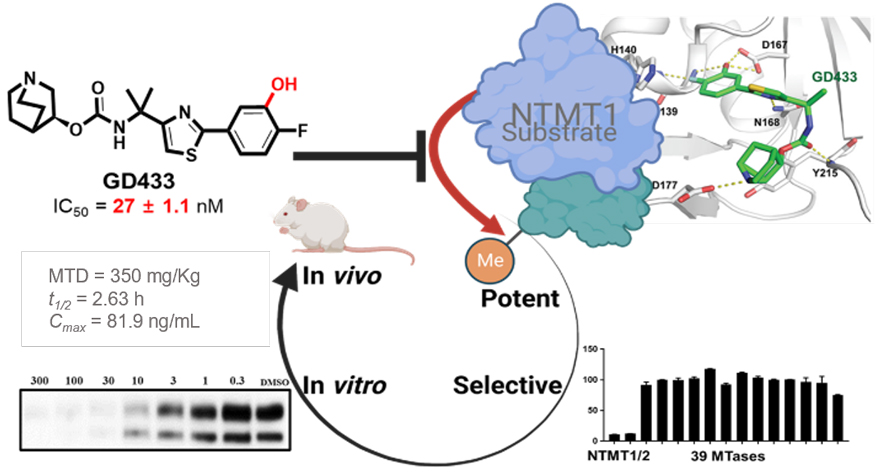
图2. 代表性抑制剂的化学及晶体结构及其抑制活性与选择性。
这一成果近期发表在Journal of Medicinal Chemistry 上。文章的第一作者是邓友超博士,于2019年加入普渡大学黄蓉课题组进行博士后研究,主要研究α-N-末端甲基及乙酰基转移酶的抑制剂。他博士毕业于中南大学湘雅国际转化医学联合研究院,师从段燕文、沈奔和黄勇课题组,主要研究方向是利用合成生物学、有机及计算化学开发天然产物及小分子药物。截止目前,邓友超博士以第一作者身份在JMC 杂志上已经连续发表五篇研究性论文。

黄蓉课题组合影(2022年11月)
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Structure–Activity Relationship Studies of Venglustat on NTMT1 Inhibition
Youchao Deng, Guangping Dong, Ying Meng, Nicholas Noinaj, and Rong Huang*
J. Med. Chem., 2023, 66, 1601–1615, DOI: 10.1021/acs.jmedchem.2c01854
黄蓉博士简介

黄蓉副教授在同济医科大学药学院获得药学学士和硕士学位(导师朱景申教授)。在同济大学医科大学药学院任教两年后,于 2001年来到普渡大学攻读药物化学博士学位,导师是Richard F. Borch教授。她主要研究酪氨酸磷酸类似物前药的设计、合成和评估,用以破坏 SH2 结构域介导的蛋白质-蛋白质相互作用。博士毕业后,她加入约翰霍普金斯大学Philip A. Cole 教授组进行博士后研究表观遗传学生物化学,在那里她开发了一种将乙酰赖氨酸模拟物定点引入蛋白质的方法,并参于组蛋白去甲基化酶学及抑制剂的研究。2011年,她加入弗吉尼亚联邦大学药物化学系,担任助理教授。2017 年,她作为终身副教授返回普渡大学,继续应用跨学科方法来研究甲基转移酶和乙酰转移酶的分子机制,设计合成抑制剂用来操纵表观遗传途径,并开发相关新药。
https://www.x-mol.com/university/faculty/315205
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号