厦门大学霍浩华课题组:氯自由基介导的高位点选择性不对称C(sp³)-H酰基化
含手性α位取代基的饱和氮杂环骨架是药物、天然产物、手性催化剂中常见的结构单元。控制此类结构的α位手性中心非常重要,因为它直接影响着相应生命活性分子的生理活性,或手性催化剂的不对称诱导能力。直接的催化不对称C-H官能团化是构建此类结构最直接高效的手段之一。然而,不对称sp3 C-H官能团化反应依然是合成化学领域公认的合成难点,面临诸多的化学选择性、位点选择性和对映选择性问题。饱和氮杂化的直接对映选择性α C-H酰基化反应未见报道(图1)。
近日,厦门大学霍浩华教授(点击查看介绍)课题组运用他们前期建立的卤素自由基介导的不对称HAT催化策略(JACS, 2022, 144, 8797; JACS, 2020, 142, 19058; Nat. Commun. 2021, 12, 3536; ACS Catal. 2021, 11, 13567),证明了可见光催化裂解的氯自由基可以实现动力学控制的C-H攫取,高位点选择性活化相对惰性的氮杂环α-C(sp3)-H键,而更为活泼的其他不同类型α-C(sp3)-H键得以保留(例如苄位和开链杂原子α位C-H键),生成的碳自由基可以高效被手性镍催化剂捕获,进而与一系列结构多样的、商品化的平台合成砌块有机羧酸发生不对称交叉偶联反应,高对映选择性生成重要的手性α氨基酮。
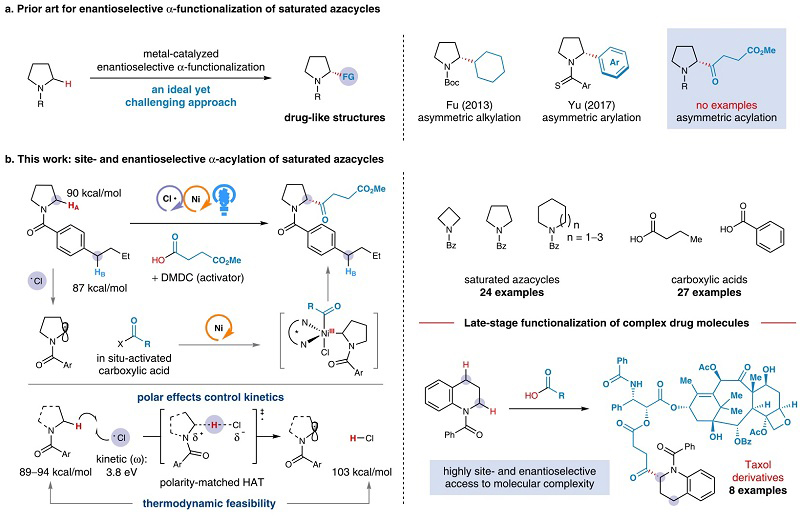
图1. 反应设计
该工作选用含活泼苄位的N-酰基吡咯烷作为竞争性C-H底物,通过羧酸原位活化的策略形成酰基化亲电试剂,通过大量条件筛选,最终确定使用1 mol% Ir[dF(CF3)ppy]2(dtbbpy)PF6作为光催化剂, 10 mol% NiCl2•glyme和13 mol%手性配体(S,R)-L1作为催化剂,1.5 equiv 2,6-lutidine作为碱,PhH(0.1 M)为溶剂,在20 ℃及蓝光照射条件下,反应24小时,以69%的产率,95%的对映选择性获得目标化合物,且3a/3b高达28/1(表1)。有意思的是,溴自由基相关的反应条件会显著降低反应产率和位点选择性。氯自由基相比溴自由基介导的反应具有更出色的选择性,可能的主要原因是:1)热力学上,氯自由基比溴自由基有更强的攫氢能力;2)动力学上,受极性匹配效应影响,具有更强亲电性的氯自由基更容易攫取氨基α位sp3 C-H;3)底物构象方面,旋转受阻的叔酰胺键使超共轭效应更为显著,α位sp3 C-H更加富电性(hydridic)。另外,其他控制实验表明反应体系的高位点选择性不受配体、碱和溶剂的影响。
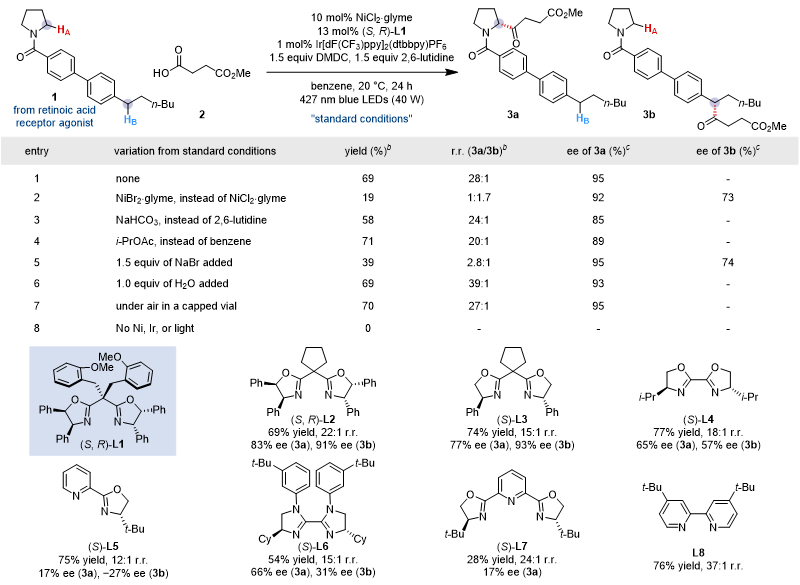
表1. 反应条件优化
随后,为进一步探索该高位点选择性C-H键不对称酰基化反应的普适性,在多种相对更为活泼C-H键(例如苄位、开链杂原子α位C-H键、烯丙位等)存在下,均可以高位点选择性实现更为惰性的氮杂环α-C-H键不对称酰基化反应,高对映选择性生成重要的手性α氨基酮(图2上)。此外,分子间竞争性实验表面,此体系兼容一系列对HAT敏感的α-sp3 C-H键和其他类型的亲电试剂(图2下),进一步证明此方法出色的化学、位点和对映选择性。
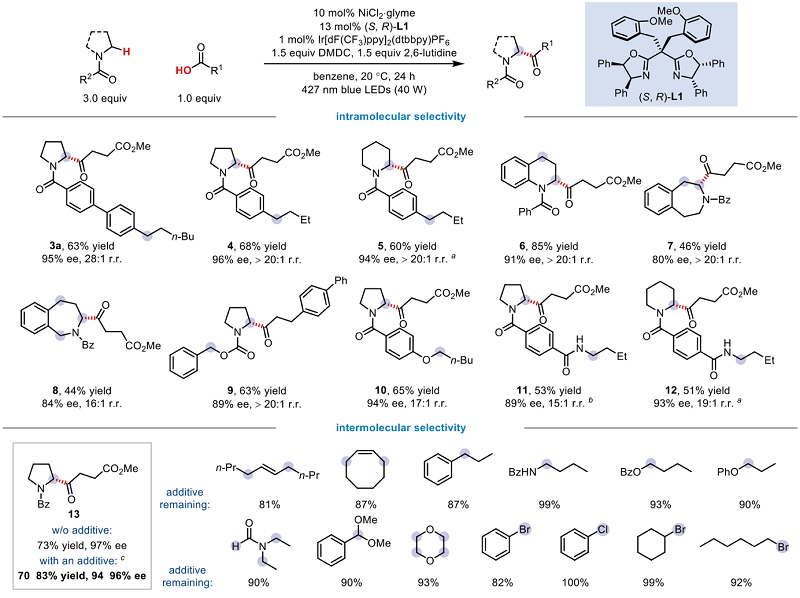
图2. 高位点选择性底物的拓展
接着,作者考察了普通底物的适用范围,发现多种环状胺类化合物(4-8元环)和各种官能团化的羧酸均可以很好应用于该不对称酰基化反应,高对映选择性生成手性α氨基酮。同时,也对一些复杂生命活性分子和药物分子进行直接修饰,发现这些分子都可以兼容在该反应体系,充分展示此方法的良好底物普适性和出色的官能团兼容性(图3)。
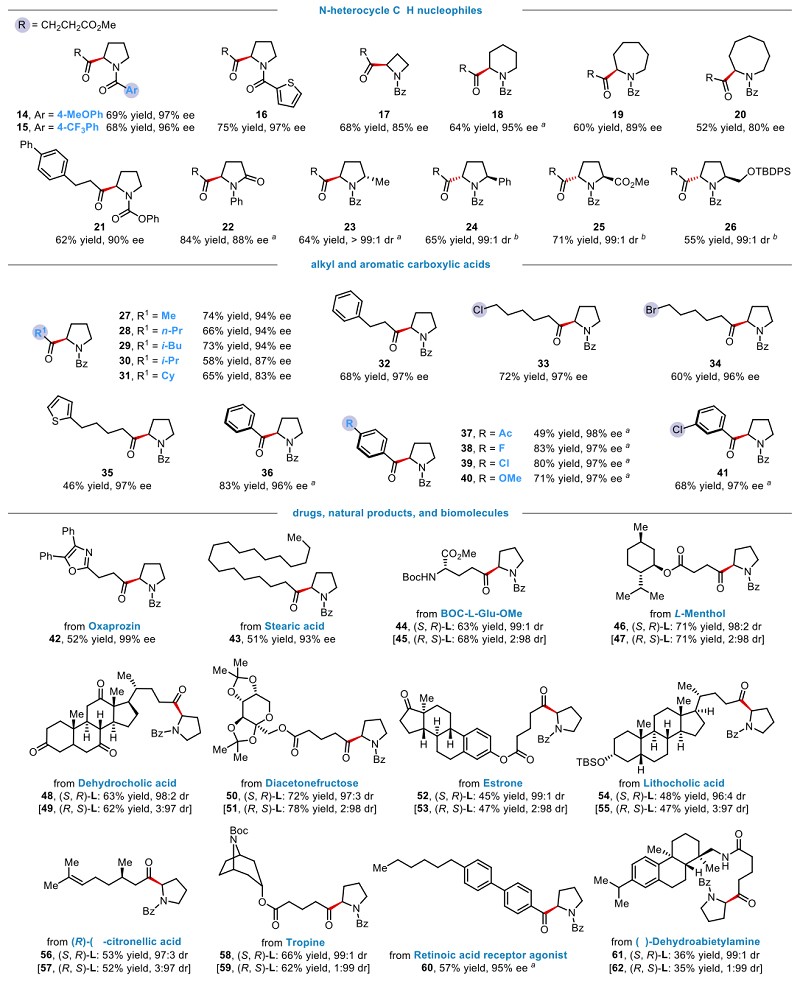
图3. 底物拓展
特别值得指出的是,作者通过此方法高效地合成了一系列复杂药物分子紫杉醇衍生物,展示出从现有药物化学库中发现候选药物的潜力。此外,该类转化可以在不借助特殊反应装置和光源的前提下,简单地放大40倍,成功的实现克级合成,产率、位点选择性及对映选择性均不会降低。并且该方法展示出不同寻常的实用性,首先通过氯自由基介导的不对称催化策略,实现相对惰性的氮杂环α-C-H高对映选择性转化,再组合该课题组前期发展的溴自由基介导的不对称催化策略,从而实现其活泼苄位的迭代官能团化—不对称芳基化与酰基化反应(图4)。
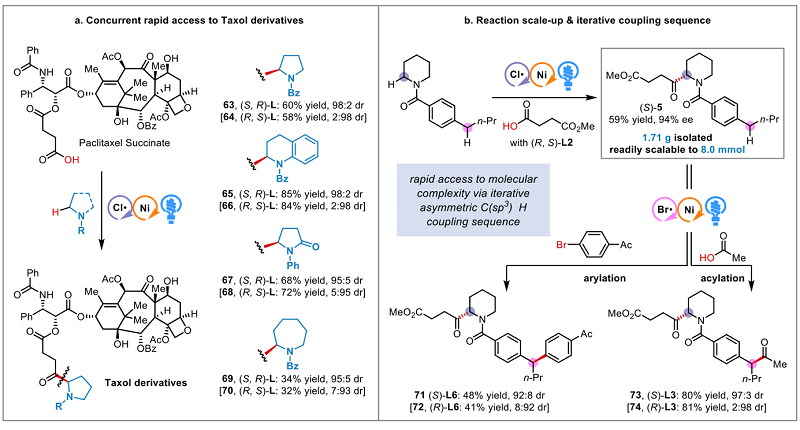
图4. 合成应用
作者通过系列反应机理实验,进而提出了以下可能的反应机理(图5)。为此反应体系的高化学选择性、位点选择性和对映选择性的协同调控提出了合理解析。
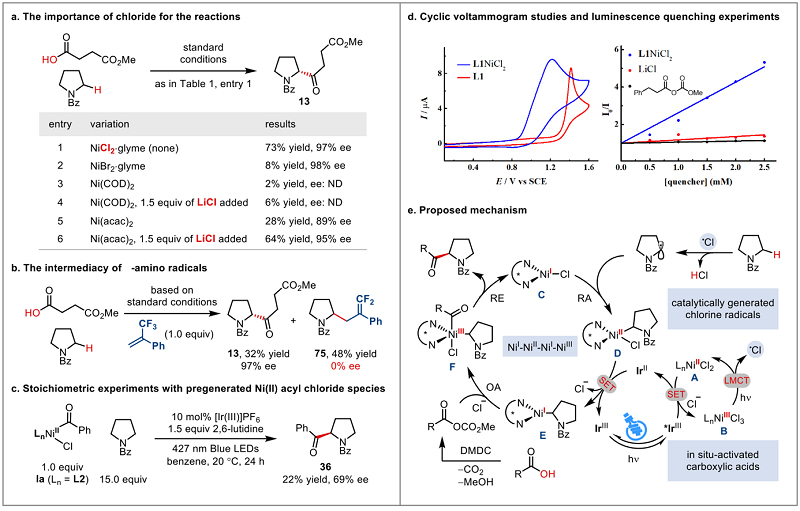
图5. 反应的机理研究。
综上所述,霍浩华课题组证明了可见光催化裂解的氯自由基可以进行动力学控制的C-H攫取,在多种相对更为活泼C-H键存在下,可以高位点选择性实现氮杂环α-C-H键不对称酰基化反应。此方法呈现出非常出色的官能团兼容性,适用于克级规模合成。特别值得指出的是,它为复杂药物分子紫杉醇系列衍生物的快速不对称合成提供了一种便捷的合成途径。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Site- and enantioselective cross-coupling of saturated N-heterocycles with carboxylic acids by cooperative Ni/photoredox catalysis
Xiaomin Shu, De Zhong, Qian Huang, Leitao Huan & Haohua Huo
Nat. Commun., 2023, 14, 125, DOI: 10.1038/s41467-023-35800-0
导师介绍
霍浩华
https://www.x-mol.com/university/faculty/243294
课题组网站链接
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号