这篇全合成,登上Science封面
副标题:通过立体特异性捕获张力环联烯实现lissodendoric acid A全合成
化学家经常使用张力中间体(strained intermediate)来驱动反应发生。早在上世纪50年代,化学家就证实了张力环炔——苯炔(1)和环己炔(2)的存在(图1A)。尽管这些原位生成的中间体张力能高(约40至50 kcal/mol)且寿命短,但科学家已经成功地将其应用于一系列化学转化和生物学应用。例如,芳香族和非芳香族环炔参与合成配体(如XPhos)、药物、农用化学品、新材料等,以及环辛炔(3)和其它张力中间体应用于获得了2022年诺贝尔化学奖的“生物正交化学”。环联烯(cyclic allene)也是一类张力分子,如于1964年和1966年被相继验证的1,2-环己二烯(4)。此后数十年来,尽管也有一些研究与应用,不过相比于前面提到的张力环炔,环联烯受到的关注却很少。
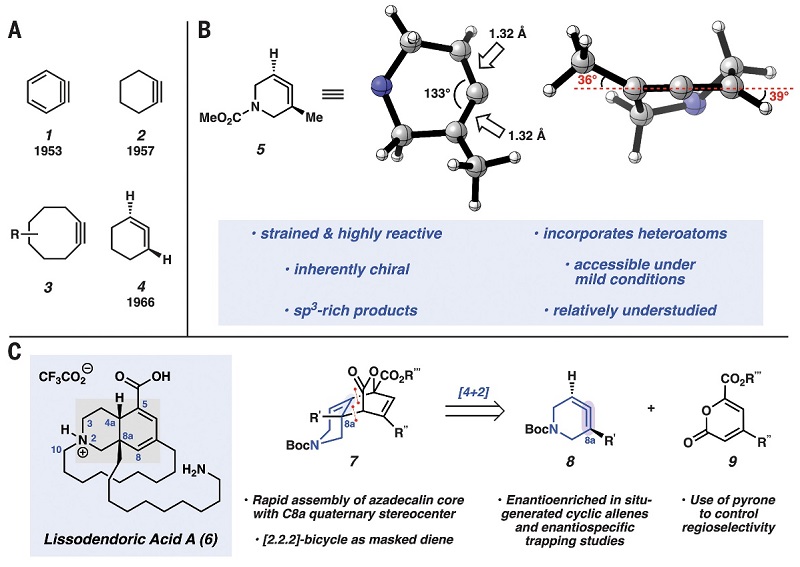
图1. 环张力中间体和当前研究概述。图片来源:Science
如图1C所示,lissodendoric acid A(6)是manzamine生物碱家族中一种结构复杂的成员,由Stonik小组于2017年从海绵Lissodendoryx florida 中分离提取出来,具有治疗帕金森病和类似疾病的功能。从结构上来看,其核心骨架是含有共轭二烯、羧酸取代基和两个立体中心的azadecalin以及位于C8a氨基癸烷取代基下的一个14元大环。然而,迄今为止尚未报道过lissodendoric acid A的全合成。近期,美国加州大学洛杉矶分校(UCLA)的Neil K. Garg教授(点击查看介绍)课题组研究了氮杂环联烯(5),该分子因其特殊的结构而展现出吸引人的化学性质(图1B),例如:1)环张力带来的高反应性;2)可进行环加成、亲核加成或金属催化反应;3)可在一次转化中形成两个化学键,最多引入三个C(sp3)立体中心。此外,环联烯还具有轴手性,可作为非常规但有价值的立体选择性合成的砌块。在此基础上,作者设想能否通过氮杂环联烯(8)和2-吡喃酮(9)的[4+2]环加成反应来同时引入azadecalin骨架和C8a季碳立体中心(比如[2.2.2]-双环产物7),[2.2.2]-双环产物可作为掩蔽的1,3-二烯,这对于lissodendoric acid A的全合成来说相当重要。近日,他们在Science 上发表了封面文章,报道了最新的进展。他们发展了张力环联烯中间体的区域选择性、非对映选择性和立体特异性捕获反应,并基于此关键反应快速组装azadecalin骨架,以12步实现了lissodendoric acid A 的全合成(总收率:0.8%)。该项成果表明环联烯可以作为用途广泛的砌块用于复杂分子的合成。

当期封面。图片来源:Science
首先,作者对环联烯8的前体(12)和富电子呋喃(11)或缺电子吡喃酮(13)之间的[4+2]环加成反应进行了研究,结果显示呋喃(11)和环联烯前体12进行反应时获得了期望之外的区域异构体10(图2A),而吡喃酮(13)和12进行反应时却获得了立体化学保持且具有所需的连接性和必要的C8a季碳立体中心的环加成产物14。值得一提的是,该反应具有endo-选择性,这与1,2-环己二烯的理论研究相一致,而且还可以通过改变捕获试剂来调节环联烯在[4+2]环加成反应中的区域选择性。然而,要想获得手性纯的前体12需要使用手性分离技术,因此作者对其它环联烯前体(16和18)的反应性进行了研究,结果显示16与呋喃11或吡喃酮13反应时均可获得环加成产物15或17(图2B),但立体化学较差,而18与呋喃11或吡喃酮13反应时则以中等的产率和立体选择性得到环加成产物10或14(图2C)。总而言之,环联烯具有以下关键特征:1)反应条件温和;2)高endo-非对映选择性形成两个C-C键;3)获得含有三个立体中心的复杂杂环产物,其中含有一个季碳立体中心。
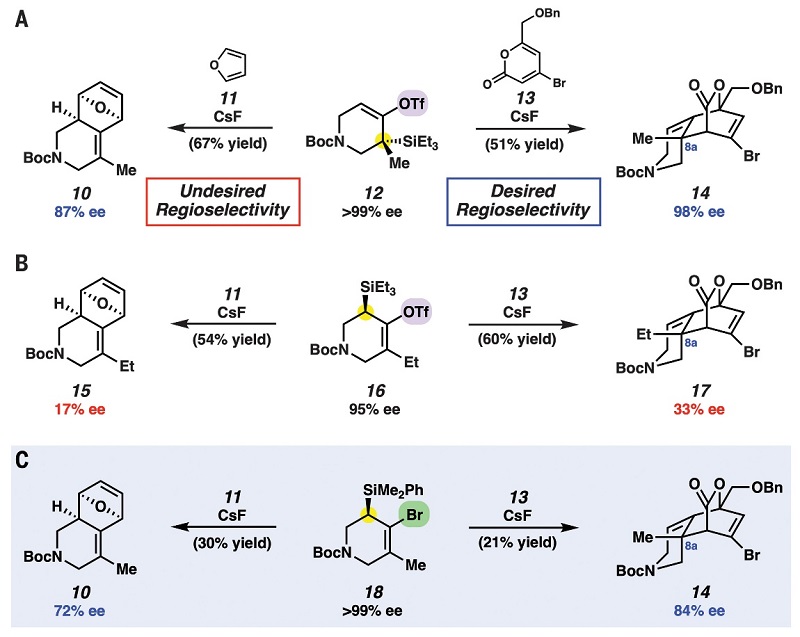
图2. 环联烯前体的[4+2]区域和立体选择性的环加成。图片来源:Science
随后,作者尝试使用更复杂的底物(22和27)进行类似反应,从而实现lissodendoric acid A(6)的全合成。具体而言,从市售的羧酸19出发,经对甲苯磺酰基化、酯基保护以及Negishi偶联三步获得吡喃酮22(图3A)。另一方面,市售的溴代三氟甲磺酸酯23与烷基锆试剂24经1,4-加成和三氟甲磺酸酯的离去获得酮25,再经Corey-Bakshi-Shibata(CBS)还原和氯甲酸乙酯保护两步获得中间体26,最后与甲硅烷基铜锂试剂进行反应便可获得环联烯前体27(图3B)。接着,作者评估了吡喃酮22和环联烯前体27的关键[4+2]环加成反应(图3C),结果显示在-20 ℃进行反应时可以73%的分离收率获得产物28,同时还需使用Bu4NBr来提高氟离子在溶液中的溶解度。需要指出的是,该过程的区域选择性同时取决于环联烯和吡喃酮:1)环联烯中的任何一个烯烃单元均可被捕获,但由于环加成反应中逆电子需求性质,更富电子的取代烯烃单元与缺电子吡喃酮发生反应;2)吡喃酮(22)中的二烯与环联烯对齐以促进C8a和C8之间成键,并且与二烯共轭的吡喃酮羰基的电子效应导致了这种选择性。其次,该反应的立体选择性同样值得注意,即该反应以endo-方式进行,二烯和环联烯的非反应性烯烃单元之间有良好的轨道重叠,并且与C8a烷基取代基相对的吡喃酮有良好的距离,进而使得28具有优异的非对映选择性(>20:1 dr)。此外,绝对立体化学和光学产率也值得特别注意,即环联烯前体27具有单个立体中心,而在生成环联烯中间体时27中的中心手性传递到环联烯中间体的轴手性,然后环加成后再次引入中心手性,生成两个三级立体中心和C8a季碳立体中心。另一方面,在-20 ℃进行反应时立体化学保留,这表明两种高度取代反应物之间的张力驱动环加成反应在低温下有利于张力环联烯的对映体互变(相关环联烯对映体互变的能垒约为14 kcal/mol)。

图3. 使用张力环联烯合成lissodendoric acid A的azadecalin骨架。图片来源:Science
最后,作者以28为关键砌块来实现lissodendoric acid A(6)的全合成。具体而言,先利用重铬酸吡啶盐 (PDC)/t -BuOOH氧化C3位,然后用氢化铜处理生成的α,β-不饱和内酰胺中间体来实现非对映选择性1,4-还原并获得cis-azadecalin 29,再经CO2释放、Boc脱除以及哌啶氮与丙烯酰氯的酰胺化三步获得四烯30,接着通过烯烃复分解反应获得大环砌块31,最后选择性地还原α,β-不饱和酰亚胺、脱保护便可完成lissodendoric acid A(6)的简明全合成(总共12步,总产率:0.8%),并通过圆二色光谱证实了lissodendoric acid A(6)的绝对立体化学结构。
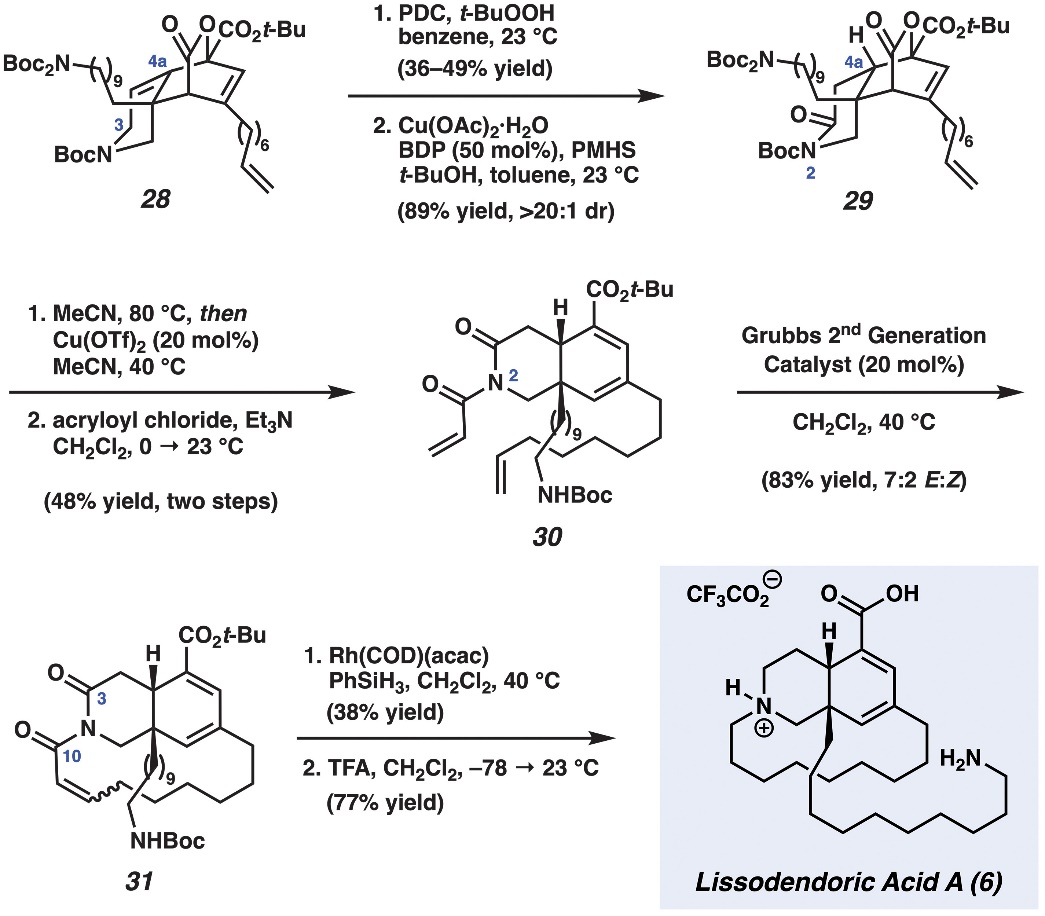
图4. lissodendoric acid A (6) 全合成的完成。图片来源:Science
总结
Neil Garg教授课题组利用被长期忽视的环联烯为关键砌块,通过立体特异性捕获张力环联烯成功地实现了生物碱lissodendoric acid A的全合成。该项成果表明环联烯可以作为有效的合成砌块用于构建复杂的分子。此外,由于关于张力环联烯的研究并不多,关于其合成应用的反应性和选择性的研究还存在很多机会,也许能给大家带来一些新的思路与启发。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Total synthesis of lissodendoric acid A via stereospecific trapping of a strained cyclic allene
Francesca M. Ippoliti, Nathan J. Adamson, Laura G. Wonilowicz, Daniel J. Nasrallah, Evan R. Darzi, Joyann S. Donaldson, Neil K. Garg
Science, 2023, 379, 261-265, DOI: 10.1126/science.ade0032
导师介绍
Neil K. Garg
https://www.x-mol.com/university/faculty/835
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号