西交大李菲课题组Anal Chem:癌细胞铁死亡早期过程的扫描电化学显微镜原位探究
铁死亡是一种铁依赖性的脂质过氧化诱发的细胞程序性死亡方式,其在机制和形态上不同于细胞凋亡等其他细胞死亡方式。自2012年由Scott J Dixon等首次提出铁死亡概念以来,因其独特的细胞死亡方式引起了生物学、医学和药学等研究领域科学工作者的广泛兴趣,其中研发靶向癌细胞铁死亡的新型药剂成为目前癌症药物研发的热点。在细胞铁死亡的早期过程,细胞内的H2O2与Fe2+发生的芬顿反应产生OH•氧化细胞膜中不饱和脂肪酸,导致细胞质膜和细胞器膜破裂,使细胞质膜丧失屏障功能、细胞器活性下降。因此,细胞膜的通透性、细胞的呼吸活性和氧化应激过程是早期铁死亡的重要参数和指标。实时动态监测癌细胞的铁死亡过程,特别是早期过程中这三个关键细胞特性参数的快速动态变化可为探究与癌细胞铁死亡机制相关的细胞膜损伤程度、线粒体活性和氧化应激状态提供细胞原位信息。但目前对这些参数的表征方法,如检测细胞膜通透性的细胞死活染色技术、测定细胞周围氧气和H2O2水平的荧光探针等,还无法实现原位、实时、连续监测细胞铁死亡过程中关键参数的快速变化。扫描电化学显微镜(scanning electrochemical microscopy,SECM)作为一种以微/纳米电极作为扫描探针的微区电化学表征技术,可实现对活细胞消耗或释放化学物质等的高时空分辨的原位、无标记检测,成为可原位监测细胞铁死亡过程中的细胞膜通透性、呼吸活性和氧化应激状态动态变化的理想工具。
近日,西安交通大学生命科学与技术学院仿生工程与生物力学研究所(BEBC)李菲(点击查看介绍)课题组以肝癌HuH7细胞为癌细胞模型,以Erastin为铁死亡诱导剂,应用SECM结合可编程脉冲电位方法,原位表征了肝癌细胞铁死亡早期过程中的细胞膜通透性、呼吸活性、释放H2O2水平等参数的动态变化(图1)

图1. 应用SECM原位检测(A)Eratin诱导的肝癌HuH7细胞铁死亡过程中细胞的(B)膜通透性、(C)呼吸活性、(D)H2O2水平的动态变化示意图。图片来源:Anal. Chem.
该研究首先通过研究了加入不同浓度Erastin后HuH7细胞在不同时间的细胞活力、ROS、脂质过氧化、GSH含量及死活状态等,筛选出Erastin诱导HuH7细胞铁死亡的合适浓度(2 μM)和HuH7细胞开始对Erastin产生反应及细胞状态发生最大变化的药物作用时间(1-3小时)(图2)。
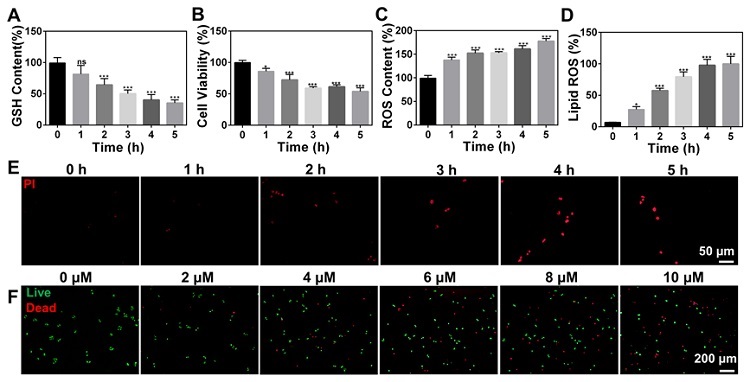
图2.(A-E)添加Erastin后不同时间HuH7细胞的细胞活力和ROS、GSH和脂质过氧化物含量及PI荧光表征结果;(F)添加不同浓度Erastin 2.5小时后HuH7细胞的死活染色荧光图像。图片来源:Anal. Chem.
之后,应用SECM正负反馈工作模式,以[Ru(NH3)6]Cl3为体系氧化还原电对,原位表征了HuH7细胞在加入2 μM Erastin后150分钟内的细胞膜通透性变化(图3)。结果显示,HuH7细胞膜的通透性系数(Pm)随药物作用时间延长而增加,在150分钟内从0增加到了8.1×10-5 m s-1,表明铁死亡过程中伴随着HuH7细胞膜结构的破裂(图3A)。而仅加入0.1% DMSO溶剂对照组细胞的Pm值无明显变化,表明0.1% DMSO对细胞膜无明显影响(图3B)。
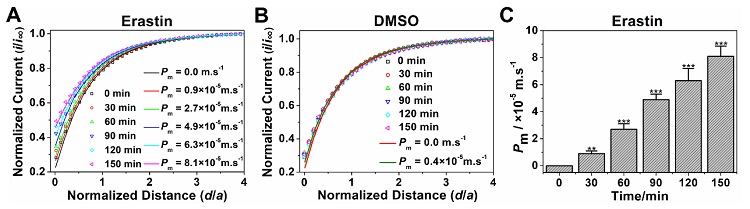
图3. 分别加入(A)2 μM Erastin、(B)0.1% DMSO后HuH7细胞在不同时间的SECM渐进曲线和理论模型拟合结果;(C)2 μM Erastin处理后9组HuH7细胞在不同时间的平均Pm值。图片来源:Anal. Chem.
之后,应用SECM结合可编程脉冲电位方法,分别以FcCOOH和氧气为氧化还原电对,实现了对HuH7细胞形貌和呼吸活性的同时、原位电化学成像(图4)。结果显示,经过Erastin处理后HuH7细胞上方的氧气还原电流随药物用作时间增加而增加,细胞最高点上方归一化的氧气还原电流在150分钟内从91.1%增加为95.3%(图4A,B),表明铁死亡过程中HuH7细胞的耗氧量逐渐减少。这可能是铁死亡过程中细胞线粒体膜上脂质过氧化反应引起线粒体呼吸链的失活,进而导致细胞呼吸活性下降。另外,加入0.1% DMSO后HuH7细胞在150分钟内无明显呼吸活性变化,表明0.1% DMSO对细胞活性无明显影响(图4C,D)。
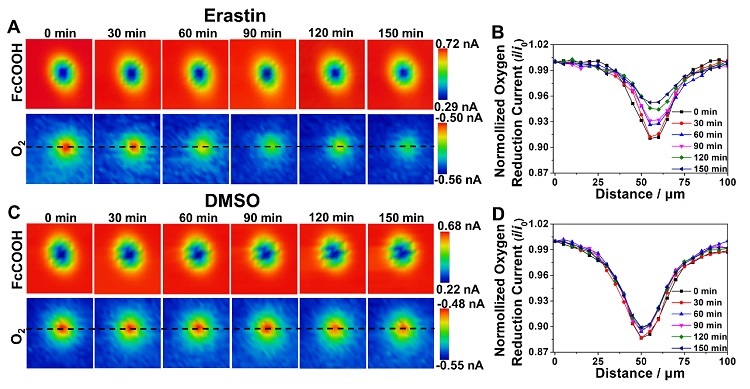
图4. 分别加入2 μM Erastin和0.1% DMSO后HuH7细胞的在150分钟内的(A, C)形貌和呼吸活性的SECM图像,(B, D)归一化的氧化还原电流结果。图片来源:Anal. Chem.
最后,该工作利用可编程脉冲电位方法对HuH7细胞铁死亡过程中H2O2的释放进行了实时、动态追踪(图5)。结果表明,加入Erastin后31-41分钟的HuH7细胞的H2O2释放量增加了1.36 μM,之后41-51分钟内下降了0.98 μM,在51-62分钟H2O2的释放再次增加了1.85 μM,最后H2O2的释放量缓慢下降。这表明HuH7细胞铁死亡过程中H2O2的释放是一个阶段式的动态变化过程,可能同时受线粒体活性和细胞膜结构完整性的协同影响。此外,加入0.1% DMSO后150分钟内HuH7细胞的H2O2释放无明显变化。
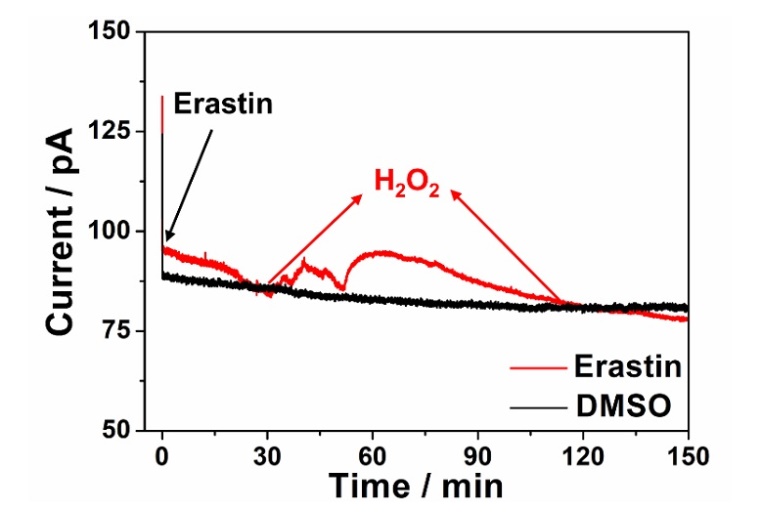
图5. 分别加入2 μM Erastin(红色曲线)和0.1% DMSO(黑色曲线)后HuH7细胞在150分钟内的H2O2的氧化电流-时间曲线。图片来源:Anal. Chem.
该工作首次应用SECM结合可编程脉冲电位方法实现了对肝癌细胞铁死亡早期过程中细胞膜通透性、呼吸活性和H2O2释放过程的原位、动态表征,研究结果有助于理解早期铁死亡过程中细胞膜结构损伤、线粒体功能状态等相关生物学机制。此外,通过定量检测癌细胞对铁死亡诱导剂的早期响应行为,可快速判断癌细胞对铁死亡诱导剂的敏感性,为发展靶向铁死亡的抗肿瘤药物提供参考。该研究成果发表在美国化学会杂志Analytical Chemistry上。该文章第一作者是西安交通大学博士生赵宇翔,通讯作者为西安交通大学李菲教授,其他作者还包括西安交通大学研究生李亚北、曙阿克•库尔曼巴依、刘禹霖、张俊杰、叶朝阳,以及西安交通大学徐峰教授和西安交通大学第一附属医院肿瘤内科郭卉教授和肝胆外科曲凯副教授等。该工作也得到美国哈佛仪器公司Frank Wang博士在SECM仪器技术方面的支持,以及国家自然科学基金、陕西省自然科学基金、陕西省重点研发计划和中央高校基本科研业务费等项目的资助。
李菲教授课题组遵循“生命科学基础问题-电化学扫描探针显微镜平台研制-细胞原位电化学成像与表征”的学术思路,立足于电分析化学方法与技术,结合组织工程学、生物力学和医学等学科,开展疾病相关细胞物理微环境对细胞生化行为的原位电化学成像和细胞界面过程动力学研究,从单细胞层次探究细胞微环境与细胞病理学的关系。该工作是李菲教授课题组自乳腺癌细胞耐药性的SECM研究(Chemical Science, 2022, 13, 10349–10360)后,将研究对象拓展到肝癌细胞的SECM应用研究新成果。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

In Situ and Quantitatively Monitoring Dynamic Process of Ferroptosis in Single Cancer Cell by Scanning Electrochemical Microscopy
Yuxiang Zhao, Yabei Li, Shuake Kuermanbayi, Yulin Liu, Junjie Zhang, Zhaoyang Ye, Hui Guo, Kai Qu, Feng Xu, and Fei Li*
Anal. Chem., 2023, DOI: 10.1021/acs.analchem.2c04179
导师介绍
李菲
https://www.x-mol.com/university/faculty/13704
课题组主页
http://gr.xjtu.edu.cn/web/feili
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号