Sarpong课题组JACS:减个碳,嘧啶变吡唑
氮杂环是药物分子中最重要的结构单元之一。截止2014年,在美国FDA批准的200种最畅销药物分子中,59%含有氮杂环结构,其中嘧啶是最常见的二嗪,吡唑是最常见的二唑。由于它们具有特殊的结构性质,因此这些含氮杂环的引入对提高药物分子的活性和多样性具有重要意义,例如:它们可以通过与生物靶标形成氢键来改善药物活性。此外,针对这些杂环的后期结构修饰也可以加快新型药物和农用化学品的发现。近年来,化学家在分子骨架编辑和后期官能团化方面取得了巨大进展,但目前重头戏仍然是对分子骨架的外围C-H键进行编辑,而有关分子骨架直接编辑的方法却很少(图1A),尽管这样可以有效避免重新设计分子合成路线的麻烦。另一方面,嘧啶杂环在C-H键活化领域是一种良好的导向基(图1B),而吡唑类杂环则是一种相对较差的导向基,因此目前还无法实现吡唑导向的C-H键活化(图1C、1D)。如果可以通过分子骨架编辑实现嘧啶变吡唑,那么就可以提供一种形式的吡唑导向的C-H键活化策略(图1E)。
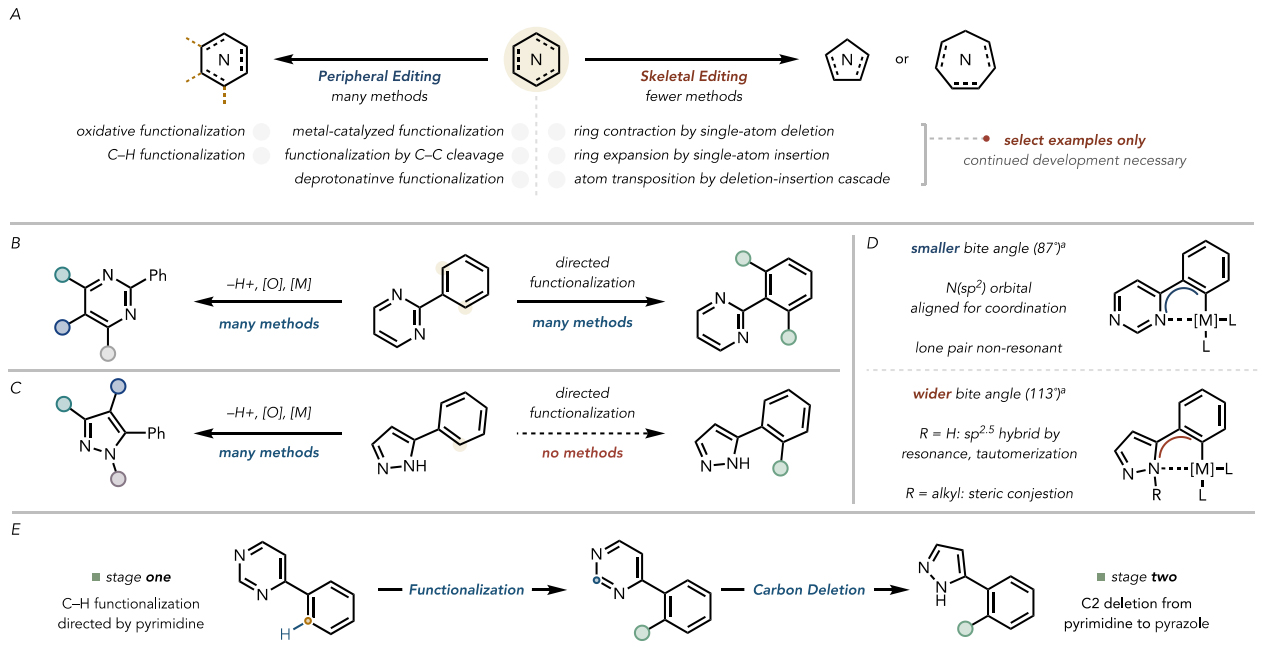
图1. 嘧啶杂环的编辑及其用作C-H键活化的导向基。图片来源:J. Am. Chem. Soc.
van der Plas和Jongejan早在1968年就发现嘧啶在溶剂量的水合肼存在下加热至200 °C就可转化成吡唑(图2A),但是取代嘧啶在该条件下却无法转化成吡唑。随后,化学家发现通过碘甲烷实现嘧啶的N-甲基化可降低嘧啶环的LUMO能量,从而有利于水合肼的亲核进攻以在100 °C将嘧啶变为吡唑,但是反应条件苛刻、底物范围有限并且需要溶剂量的碘甲烷。近日,美国加州大学伯克利分校(UC Berkeley)的Richmond Sarpong教授(点击查看介绍)课题组通过计算研究发现嘧啶N-三氟甲磺酰化能够有效地降低嘧啶的LUMO能量(−3.88 eV),使得肼能够在温和的条件下(23 ℃)进行亲核进攻(图2B),并成功地将一系列取代嘧啶缩合成相应的吡唑。该反应的关键在于室温下嘧啶核的三氟甲磺酰化,随后是肼介导的骨架重塑。相关成果发表在J. Am. Chem. Soc.上。
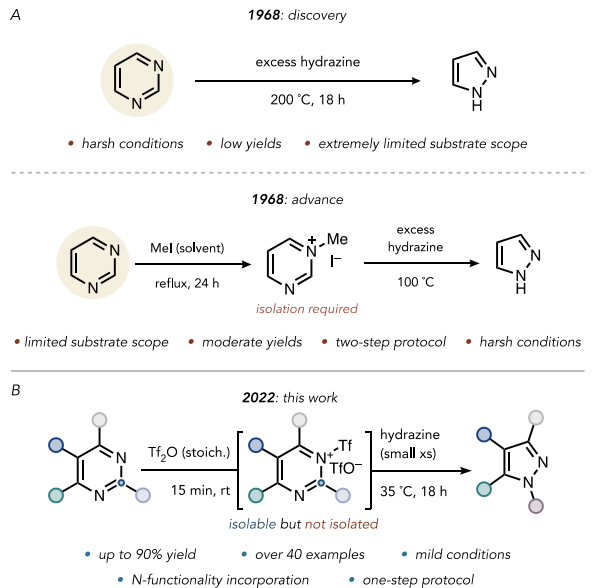
图2. 研究背景及本文的工作。图片来源:J. Am. Chem. Soc.
首先,作者试图确定活化嘧啶母核的条件,但是使用亚化学计量的Brønsted或Lewis酸均没有效果,这可能是由于竞争性质子化或与肼亲核试剂键合所致。在计算的支持下,他们推断成功的活化可能是通过N-酰基化或N-磺酰化实现的。如图3所示,当嘧啶氮的三氟甲酰化在23 ℃下反应15 min后,然后加入肼就能以37%的产率实现环收缩。对反应温度、溶剂进行优化后,得到最佳反应条件:即4-苯基嘧啶(1.0 eq.)、三氟甲磺酸酐Tf2O(1.1 eq.)先在23 ℃反应15 min,然后向其中加入水合肼(3.0 eq.)并在1,4-二氧六环为溶剂的条件下于35 ℃反应18 h,可以90%的产率得到目标产物——5-苯基-1H-吡唑,并且该反应还能以10.0 mmol(1.56g)规模进行制备(收率80%)。
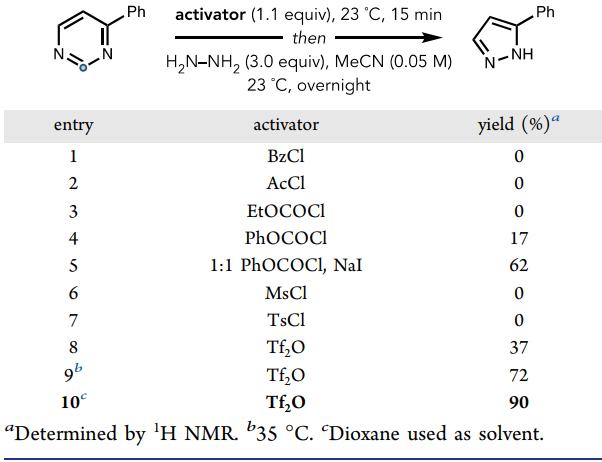
图3. 反应条件优化。图片来源:J. Am. Chem. Soc.
有了最佳反应条件,作者对该反应的底物范围进行了考察。如图4A所示,无论芳环的邻位或间位带有吸/供电子基团(如:2a-6a和2b-6b)均能以中等至较好的收率实现这一转化。此外,嘧啶环上也能耐受各种杂芳基取代基(7-10)、萘基(11)、环己基(12)甚至联芳基(13-17),尽管4-吡嗪基嘧啶(8b)和对二甲基氨基苯基衍生物(13)由于竞争性反应导致收率较低。随后,作者探究了嘧啶环母体的官能团兼容性(图4B),结果显示该反应可以兼容各种取代基,例如:给电子基团(19-21)、苯环(22)、苄基(23)、卤素(24和25)、氰基(26)甚至稠合嘧啶(28),但是吸电子取代基的存在往往会降低反应效率(24-27)。值得一提的是,在活化阶段将这些带有吸电子基团的底物加热至60 ℃反应2 h(以增加三氟甲酰化),然后在加入肼之前冷却至35 ℃就能显著提高收率(例如:27的产率从9%→53%)。最后,作者尝试合成了一系列N-1位有取代基的吡唑类衍生物(30-33,图4C)。通过对比可以发现相对于没有取代的肼,苯基取代肼的反应活性往往会降低很多,这可能是由于苯基的存在降低了肼的亲核性。需要指出的是,当使用环己基肼进行反应时区域选择性发生逆转,生成N2/N1=2.5:1的吡唑异构体混合物34a-b(总收率:70%),NOESY证实有利于在N2处取代。
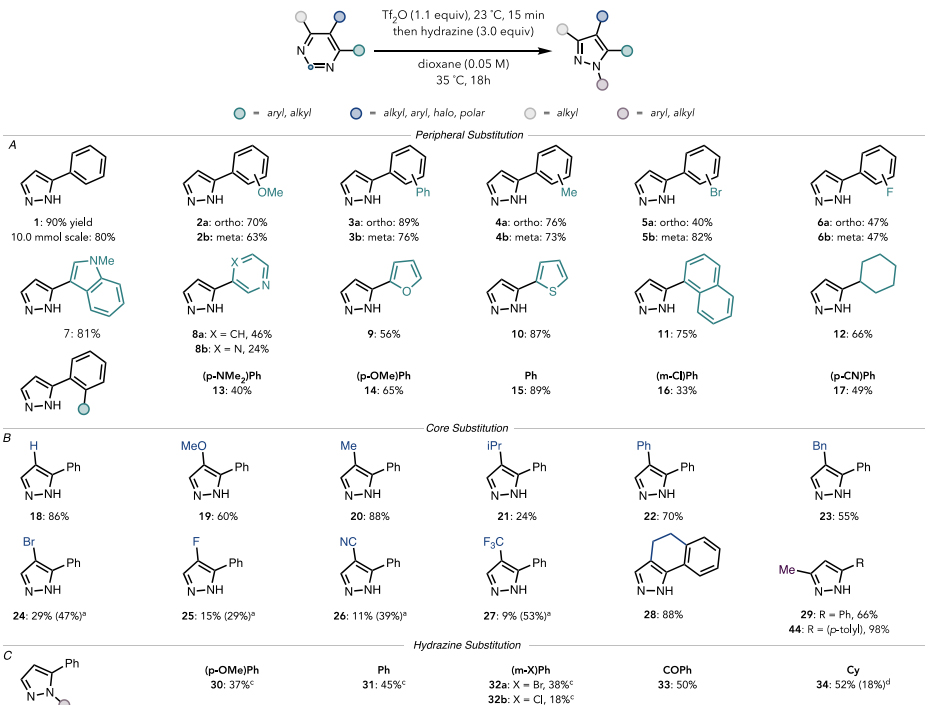
图4. 底物扩展。图片来源:J. Am. Chem. Soc.
与此同时,作者发现对反应条件稍加优化,该反应也可以兼容游离的羟基和氨基(图5A)。此外,取代喹唑啉(药物中的结构单元)也能实现这一转化,以41%的收率获得相应产物38(图5B)。为了证明该反应的实用性,作者直接对结构相对复杂的药物分子(39-43)进行后期骨架编辑(图5C),并以良好的收率转变为含吡唑类的结构,其中benzpyrimoxan由于空间位阻不能在标准条件下进行反应,但是将温度升至60 ℃就能转化为相应的吡唑衍生物39,尽管收率为20%。最后,作者通过连续的嘧啶导向的C-H键活化和嘧啶分子骨架编辑,顺利地合成了Celecoxib衍生物的前体46(图5D)。此外,2-芳基嘧啶的导向C-H键官能团化反应(如:邻位乙酰氧基化和邻位氯化)也能成功地应用于4-芳基嘧啶44,并以良好的收率得到相应的产物47和48(图5E)。
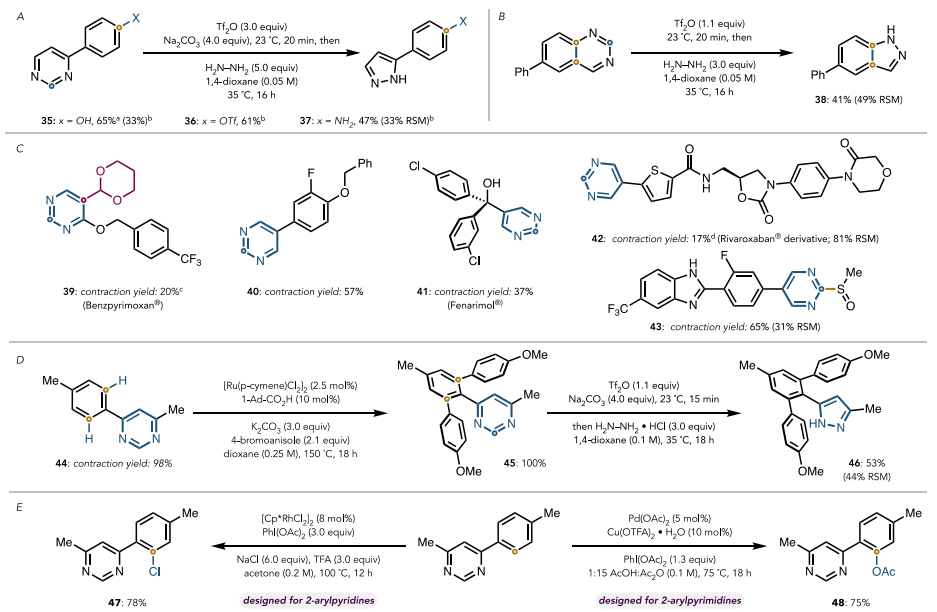
图5. 反应的应用。图片来源:J. Am. Chem. Soc.
最后,作者还详细研究了该反应可能的机理。其中,空间位阻最小的嘧啶氮原子更容易进行三氟甲磺酰化(ΔG⧧ ≈ 0.99 kcal/mol;图6A),这一选择性也进一步通过4-苯基嘧啶的甲基化实验(图6C)和通过计算得到的Fukui亲核指数予以证实(图6D)。随后,亲核性的肼进攻活化嘧啶的C-6位得到中间体C,DFT计算表明该步骤为决速步。同时,作者发现在此阶段于较低温度下脱三氟甲磺酰基是非常显著的副反应,会严重降低反应的收率,条件优化过程中将反应温度升至35 ℃时产率显著增加也证实了这一点。接着,具有较高酸性的中间体C去质子化得到中间体D,随后开环得到中间体E,经互变异构得到中间体F,其末端氮原子与C-4反应关环形成中间体G,最后经质子转移和1,5-氢迁移消除N-三氟甲基甲脒基团便可生成所需的吡唑产物。
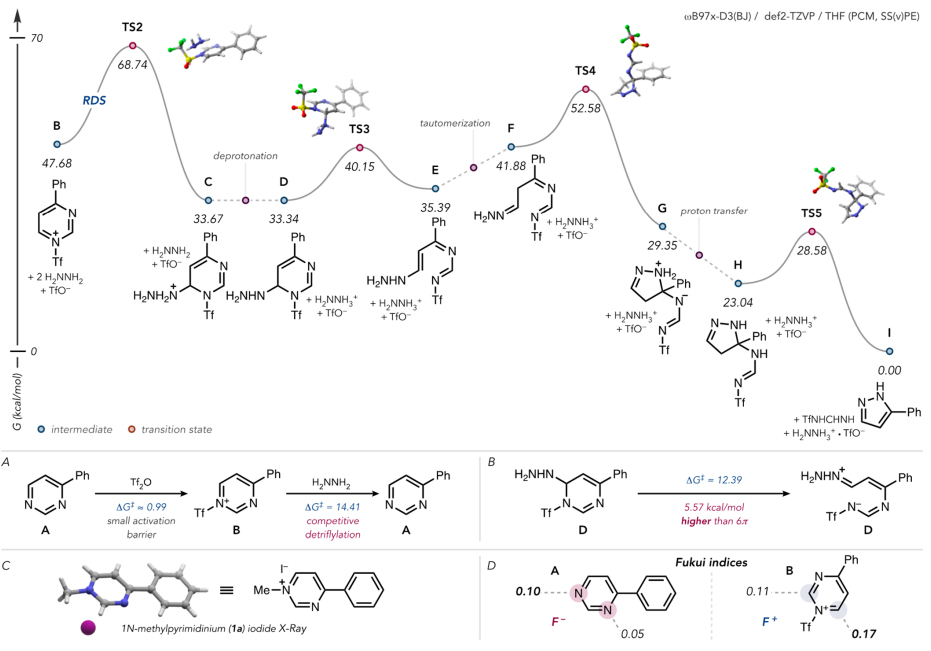
图6. 反应机理研究。图片来源:J. Am. Chem. Soc.
总结
Sarpong课题组报道了在较温和的条件下通过形式上的碳原子删除实现了从嘧啶到吡唑的转化。该反应条件温和,底物范围广泛,可以应用于复杂药物分子骨架的直接编辑。此外,作者利用嘧啶核作为强导向基进行C-H键官能团化,然后骨架跃迁到相应的吡唑,为制备多样化的吡唑化合物(包括各种N2-取代吡唑)建立了一个新的平台。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Skeletal Editing of Pyrimidines to Pyrazoles by Formal Carbon Deletion
G. Logan Bartholomew, Filippo Carpaneto, Richmond Sarpong
J. Am. Chem. Soc., 2022, 144, 22309-22315, DOI: 10.1021/jacs.2c10746
导师介绍
Richmond Sarpong
https://www.x-mol.com/university/faculty/32
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号