Science:“驯服”乙烯基碳正离子
副标题:乙烯基碳正离子的催化不对称C-H键插入反应
碳正离子是一种带正电且通常不稳定的分子,在天然产物、药物分子的合成中起着重要作用。尽管碳正离子与许多现代合成过程相关,但要想控制反应的区域选择性、化学选择性和立体选择性仍极具挑战性,在不对称催化中尤其如此。目前,很多共振稳定的三配位碳正离子已被应用于催化对映选择性反应,例如亚铵离子和羰基氧鎓(oxocarbenium)离子。相比之下,双配位碳正离子(如芳基正离子和乙烯基正离子)在不对称催化领域却鲜有应用(图1B),这可能要归因于缺乏生成此类碳正离子的催化方法以及它们一旦形成就具有的超高反应性。此外,大多数双配位碳正离子催化的C-H键插入反应都需要使用弱配位阴离子(weakly coordinating anions,WCAs),WCAs具有弱碱性和亲核性,从而可以避免不利的E1消除或SN1亲核取代反应。然而,目前已报道的少数手性WCAs尚未成功用于不对称催化中,这是因为对映选择性所需的高度有序的过渡态几乎总是依赖于定向配位相互作用。
近日,美国加州理工学院的Hosea M. Nelson教授、加州大学洛杉矶分校的K. N. Houk教授和犹他大学的Matthew S. Sigman教授课题组强强联手,一起“驯服”了多年来一直“桀骜不驯”的乙烯基碳正离子,将其“关”在大体积催化剂中并实现了其催化不对称的C-H键插入反应。具体而言,作者使用诺奖得主Benjamin List课题组发展的具有受限空间结构的超强Brønsted酸催化剂——手性亚氨基双磷酰亚胺酯(IDPi),成功地实现了乙烯基碳正离子的高对映选择性C-H键插入反应(图1C),使得未活化C(sp3)-H键的立体选择性官能团化成为可能。相关成果发表在Science 上。
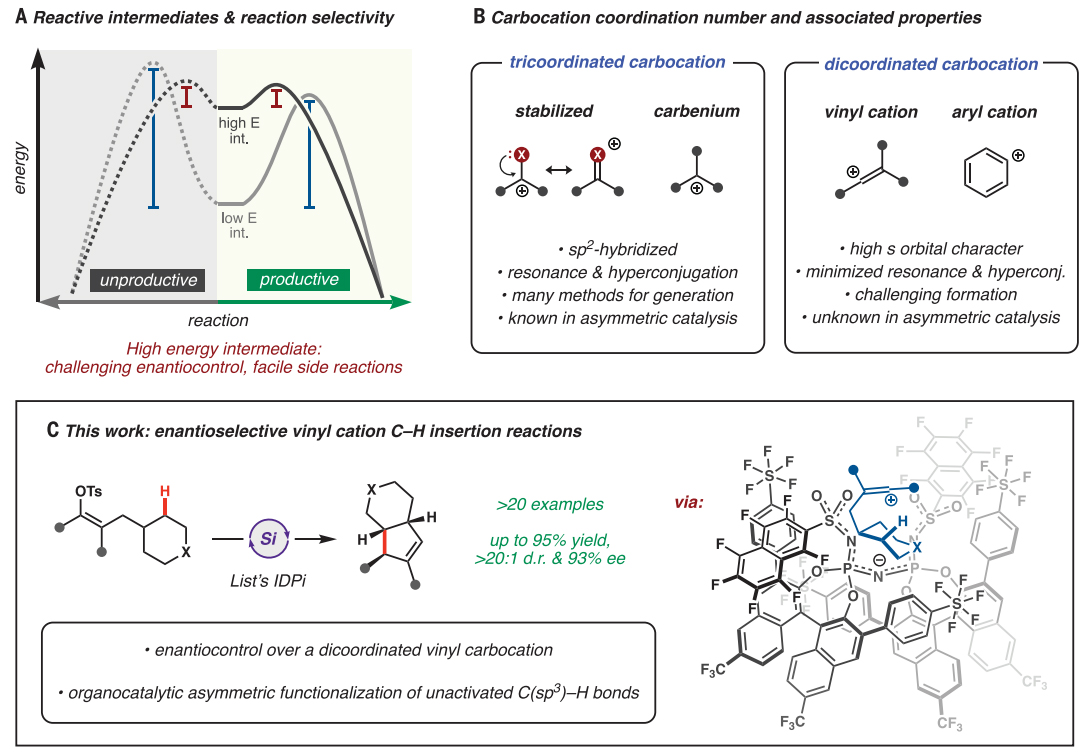
图1. 碳正离子的选择性反应。图片来源:Science
鉴于含氮多环骨架广泛存在于许多生物活性天然产物中,因此作者试图通过C-H键插入使哌啶基片段发生分子内去对称化以产生双环结构。对反应条件进行筛选后,作者发现底物1a在IDPi 8B(12 mol%)、烯丙基三(三乙基硅基)硅烷(1.3 equiv.)和环己烷为溶剂的条件下于65 ℃反应72 h,能以91%的收率、91%的e.e.值和>20:1 d.r.值得到环化C-H键插入产物2a(图2),含有三个连续的立体中心。
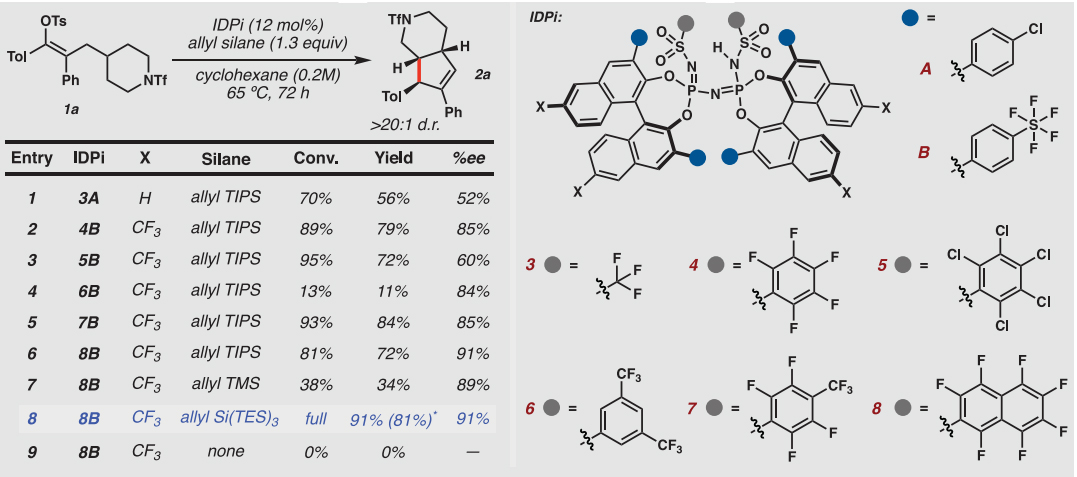
图2. 反应优化。图片来源:Science
有了最佳反应条件,作者探索了该反应的底物范围(图3),结果显示两个芳基环上带有不同基团的底物(2b-2i、2l-2s)甚至杂环取代的底物(2j和2k)均能兼容该反应,以中等至较好的收率(40-95%)、优异的对映选择性(高达93% e.e.)和非对映选择性(>20:1 d.r.)得到所需产物,并且许多产物可通过单次重结晶提高对映选择性以产生对映纯产物(>99% e.e.)。需要指出的是,该反应能够耐受先前在过渡金属催化中不稳定的官能团(2p-2s),进一步凸显了该方法与过渡金属催化C(sp3)-H键官能团化的互补性。此外,该反应还能在空间拥挤的全碳季碳中心附近实现C-H键插入并且收率很高(2u,收率81%),尽管具有中等的对映选择性。值得一提的是,模型底物的全碳类似物也能以中等的立体选择性转化为双环[4.3.0]壬烯(2v)。另一方面,产物2a可以在Red-Al的作用下脱除N-Tf保护基并得到游离胺2w,或者在酸性条件下进行加热可异构化为热力学上更有利的四取代烯烃2x,同时不会损失对映选择性。
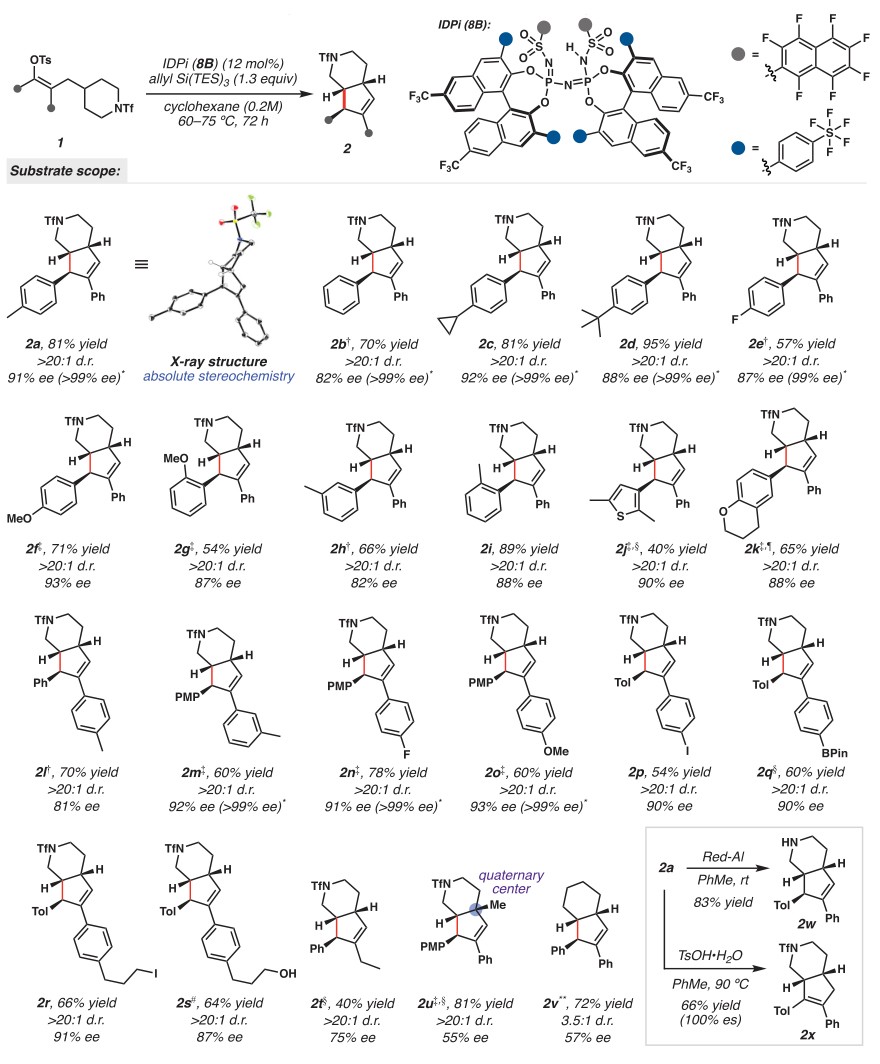
图3. 底物范围。图片来源:Science
如图4A所示,Z-和E-烯基对甲苯磺酸酯异构体进行反应时均得到了相同的插入产物2a并且具有相同的对映选择性,这进一步证实了线性乙烯基碳正离子中间体的存在。此外,作者还制备了烯基对甲苯磺酸酯9(不能进行分子内C-H键插入)并发现其在标准条件下主要得到联烯10,这可能是由于线性乙烯基碳正离子中间体经Wagner-Meerwein重排所致。在对映选择性插入的情况下,烯丙基硅烷不影响反应的选择性,尽管它对速率有深远影响,该结果不仅支持Si中心在底物电离中的作用,而且表明在电离后形成离散的乙烯基正离子-IDPi离子对,经历对映选择性决定的C-H键插入步骤。支持这一假设的是底物插入位点的氘化会导致两种结构不同催化剂的e.e.值显著增加(图4B),同时没有观察到与CD2相邻亚甲基的氘掺入(图4C)。其次,底物1u以高产率形成插入产物 2u,并没有重排的迹象。在此基础上,作者提出了可能的反应机理(图4D):首先,烯丙基硅烷经质子脱硅烷基化产生活性Lewis酸11,将底物1电离并产生反应性的乙烯基正离子物种12,同时将其限制在IDPi阴离子内作为接触离子对。随后,12经对映选择性决定的C-H键插入步骤得到中间体13,最后经动力学去质子化便可得到插入产物2并再生IDPi。
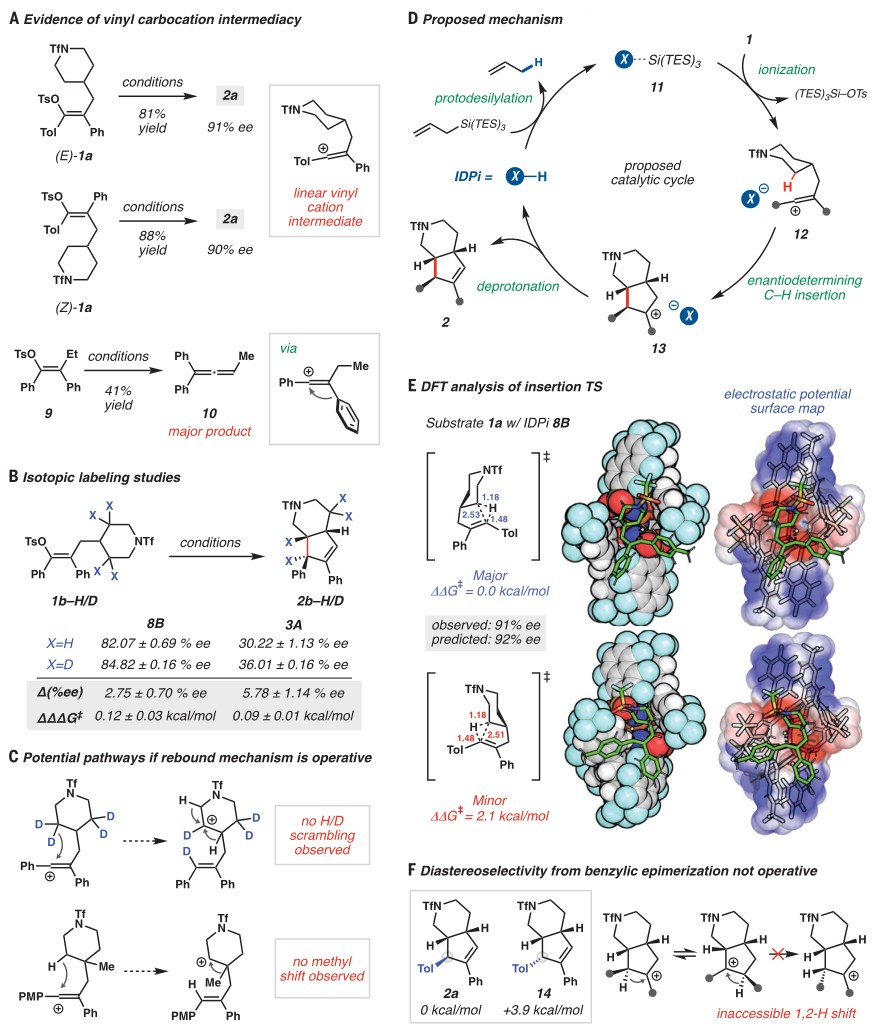
图4. 机理研究。图片来源:Science
为了探究带来立体选择性的特定相互作用,作者利用DFT计算了底物 1a和催化剂8B的两种非对映体过渡态(TS),发现两者之间的能量差 (ΔΔG‡) 为2.1 kcal/mol(图4E)。在minor TS中,空间位阻的哌啶更靠近催化剂骨架中拥挤的p-SF5取代基,这些排斥作用阻碍了底物在催化剂阴离子口袋中的最佳定位,从而削弱了缔合离子之间的分子间相互作用。仔细检查TS结构发现乙烯基正离子发生弯曲,使得甲苯基远离大位阻的N-Tf哌啶环,这与实验结果相一致。尽管计算显示产物2a在能量上优于其苄基差向异构体14(图4F),但C-H键插入后热力学驱动的平衡可能不是非对映选择性的驱动因素。已知 1,2-氢迁移是立体特异性的,这排除了苄基氢交换作为苄基立体中心差向异构化的潜在机制,并且由于氘化底物1b-D4没有发生H/D交换,因此这些结果与1,1-插入步骤相一致,该步骤能同时确定所有三个立体中心并具有高立体控制。
为了进一步探索控制催化剂和底物结构如何影响对映选择性结果的因素(图5),作者使用统计模型分析优化和底物范围研究中记录的不同反应输出来全面研究反应。结果表明,该反应的高对映选择性是由空间受限催化剂和Tf-保护的哌啶基底物中存在的致密电负性的组合产生的。对于具有正离子稳定功能的底物,催化剂的带负电口袋中的催化作用是最佳的,这就解释了在IDPi(8B)条件下2f的93% ee值并支持了所提出的过渡态。
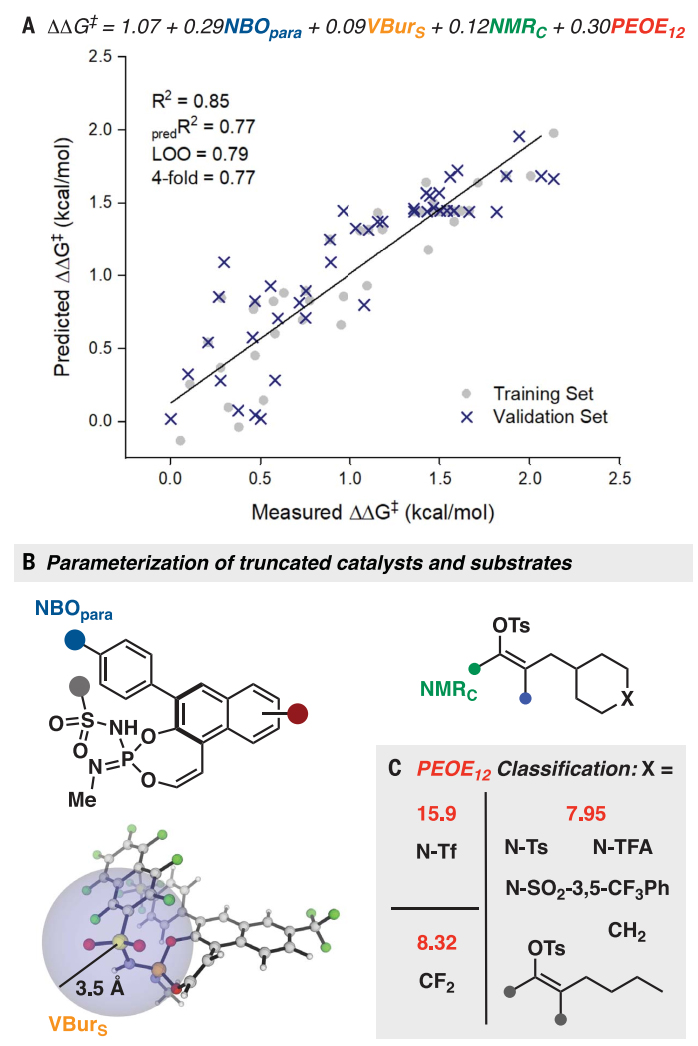
图5. 统计建模。图片来源:Science
最后,作者试图用新的底物类别来测试本文的体系,并利用这些中间体的高能量来构建张力环。为此,作者制备了底物15(图6),将其插入环己基就会产生手性[3.2.1]碳环(16),其中IDPi 3A能以中等的产率和对映选择性(高达77% ee)催化这一过程,进一步展现出IDPi催化在通过乙烯基碳正离子进行具有挑战性的对映选择性C(sp3)-H键官能团化反应方面具有更广泛的适用性。此外,产物16可以很容易地通过氧化裂解转化为手性1,3-二酮环己烷(17)并且具有高对映体特异性(如:17a-17c),这突出了该反应的应用潜力。
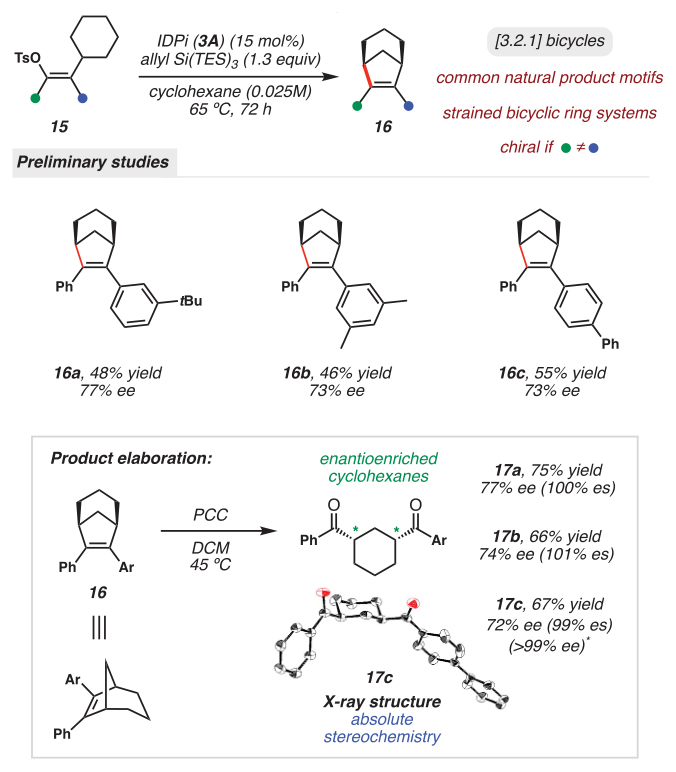
图6. 张力双环体系的催化不对称合成。图片来源:Science
在合成化学中,反应性极高的乙烯基碳正离子像是一匹喜欢在反应中纵横驰骋的野马,以至于许多人都怀疑它能否被控制进而以立体选择性的方式合成目标分子。本文作者将乙烯基碳正离子限制在大体积催化剂IDPi内,成功实现“驯服”,以对映体选择性的方式将其插入碳氢键中。哈佛大学的Eric N. Jacobsen表示,这项工作代表了“使用高反应性中间体进行不对称催化的重大进展。”[1]
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Catalytic asymmetric C-H insertion reactions of vinyl carbocations
Sepand K. Nistanaki, Chloe G. Williams, Benjamin Wigman, Jonathan J. Wong, Brittany C. Haas, Stasik Popov, Jacob Werth, Matthew S. Sigman, K. N. Houk, Hosea M. Nelson
Science, 2022, 378, 1085-1091, DOI: 10.1126/science.ade5320
参考资料:
[1] Chemists tame the vinyl carbocation
https://cen.acs.org/synthesis/Chemists-tame-vinyl-carbocation/100/web/2022/12
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!






















































 京公网安备 11010802027423号
京公网安备 11010802027423号