中山大学周建华教授团队ACS Nano:三层结构蛋白微泡胶囊用于增强超声造影诊疗
近日,中山大学生物医学工程学院周建华教授(点击查看介绍)团队在ACS Nano 期刊发表研究论文,通过乙醇-水交换策略制备了超稳定的三层结构蛋白微泡(图1)。该微泡的三层结构分别为外壳、中间蛋白溶液层和内部的气核。这种策略具有可控性、普适性和环保性,制备出来的微泡具有高稳定性、高载药量和优异的超声造影功能,充分展示了其在诊断治疗平台设计和应用方面的巨大潜力。
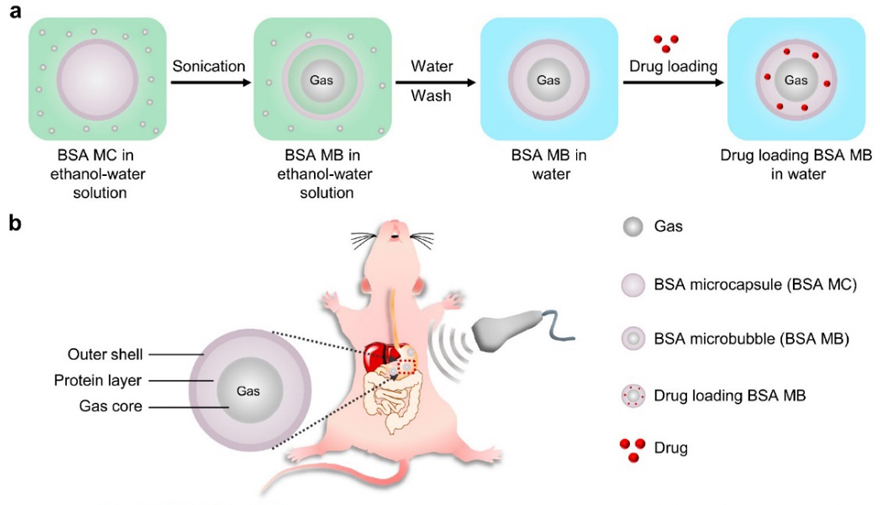
图1. 微泡制备过程及应用于胃超声造影的示意图
微泡由于具有大空腔、低密度、大表面积和声散射等特点被广泛应用在食品、能源、生物医药等领域。尤其在生物医药领域,微泡在超声成像、药物输送、组织工程等方面发挥着越来越重要的作用。如微泡因具有强的声散射能力而被用作超声造影剂,以提高器官或组织的超声成像效果。脂质微泡是最常见的微泡,并被证明具有良好的应用前景,如临床使用的超声造影剂声诺维就是一种脂质微泡。然而,对于许多实际用途来说,脂质微泡往往缺乏稳定性,因此研究人员付出了巨大的努力来寻找替代的外壳材料。例如无机纳米颗粒、高分子聚合物等硬材料,然而这些硬材料往往难以降解,容易产生生物毒性。因此,仍然需要探索新的方法来制备具有高稳定性、生物相容性好、结构可控的微泡,以赋予其先进的功能。
除了作为超声造影剂,微泡在超声影像介导药物递送方面也有重要的应用潜力。传统的微泡制备方法(如超声空化法、吸附法、薄膜水化法)得到的微泡通常是两层结构,即外膜和内部的气核,没有专门的载药层。这类微泡的载药方式主要包括两种:一是将药物吸附在微泡的外膜上,二是将药物嵌入到外膜中。这两种载药方法的载药量均不高,前者包载的药物不牢,药物容易从外膜脱落,后者会加重微泡外膜的负担,降低微泡的稳定性,且必须通过破坏微泡的方式才能将药物释放出来。因此,制备载药量高和可控释放药物的微泡来开发一种智能的影像介导药物递送系统是具有重要意义。
为了解决上述问题,周建华教授团队报道了一种超稳定的新型三层结构蛋白微泡(图1),即外膜、中间蛋白溶液层和内部的气核。这种微泡是通过简单的乙醇-水交换策略制备的,即通过将乙醇加入到含有蛋白微胶囊的水溶液中,施加超声,即可以获得特殊三层结构的微泡。这种微泡制备方法具有可控性和普适性。得益于微泡的特殊结构,微泡能够在水溶液中保持长期稳定,在体内外均显示出优异的增强超声造影能力。此外,微泡中间的蛋白质溶液层可以作为专门的载药层,从而提高微泡的载药量,且该载药微泡可以在外部超声的刺激下可控地释放药物。微泡的这些特殊优势将对广泛使用的传统脂质微泡提出了挑战,作为一种多功能微泡,他们在构建超声成像介导的治疗平台方面具有很大的潜力。此外,这种特殊三层结构的微泡在超声造影剂领域具有新颖性和先进性,有望成为新一代的超声造影剂,他们将引起人们对超声成像引导下给药系统的更多兴趣和关注。
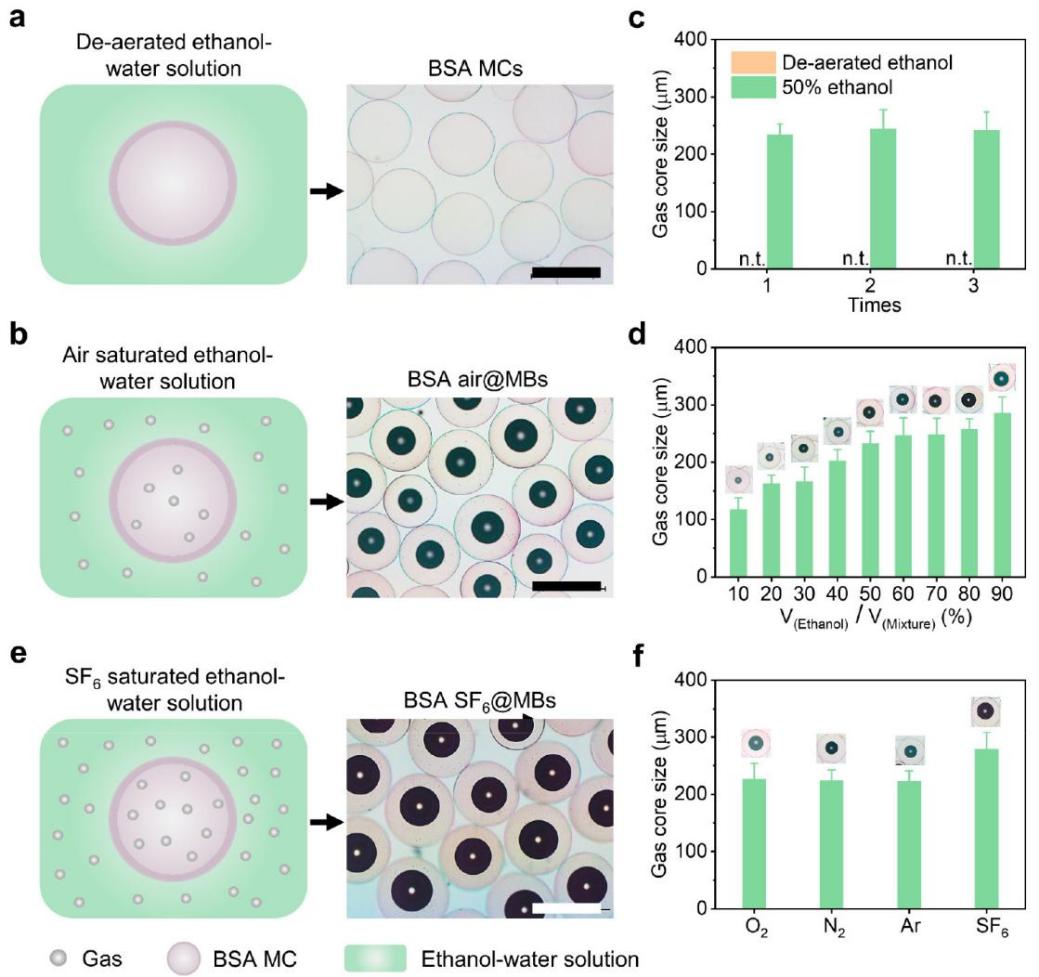
图2. 乙醇-水交换策略制备微泡的机理

图3. 乙醇-水交换法制备出不同尺寸和类型的微泡
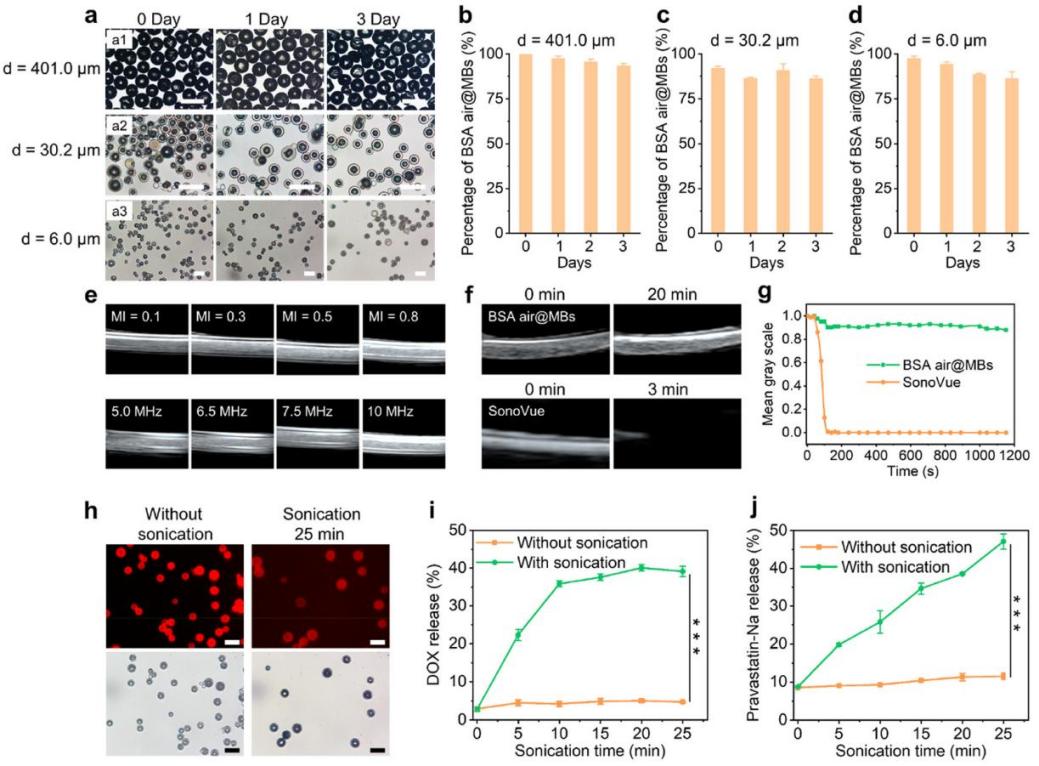
图4. 微气泡的稳定性、超声造影及载药性能研究
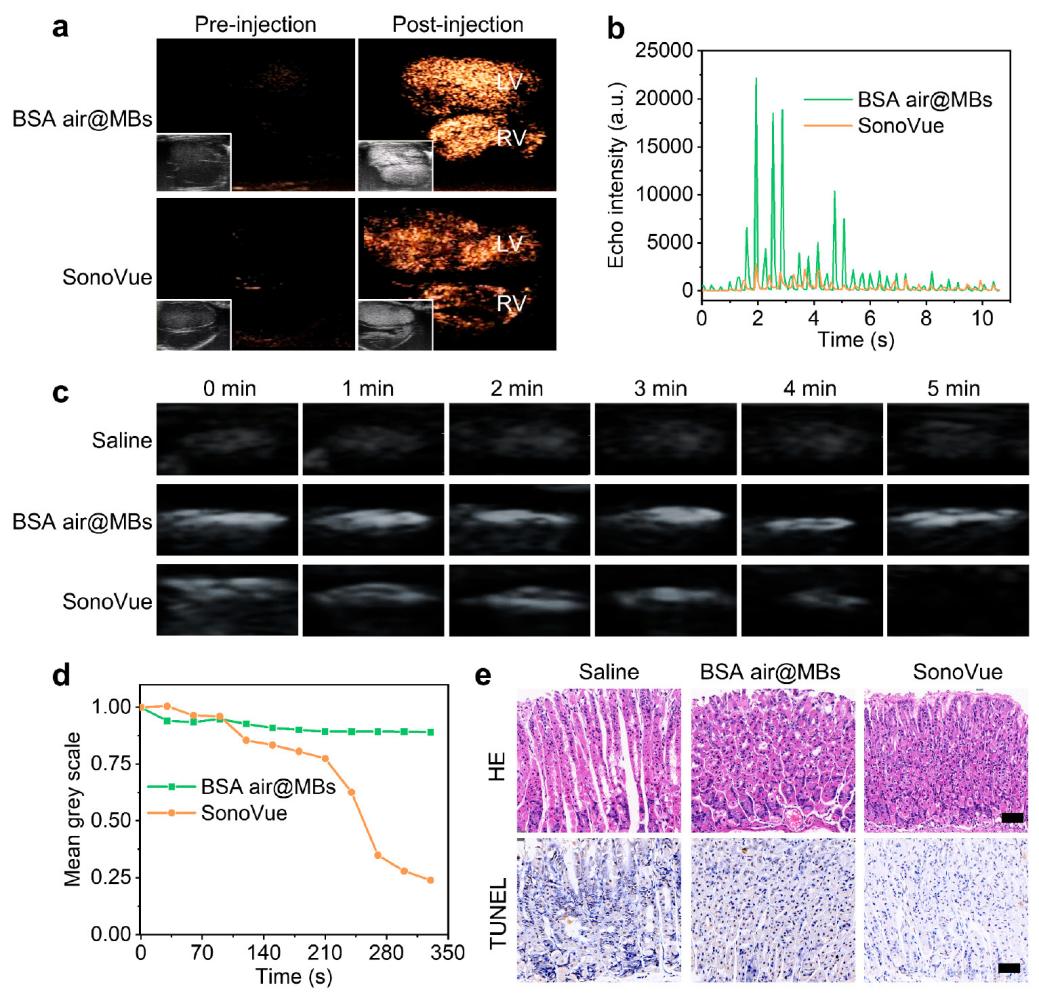
图5. 微泡体内超声造影研究

图6. 微泡在体内外的安全性评估
论文的通讯作者为中山大学生物医学工程学院周建华教授,第一作者为博士生邓秋榕和硕士生米娇妹。该研究得到了国家重点研发计划(2017YFE0102400)、国家自然科学基金(32000939)、深圳科技计划(RCBS20210706092409020、RCBS20210609104339043、JCYJ20190807160401657和JCYJ20190707160415074)的部分支持。这项工作还得到了广东省传感器技术和生物医学仪器重点实验室基金会(2020B12120060077)和中澳健康科技创新联合研究院的部分支持。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Superiorly Stable Three-Layer Air Microbubbles Generated by Versatile Ethanol–Water Exchange for Contrast-Enhanced Ultrasound Theranostics
Qiurong Deng, Jiaomei Mi, Jianpei Dong, Yin Chen, Lanxi Chen, Jinxu He, and Jianhua Zhou*
ACS Nano, 2022, DOI: 10.1021/acsnano.2c07300
导师介绍
周建华
https://www.x-mol.com/university/faculty/62331
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
































 京公网安备 11010802027423号
京公网安备 11010802027423号