“隔山打牛”:通过桥接蛋白靶向嵌合体(Bridged PROTAC)降解“不可成药”靶点
西奈山伊坎医学院金坚教授团队长期深耕于靶向蛋白降解领域,致力于蛋白降解药物的设计与开发,以及推进这些技术的临床应用与转化。该团队已经成功开发了多种靶点的蛋白靶向嵌合体(PROTAC),克服了传统小分子药物的种种缺陷,为靶向蛋白降解领域的研发不断注入强心剂。包括:组蛋白甲基转移酶NSD家族NSD2/3、激酶家族AKT和ALK、EGFR以及表观遗传家族靶点EZH2等。
此外,金坚教授团队也开发了其他新型PROTAC及去泛素化酶靶向嵌合体(DUBTAC)技术:(1)叶酸笼罩的Folate-Caged PROTACs,该类PROTAC进一步提高了PROTAC的细胞选择性;(2)基于寡核苷酸链的TF-PROTACs,成功实现了对不可成药转录因子的降解;(3)光诱导opto-PROTAC,实现了PROTAC的可控激活;(4)靶向WDR5 和Ikaros的双靶点PROTAC;(5)开发新型的E3连接酶KEAP1配体,并成功用于BRD3/4的降解。进一步拓展了靶向蛋白质降解的有限工具箱。(6)基于寡核苷酸链的TF-DUBTACs,成功稳定了对肿瘤有抑制功能的不可成药转录因子。
近日,金坚教授研究团队在Journal of the American Chemical Society 杂志上在线发表研究论文,首次报道了通过桥接蛋白靶向嵌合体技术(Bridge PROTAC)有效降解不可成药靶标cyclin D1,极大地扩展了PROTAC的应用领域。金坚教授为本文的通讯作者,金坚教授是生物医药公司CULLGEN的联合创始人,熊彦、钟玥和Hyerin Yim为本文的共同第一作者。
背景介绍
近年来,PROTAC作为一种全新的疾病治疗手段,吸引越来越多的关注。相比于传统的小分子靶向药,PROTAC具有无可比拟的优势,例如具有催化特性,不需要具备和靶点有很高的亲和力,也不需要抑制靶点的酶活性。但是PROTAC也有一些自身的局限性,只有通过直接靶标蛋白结合,才能达到相应的降解。目前为止, 在700 多种确定的致癌蛋白中,只有大约40种蛋白有相应的小分子结合体,因此对于剩下的这些缺乏小分子结合体的“不可成药”靶点,亟需全新的策略予以靶向。
Cyclin D1在调节细胞周期中起着关键作用,在多数肿瘤中被过度表达,对肿瘤细胞具有触发以及维持功能。同时,以往的实验表明,cyclin D1不是维持正常细胞功能的必须蛋白,通过生物敲除cyclin D1的小鼠能够正常发育。因此,cyclin D1是一个很有潜力的癌症治疗靶标,在DepMap所列的627种癌症优先靶向靶标中,cyclin D1名列榜首。
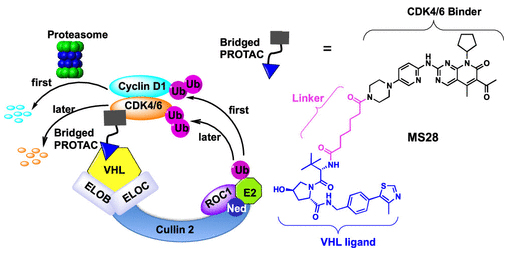
然而,cyclin D1缺乏已知的小分子结合体,通常被认为是不可成药靶标,无法应用传统的PROTAC技术靶向。基于对PROTAC技术的理解,以及一些“不可成药”靶标(POI)可以与一些具有小分子结合体的“桥接蛋白”(bridge protein)形成蛋白复合物的报道,作者认为可以发展基于桥接蛋白小分子结合体的异双功能小分子(heterobifunctional small molecule),拉近POI和bridge protein形成的蛋白复合物与E3链接酶的距离,以达到对POI的泛素化及降解。由于与cyclin D1形成蛋白复合物的CDK4/6有着高活性,高选择性的小分子抑制剂,作者选择了cyclin D1作为研究靶标来验证bridged PROTAC 的想法(图1)。
实验结果与讨论
基于FDA批准的CDK4/6小分子靶向药Palbociclib(PB)和E3链接酶配体VHL-1,作者设计及合成一系列不同烷烃碳链链接的异双功能小分子,并在对cyclin D1依赖及过表达的非小细胞肺癌(NSCLC)Calu-1细胞系中评估这些双功能分子对cyclin D1 蛋白水平的影响。作者发现在这些小分子中,MS28能够有效地降解cyclin D1。基于MS28,作者设计了两个相应的阴性对照:MS28N1,可以结合CDK4/6但不结合VHL;MS28N2,可以结合VHL但不结合CDK4/6(图1)。
在进一步的评估中,作者发现MS28在降解cyclin D1的同时,也可以选择性地降解CDK6 (接近50%的降解),同时在低浓度时(0.3 μM)对CDK4蛋白水平却没有影响。由此表明,MS28有可能选择性的结合CDK6-cylcin D1的蛋白复合物,而不是CDK4-cyclin D1蛋白复合物。有趣的是,在相同实验条件下,两个早先报道的基于cereblon的CDK4/6小分子降解剂BSJ-03-204(BSJ)和MS140都不能有效降解cyclin D1。同时,此前的报道也表明另外一个基于cereblon 的CDK4/6小分子降解剂CP-10也不能降解cyclin D1。基于以上结果,作者探讨了MS28引起的cyclin D1降解机理并不是由于CDK4/6的降解,导致cyclin D1不能有效地与CDK4/6 形成蛋白复合物,从而造成cyclin D1不稳定。在MS28、MS28N1、MS28N2和PB与CDK4/6蛋白的结合能力的实验中,MS28和MS28N1对CDK4/6保持了一定的结合能力,而MS28N2 则丧失了对CDK4/6的结合能力。同时,相对于CDK4,MS28和MS28N1对CDK6保持更高的结合能力,这在一定程度上解释了MS28能够选择性地降级CDK6,而不是CDK4。接下来,在Calu-1细胞系中,作者评估了MS28N1和MS28N2对cyclin D1蛋白浓度的影响,结果表明,这两个小分子都不能有效地降低cyclin D1蛋白浓度,说明小分子需要同时结合CDK4/6和VHL才能有效降解cyclin D1(图1)。

图1. 全新的cyclin D1降解剂MS28的发现
下一步,作者研究了在不同时间下,MS28对cyclin D1蛋白浓度的影响。实验表明,MS28优先降解cyclin D1 (1小时,大于50%降解),而要等到4小时才能对CDK4/6发挥作用。这些实验结果和之前观察到的BSJ和MS140不能降解cyclin D1的现象进一步证明MS28不是通过先降解CDK4/6来促使cyclin D1的降解。更有可能是,MS28促进了cyclin D1、CDK4/6和VHL三元复合物的形成,拉近了cyclin D1与VHL的距离,导致cyclin D1的优先泛素化使之先于CDK4/6降解。作者还研究了不同浓度条件下,MS28对cyclin D1、CDK4/6浓度的影响,结果表明,MS28对cyclin D1远远优于CDK4/6的降解效率(DC50= 950 ± 66 nM,Dmax 大于90%)。之后,通过实验作者发现MS28对CCND1和CDK4/6 mRNA浓度没有影响,排除了MS28是通过蛋白转录影响cyclin D1蛋白浓度的可能性(图2)。

图2. 在Calu-1细胞系中,MS28选择性降解cyclin D1
接下来,作者对MS28降解cyclin D1的作用机制进行了深入研究。首先,通过等温滴定量热法(ITC)确定了MS28不与cyclin D1直接结合,排除了MS28直接促使cyclin D1与VHL形成二元复合物导致cyclin D1直接降解的可能(图3)。

图3. MS28不与cyclin D1直接结合
在进一步的机制研究中,作者发现,敲除了CDK6或者VHL都能够抑制MS28对cyclin D1的降解,表明MS28降解cyclin D1需要通过促进CDK6-cyclin D1 蛋白复合物和VHL E3连接酶的结合。由于MS28能够与CDK6结合更加紧密,且更高效地降解CDK6,只需要敲除CDK6就能抑制cyclin D1的降解。在pull-down实验,在经MS28处理的CDK6、cyclin D1和VHL-ELOC-ELOB(VCB)缓冲液中,cyclin D1和VHL能和CDK6一起共洗脱,进一步证明MS28促进了CDK6-cyclin D1-VHL三元复合物的形成。此外,加入蛋白酶体抑制剂MG132或者NAE抑制剂MLN4924可有有效抑制逆转cyclin D1降解效果,表明MS28诱导cyclin D1降解依赖泛素蛋白酶体途径(UPS)(图4)。

图4. MS28依赖于VHL、CDK6和UPS途径降解cyclin D1
为了探究MS28的靶点选择性,作者进行了一系列实验。首先,通过WB实验,确定了MS28除了降解cyclin D1、CDK6和CDK4以外,还能降解cyclin D3和cyclin A2。作者推断cyclin A2的降解可能是由于MS28对CDK4/6的抑制引起下游靶标转录变化造成的。WB实验还确认了MS28不能影响cyclin D2 和一些其它主要cyclins和CDKs蛋白浓度,例如cyclin B1和CDK2。作者还测试了58种激酶对MS28的响应,在1 μM浓度下,除了CDK6,MS28对其他57种激酶都没有表现出明显的抑制作用。在相应的基于全局串联质谱标签TMT定量蛋白分析的蛋白质组学实验中,MS28只有影响了包括cyclin D1/3和CDK6在内的一小部分蛋白浓度,而这类蛋白大部分和细胞周期相关,因此他们的浓度降低很有可能是cyclin D1和CDK4/6降解引起的。上述的一系列实验表明,MS28具有较好的靶点选择性(图5,图6)。

图5. MS28具有良好的靶点选择性

图6. 在蛋白组学实验中,MS28选择性降解cyclin D1及相关的细胞周期蛋白
众所周知,cyclin D1在调节CDK4/6、Rb-E2F信号通路中起着关键作用,在RT-qPCR实验中,MS28能够显著地降低E2F调控的下游基因mRNA水平。此外,在细胞增殖实验中,相比于PB和其他的CDK4/6降解剂BSJ,MS28能够显著抑制Calu-1细胞的增殖(GI50 = 1.0 ± 0.32 μM)。在soft agar colony formation实验中,MS28也表现出优于PB、BSJ和MS28N1的抑制增殖效果。在另外一个依赖cyclin D1的NSCLC NCI-H2110细胞系中,MS28也能选择性地降解cyclin D1,而PB、BSJ、MS28N1、MS28N2对cyclin D1没有任何影响。在NCI-H2110细胞的增殖实验中,MS28也表现出优于PB和BSJ的抑制增殖效果(GI50 = 750 ± 90 nM)(图7)。

图7. 在肿瘤细胞中MS28有效抑制Rb-E2F信号通路,以及相应肿瘤触发和增殖
在BT-549乳腺癌细胞系中,MS28也能选择性的降解cyclin D1/3,而对cyclin D2、CDK2/4/6没有任何影响(图8)。

图8. 在BT-549细胞中,MS28选择性降解cyclin D1/3
此外,MS28尽管能够在正常细胞PNT2中浓度依赖地降低cyclin D1和CDK4/6的蛋白水平,但是对该细胞没有表现出任毒副作用,表明正常细胞是不依赖cyclin D1和CDK4/6维持常规运作的(图9)。

图9. 在正常PNT2细胞系中,MS28能够降解cyclin D1和CDK4/6,但不表现出细胞毒性
最后,作者对MS28进行PK研究,评估MS28在小鼠体内的生物利用度。实验结果发现MS28展现出优良的PK特性在体内可以获得足够的血浆暴露(图10)。

图10. MS28展现出优良的PK特性
总结
传统的PROTAC技术由于其独特的蛋白降解机制在药物研发中受到了越来越多的关注,但是需要通过直接结合靶标蛋白才能发挥功效,面临着很大的局限性。金坚课题组首次报道了bridged-PROTAC策略,通过“隔山打牛”的方法,不直接结合不可成药的cyclin D1靶标却成功将其降解,展现出了其巨大的应用前景,极大地扩展了可成药靶标。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Bridged Proteolysis Targeting Chimera (PROTAC) Enables Degradation of Undruggable Targets
Yan Xiong, Yue Zhong, Hyerin Yim, Xiaobao Yang, Kwang-Su Park, Ling Xie, Poulikos I. Poulikakos, Xiaoran Han, Yue Xiong, Xian Chen, Jing Liu, and Jian Jin*
J. Am. Chem. Soc., 2022, DOI: 10.1021/jacs.2c09255
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号