JACS:化学酶法合成Gedunin
柠檬苦素类化合物是一类含有呋喃环并且高度氧化的四降三萜类植物次生代谢产物(图1A),具有广泛的结构多样性和药理作用(图1),例如:epoxyazadiradione可以抑制Tau蛋白聚集、deoxygedunin可以引发TrkB激动、gedunin(1)可以有效抑制HSP90等。在过去的几十年里,Yamashita和Corey陆续实现了limonin(2,35步)、azadiradione(3,27步)和protolimonoid(4,20步)的全合成,但目前还尚未报道过gedunin(1)的全合成,更别提复杂柠檬苦素类似物的生物合成方法了。尽管角鲨烯转化为30C protolimonoid melianol(5)的过程已被阐明(图1B),但是有关该家族中更复杂成员的后续生源转化的报道却寥寥无几,这严重阻碍了高价值柠檬苦素类似物的合成。
近日,美国莱斯大学(Rice University)的Hans Renata教授课题组首次利用化学酶促法以13步、5.5%的总收率合成了gedunin(1),一种具有HSP90抑制活性的环D-seco柠檬苦素类似物。其关键之处在于:1)应用现代催化转化(氢转移介导的醇官能团化和氢原子转移的Giese加成)在C8和C13处构建两个关键的季碳中心;2)在C3处使用生物催化氧化来构建一个化学手柄以合成A环的烯酮结构单元。相关成果发表在J. Am. Chem. Soc. 上。
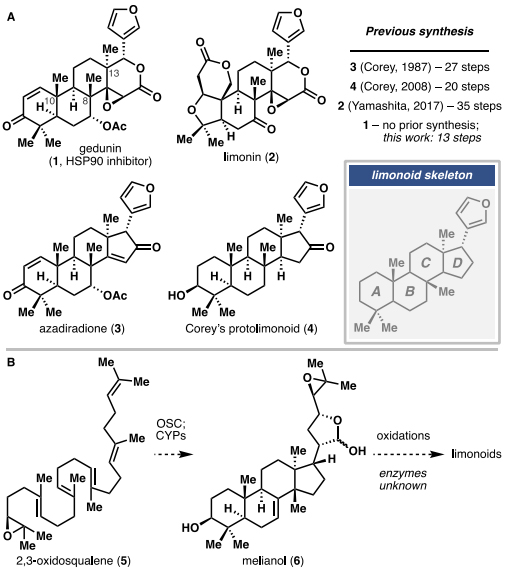
图1. 代表性的柠檬苦素及其目前生物合成方面的知识差距。图片来源:J. Am. Chem. Soc.
Gedunin (1) 的合成面临着几个独特的挑战:1)高度氧化的碳环骨架;2)高度拥挤的B/C/D三环体系;3)C8、C10和C13三个季碳中心;4)C/D双环上热力学不利的船式-船式构型。为此,作者进行了逆合成分析(图2):其中gedunin(1)可通过具有D环的片段8与具有A、B环的片段7之间的偶联反应来构建1所需的C环,而7则可以由sclareolide(9)经酶催化的C3位选择性氧化转化而来。实际上,对于gedunin的合成,其手性中心大多数已经在片段7和8的合成中构建,后续的合成只需要通过构建C环引入两个新的手性中心,这种汇聚式合成策略也将使合成步骤更加简洁高效。
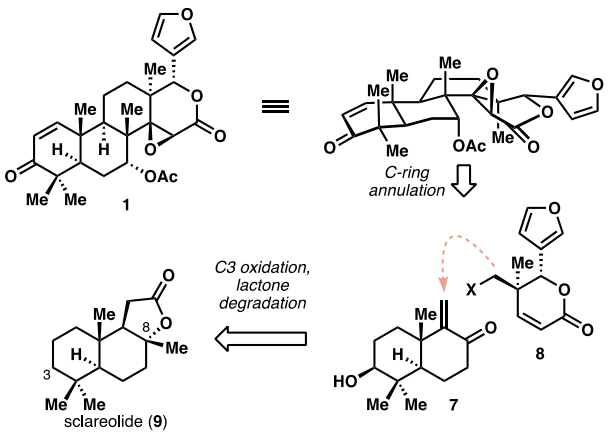
图2. 逆合成分析。图片来源:J. Am. Chem. Soc.
尽管先前的报道利用P450BM3变体实现了sclareolide(9)的C3-位羟基化,但是本文却不能在合成的第一步进行C3-位氧化,这是因为得到的C3-OH需要在后续的合成中进行保护。为此,作者试图将9的内酯单元转化为相应的B环烯酮,然后再进行C3-位氧化,但是该过程存在一定的挑战,这是因为P450酶可催化烯酮和二烯酮的环氧化。如图3A所示,作者首先利用MeLi对sclareolide(9)的内酯进行加成以在C12-位生成甲基酮,再经Baeyer-Villiger氧化得到醋酸酯,接着将C8-位叔醇进行消除得到化合物10,再经臭氧化和OAc消除便可以3步29%的总收率得到烯酮11。随后,作者筛选了几种P450BM3酶来实现11的C3-位氧化,结果显示不同的酶会导致C3-位氧化产物7与烯酮环氧化产物12的比例不同。另外,酶氧化的效率和化学选择性可通过调整酶活性部位的丙氨酸片段而改变,因此当使用MERO1 L437A酶进行氧化时,可以得到68%的7,同时生成极少量的C9-C11环氧化副产物。需要指出的是,在该阶段引入C3-OH后便无需在后续过程中进行不必要的保护基操作。其次,作者采用Krische报道的方法,将糠醇13与单氧化异戊二烯14置于Ir催化剂下进行反应,以优异的收率和选择性一步法构建C13-位季碳立体中心化合物16,对其仲醇进行保护并得到化合物17,接着在Hoveyda-Grubbs II催化剂的作用下发生关环复分解反应(RCM)获得相应的不饱和内酯18,最后经Appel反应进行碘代便能合成片段8(图3B),整个过程仅需4步。
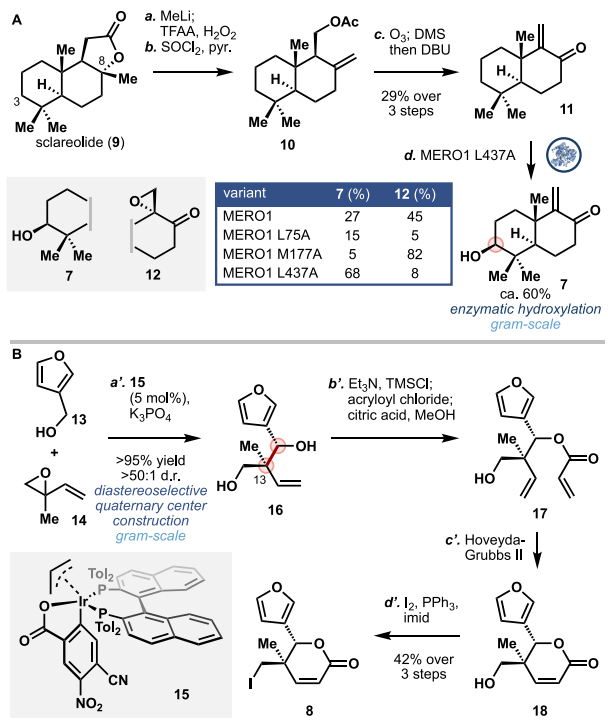
图3. 烯酮片段7与碘代物8的制备。图片来源:J. Am. Chem. Soc.
接下来,烯酮7与碘代物8在Luche发展的条件下进行偶联反应(图4),以93%的收率得到单一的非对映异构体19,随后C8-位羰基发生Wittig反应引入末端双键,再通过DMP氧化仲醇得到中间体20(两步总收率:90%),经SeO2介导的C7-位烯丙基氧化得到烯丙醇中间体,接着在Fe(acac)3与PhSiH3的作用下发生氢转移的Giese偶联,以两步83%的总收率得到了所需的碳环骨架21(单一异构体)。然后,环化产物21在LDA和TMSCl的作用下得到相应的烯醇硅醚22,再在Pd(OAc)2为催化剂、O2为氧化剂的条件下顺利地实现了A环及D环的脱氢氧化,随后使用醋酸酐将C7-位羟基转化为OAc,以3步、73%的总收率得到中间体23,最后在m-CPBA的作用下选择性氧化C14、C15位双键,就能以13步、5.5%的总收率实现天然产物gedunin(1)的全合成。尽管底物α-和β-面的空间环境看起来相似,但是环氧化以完全的facial选择性进行,这归因于α-面环氧化时会遭受与 C7-OAc基团不期望的孤对-孤对排斥。
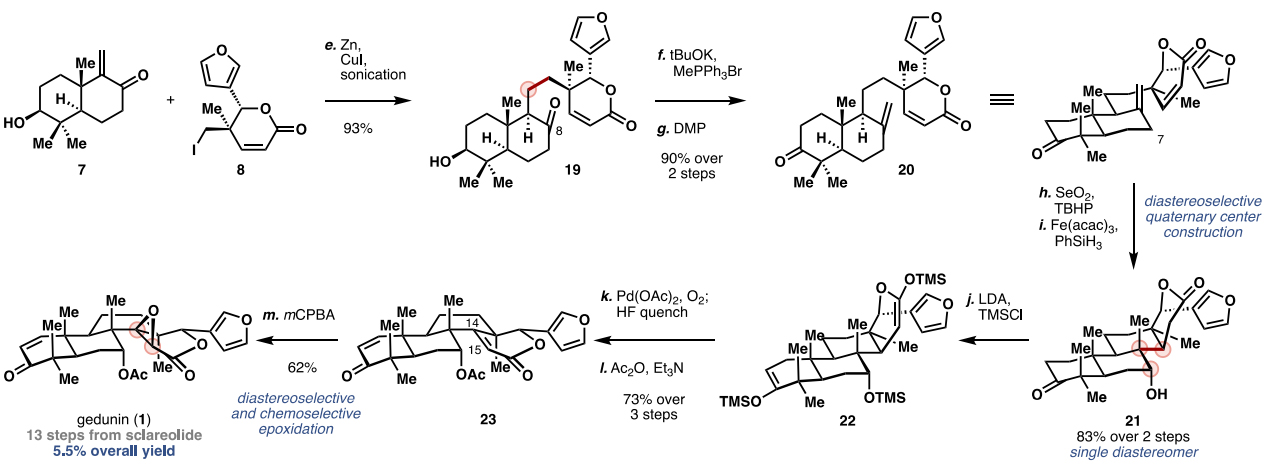
图4. Gedunin (1) 的合成。图片来源:J. Am. Chem. Soc.
总结
Hans Renata教授课题组从sclareolide (9)出发,通过13步完成了gedunin 的首次从头合成。该过程的两个关键特征是:1)通过使用现代催化转化(氢转移介导的醇官能团化和氢原子转移的Giese加成)在C8和C13处构建两个季碳中心;2)通过生物催化引入7的C3醇,同时将烯酮环氧化的干扰最小化,这极大地简化了整个合成过程中的保护基操作和氧化还原调整。可以预见,该策略将为其它更复杂柠檬苦素类似物的合成奠定了基础。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Concise Chemoenzymatic Synthesis of Gedunin
Jian Li, Fang Chen, Hans Renata
J. Am. Chem. Soc., 2022, 144, 19238-19242, DOI: 10.1021/jacs.2c09048
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!































 京公网安备 11010802027423号
京公网安备 11010802027423号