Science:自由基和离子途径实现吡啶间位C-H键官能团化
吡啶及其衍生物不仅是药物分子和农用化学品中最常见的骨架之一(图1A),而且在配体和功能材料中也发挥着重要作用。通常情况下,吡啶C-H键官能团化方法主要依赖于邻位和对位的电性差异来实现,但对于普通吡啶的间位C-H键官能团化却更具挑战性。尽管亲电芳香取代已应用于吡啶的间位选择性卤化/硝化,但苛刻的酸性条件限制了其应用。在过去的几十年里,过渡金属催化的吡啶C-H键官能团化已成为药物、农药和生物活性天然产物中吡啶衍生物的最佳合成策略(图1B),例如:1)在空间位阻控制的基础上,铱催化的吡啶间位C-H键硼化和甲硅烷基化;2)通过配体设计实现钯催化的吡啶间位C-H键烯基化和芳基化反应,但是这两种策略的反应类型和底物范围都有些受限。另外一种策略是吡啶临时脱芳构化,即将缺电子的杂芳烃转化为活化的富电子中间体,再经亲电反应以及随后的芳构化获得间位取代的杂芳烃(图1C),但是这种策略常常受制于烯胺稳定性的影响。综上,虽然在吡啶的间位选择性官能团化方面取得了一定进展,但是要想在温和条件下实现吡啶及其衍生物C3-H键官能团化仍颇具挑战。
近日,德国明斯特大学Armido Studer教授课题组利用氧化还原中性脱芳构化-芳构化策略,成功地实现了吡啶、喹啉和异喹啉等的间位C-H键官能团化(图1D),制备了一系列间位三氟甲基、全氟烷基、氯、溴、碘、硝基、硫代和硒代-杂芳烃。具体过程如下:首先,吡啶可以与廉价易得的乙炔二羧酸盐反应形成 Huisgen 1,4-偶极子,能与羰基偶极试剂发生脱芳构化环加成反应形成稳定的oxazino-吡啶中间体。该中间体可与多种自由基前体和亲电试剂进行区域选择性自由基和离子型C-H键官能团化,最后经酸促进的芳构化便可获得间位官能团化的吡啶。相关成果发表于Science 上,第一作者为Hui Cao博士与Qiang Cheng博士。
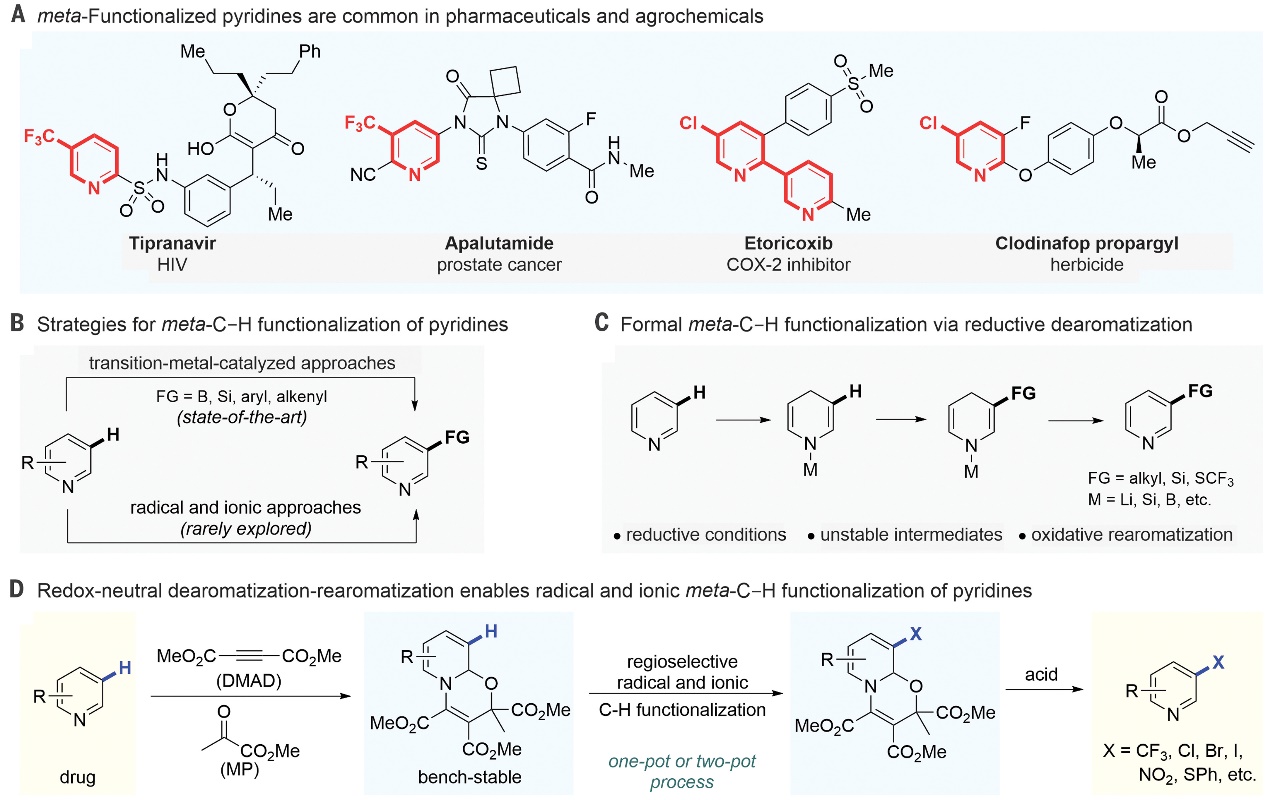
图1. 吡啶间位的官能团化。图片来源:Science
首先,作者对吡啶的氧化还原中性去芳构化和芳构化的反应条件进行了探索(图2),结果显示吡啶、乙炔二甲酸二甲酯(DMAD)和丙酮酸甲酯(MP)在乙腈为溶剂的空气氛围下于室温进行三组分偶联反应,能以89%的收率生成稳定且无需分离的oxazino-吡啶非对映体的混合物,其可作为高效的碳自由基受体和亲核试剂。另外,作者还将脱芳构化-芳构化策略与三氟甲基自由基化学相结合,即将oxazino-吡啶中间体、廉价的三氟碘甲烷与有机碱DBU置于蓝光照射下进行反应,成功地实现了吡啶间位直接安装三氟甲基,并且三氟甲基自由基与亲核脱芳构化中间体的高度电性匹配实现了高区域选择性。进一步研究后,作者认为该反应的具体过程如下:C-I键在蓝光照射下均裂产生三氟甲基自由基(链引发),再与oxazino-吡啶中间体进行加成产生相应的自由基,随后从CF3I中攫取碘原子来维持链增长,最后经DBU介导的HI消除生成三氟甲基化的oxazino-吡啶,最后在酸性条件下芳构化便可获得所需产物。
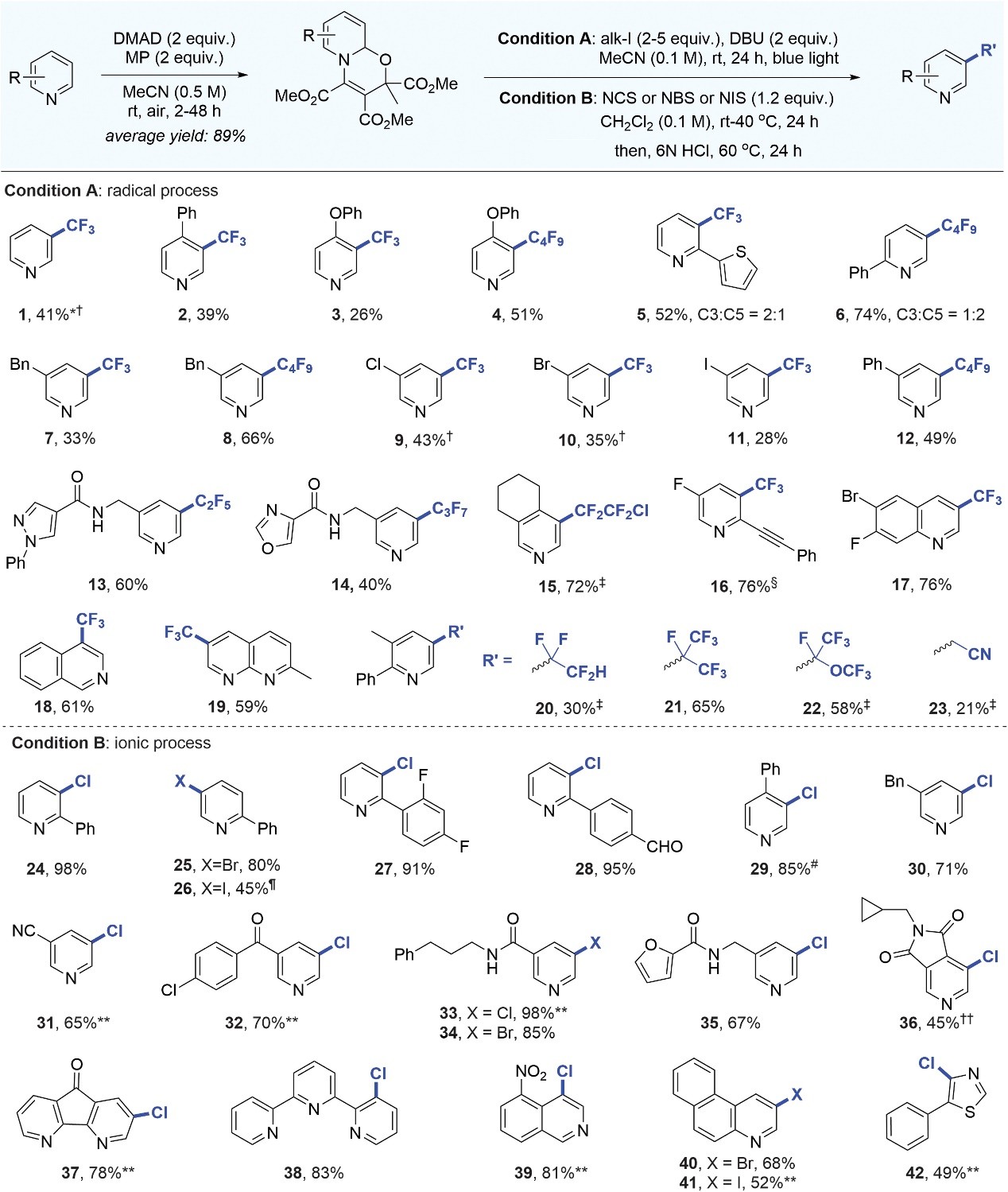
图2. 底物拓展。图片来源::Science
在最优条件下,作者对底物范围进行了考察(图2),结果显示无论给电子基团(如:苯基(2)、苯氧基(3)、烷基(7))还是吸电子基团(如:卤素原子(9、10、11、16))取代的吡啶、杂芳基取代的吡啶(如:噻吩(5)、吡唑(13)、噁唑(14))、多取代吡啶(15、16、20-23)甚至喹啉(17)、异喹啉(18)和萘啶(19)均能兼容该反应,并以完全的间位选择性获得所需产物,特别是含有两个间位C-H键的底物(1-6)仅获得单官能团化产物。需要指出的是,oxazino-吡啶中间体的二烯胺骨架在β-和 δ-位均具有反应性,从而导致2-芳基吡啶得到C3-和 C5-位官能化产物的混合物(5 和 6),而产物 5 和 6 相反的选择性则表明了空间位阻对自由基加成的影响。通过改变自由基前体,也能在吡啶、喹啉和异喹啉的间位引入其它多氟烷基(4、6、8、12-15、20-22),并且全氟烷基化的效率比三氟甲基化的效率更好。随后,作者使用市售的N-卤代琥珀酰亚胺对温和条件下吡啶间位直接卤化的底物范围进行了探索,成功地实现了一系列富/缺电子基团取代吡啶(24-36)、联吡啶和三联吡啶(37、38)、异喹啉(39)、1-氮杂菲(40、41)以及噻唑(42)的间位选择性亲电卤化。值得一提的是,对于含有两个间位C-H键的2-芳基吡啶(24-28),可以相反的区域选择性实现单氯化(C3 位)和单溴化(C5 位),进而解决了二烯胺中间体的 β-或δ-反应性。作者推测这可能是因为氯化作用不可逆地发生在更亲核的β-位并获得动力学产物,而由于C-Br键较弱且溴化是可逆的,进而获得空间位阻较小且热力学更稳定的δ-溴二烯胺中间体。

图3. 药物和药物分子的间位官能团化。图片来源:Science
其次,该方法对于含有吡啶的药物分子及其衍生物的后期修饰同样有效。如图3所示,12种具有不同取代模式的药物分子及其衍生物(43-68)均能以良好的产率(30-92%)发生选择性的间位官能团化。具体而言:1)各种官能团均可以自由基和离子途径选择性地引入生物碱(-)-可替宁的间位,包括:三氟甲基(43)、五氟乙基(44)、氯(45)、溴(46)、碘(47)、硝基(48)、硫基(49)和硒基(50);2)美替拉酮中相对富电子的吡啶可选择性地发生三氟甲基化(54)和氯化(55);3)伊马替尼前体中的嘧啶部分耐受性良好(56, 收率76%);4)含有4-烷基吡啶部分的托吡卡胺能以中等产率获得单三氟甲基化产物(59),而具有4-芳基吡啶部分的米力农则获得单-和双-三氟甲基化的混合物(58),并且可分离;5)Vismodegib 可分别实现3-氯化(63, 收率92%)和5-溴化(64, 收率69%);6)具有联吡啶结构的药物Abametapir,其单脱芳构化中间体得到间,间'-二氯化产物(65, 收率70%)和间,间'-二溴化产物(66, 收率51%),这可能是由于相应脱芳构化中间体的高反应性所致;7)利用氘水和氘代三氟乙酸处理法舒地尔的脱芳构化中间体,可实现其选择性氘化(68, 收率86%, >99%氘化率)。此外,尽管一些药物和前体在脱芳构化之前需要保护羟基或氨基(53、56、67和68),但是酸促进的重芳构化却可以方便地合成游离醇或胺产物。
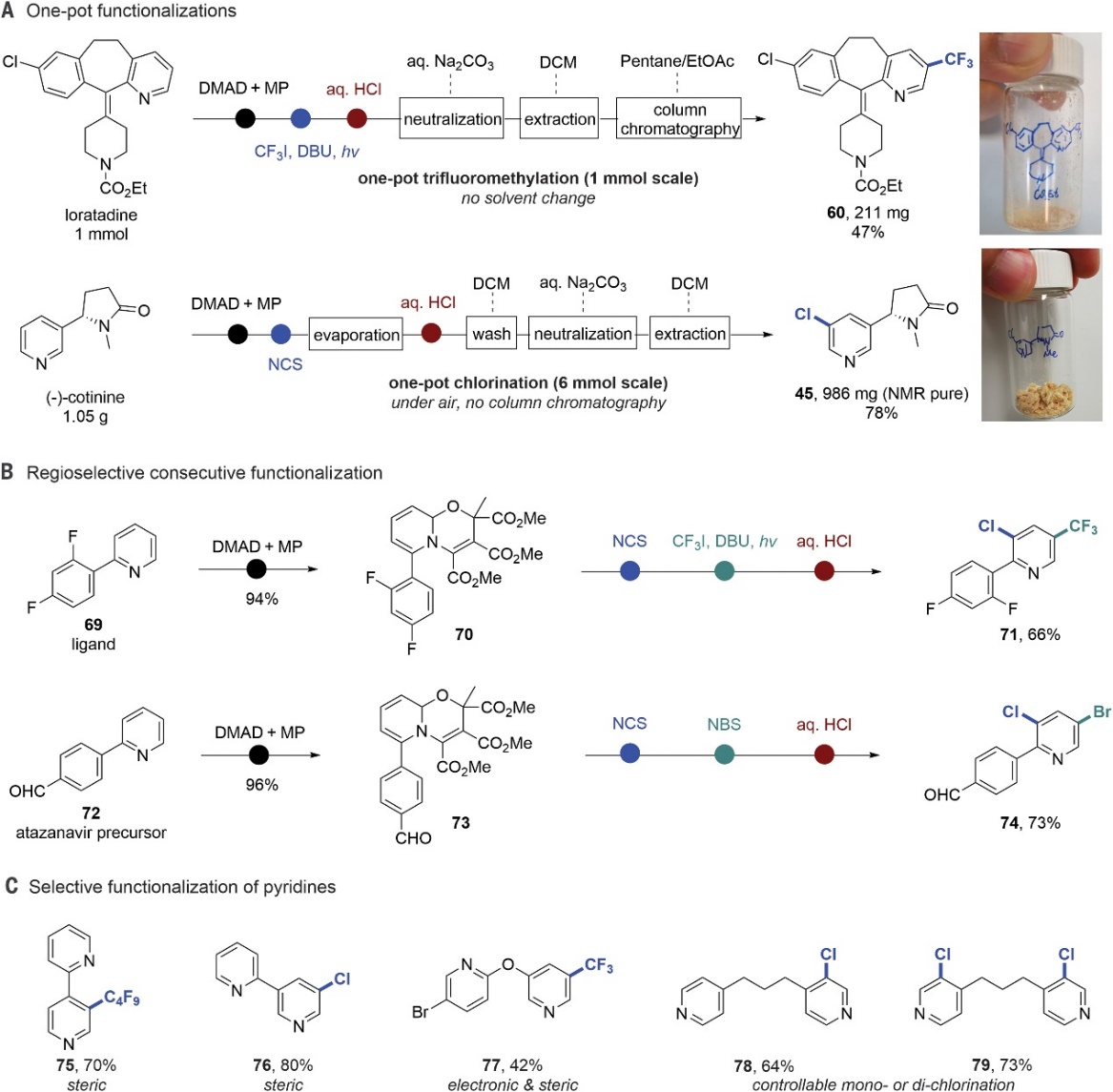
图4. 合成应用。图片来源:Science
最后,作者对该反应进行了合成应用(图4),例如:1)从氯雷他定(1 mmol)出发,以47%的分离收率一步法获得间位三氟甲基化产物60(图4A),而以(-)-可替宁为原料,可以78%的收率一步实现间氯代(-)-可替宁(45)的克级规模制备,并且无需柱色谱分离;2)充分利用二烯胺中间体的β-和 δ-反应性,成功地实现了配体69的顺序离子氯化和自由基三氟甲基化并获得3,5-双官能化吡啶71(图4B),同时还实现了阿扎那韦前体72的顺序离子-离子双官能团化(74,收率:73%);3)当分子中存在两种不同的吡啶时,富电子和小空间位阻的吡啶具有高选择性(54-55、75-79),特别是含有相同化学环境的吡啶衍生物(78-79)还能进行受控的单-/双-脱芳构化,从而获得相应的单-/双-氯化产物(图4C)。
总结
Armido Studer教授团队通过氧化还原中性脱芳构化-重芳构化策略,成功以自由基和离子途径实现了吡啶、喹啉和异喹啉等杂芳烃的间位 C-H 键官能团化。该方法具有条件温和、选择性高、可操作性高以及官能团耐受性好等优点,并且对药物分子及其前体的后期修饰也有很好的效果。毫无疑问,该方法将极大地促进含吡啶类药物和有机功能材料的进一步发展。
值得一提的是,同期Science 上还报道了吡啶间位C-H键官能团化的另外一项成果,X-MOL将于明日带来解读。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Radical and ionic meta-C–H functionalization of pyridines, quinolines, and isoquinolines
Hui Cao, Qiang Cheng, Armido Studer
Science, 2022, 378, 779-785. DOI: 10.1126/science.ade6029
(本文由吡哆醛供稿)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!
-
超越电子效应:余金权团队实现无导向基的芳烃间位选择性C-H键活化 2019-10-01
-
Nature:“一锅法”吡啶C-H键氟烷基化 2021-05-11








































 京公网安备 11010802027423号
京公网安备 11010802027423号