Chem:可见光介导的多组分反应——合成α-氯代烷基硼酸酯的新方法
α-氯代烷基硼酸(α-CAB)酯是一类比较稳定的双功能分子。该类分子的碳原子上同时包含具有不同反应性的C–Cl键和C–B键,使得该碳原子可以转化为碳亲核试剂、碳亲电试剂或者碳自由基中间体,进而表现出各自不同的反应性。尽管α-CAB酯具有以上多种用途,但它的复杂衍生物很难通过现有方法制备。基于此,来自英国剑桥大学的Matthew J. Gaunt教授团队近日在Cell Press细胞出版社期刊Chem 上发表了题为“Multicomponent synthesis of α-chloro alkylboronic esters via visible-light-mediated dual catalysis”的最新研究。他们使用一种新颖的可见光介导的双金属协同催化系统,并将二芳基碘鎓盐、乙烯基硼酸酯和简单的金属氯化物转化为稳定的、多用途的α-CAB酯类化合物。
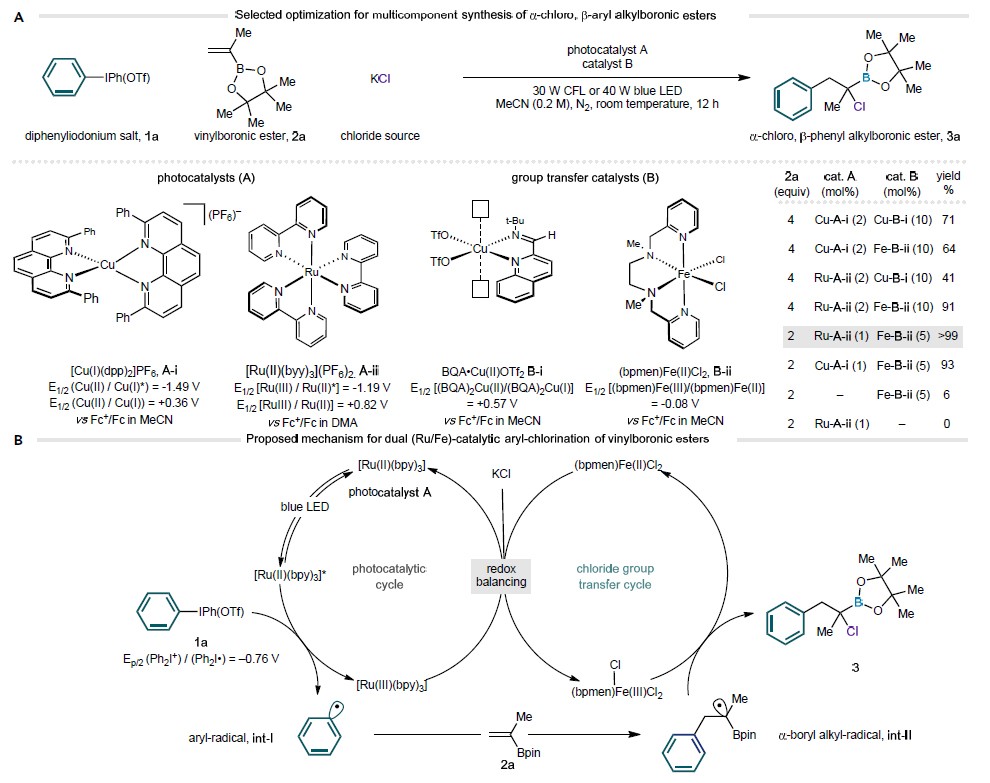
图1. 反应条件的优化和反应机理
经过细致的条件筛选,作者发现当使用二芳基碘鎓盐1a(1.0 当量)、乙烯基硼酸酯2a(2.0 当量)和氯化钾(2.0 当量)作为起始原料(图1A),使用 [Ru(II)(bpy)3](PF6)2 (A-ii,1 mol %)和 (bpmen)Fe(II)Cl2 (B-ii,5 mol %) 分别作为光敏剂和氯原子转移催化剂时(图1B),反应能以99%的分析产率和82%的分离产率得到α-CAB酯 3a。
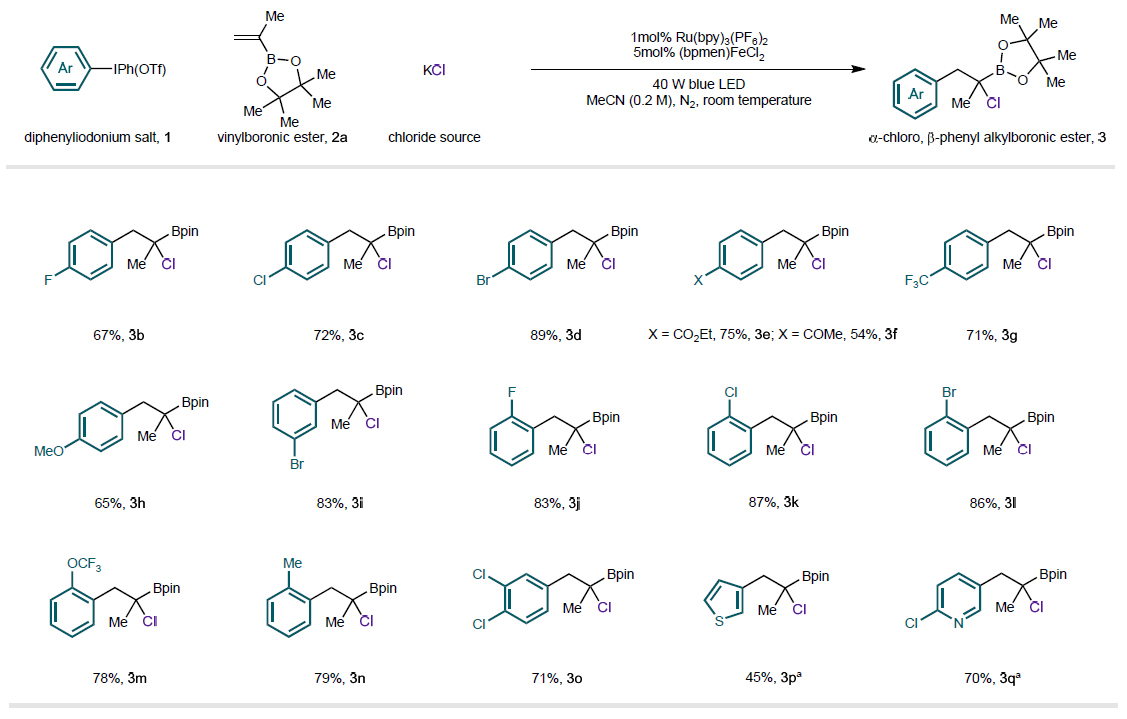
图2. 芳基碘鎓盐的底物范围
作者首先以甲基取代的乙烯基硼酸酯2a和氯化钾为起始原料,对二芳基碘鎓盐的芳基取代基进行了考察。作者发现:二芳基碘鎓盐的苯环邻、间、对位上可以兼容一系列的吸电子基(图2, 3b-g, 3i-m, 3o)和给电子基(图2, 3h, 3n);杂芳环取代基,如:噻吩环、吡啶环,也可以适用于该体系,但反应效率有所下降(图2,3p-q)。
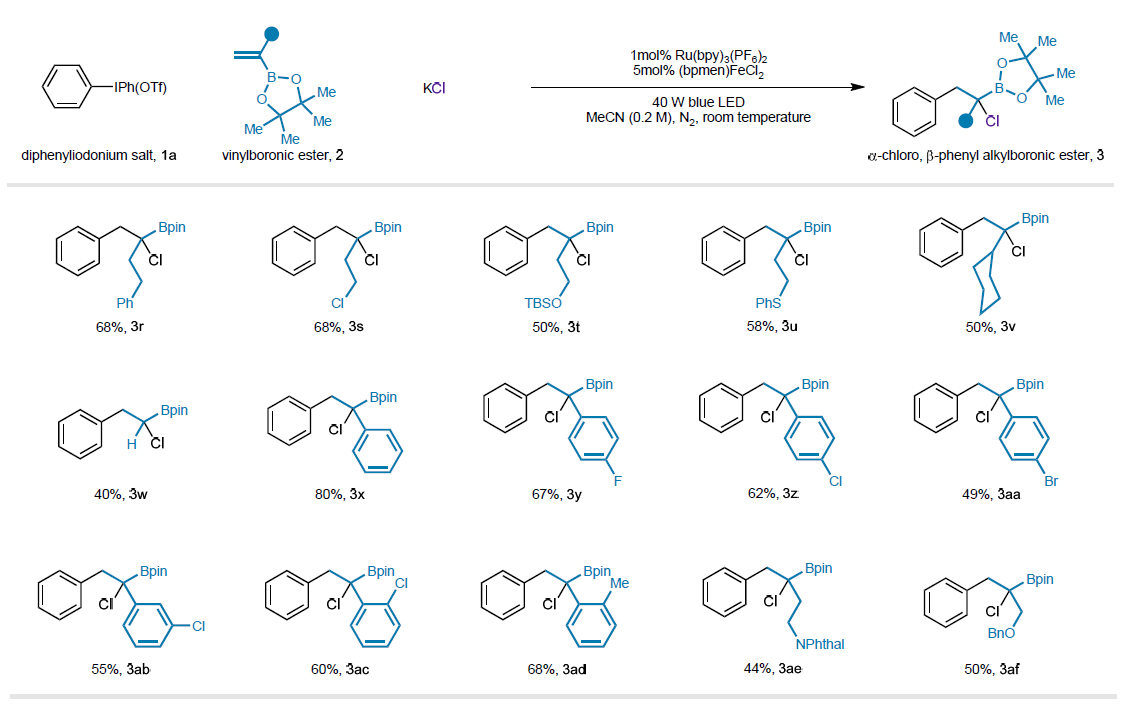
图3. 乙烯基硼酸酯的底物范围
紧接着,作者对乙烯基硼酸酯的底物范围进行了考察。作者发现:乙烯基硼酸酯的α位可以兼容一系列的烷基(图3,3r-v,3ae-af)、芳基取代基(图3,3x-z, 3aa-3ad),并普遍能以中等至较高的收率得到α-CAB 酯类化合物;当乙烯基硼酸酯的α位是氢原子,反应效率有所降低(图3,3w),可能是由于氢原子不利于稳定反应过程中的α-二羟硼基-烷基自由基。
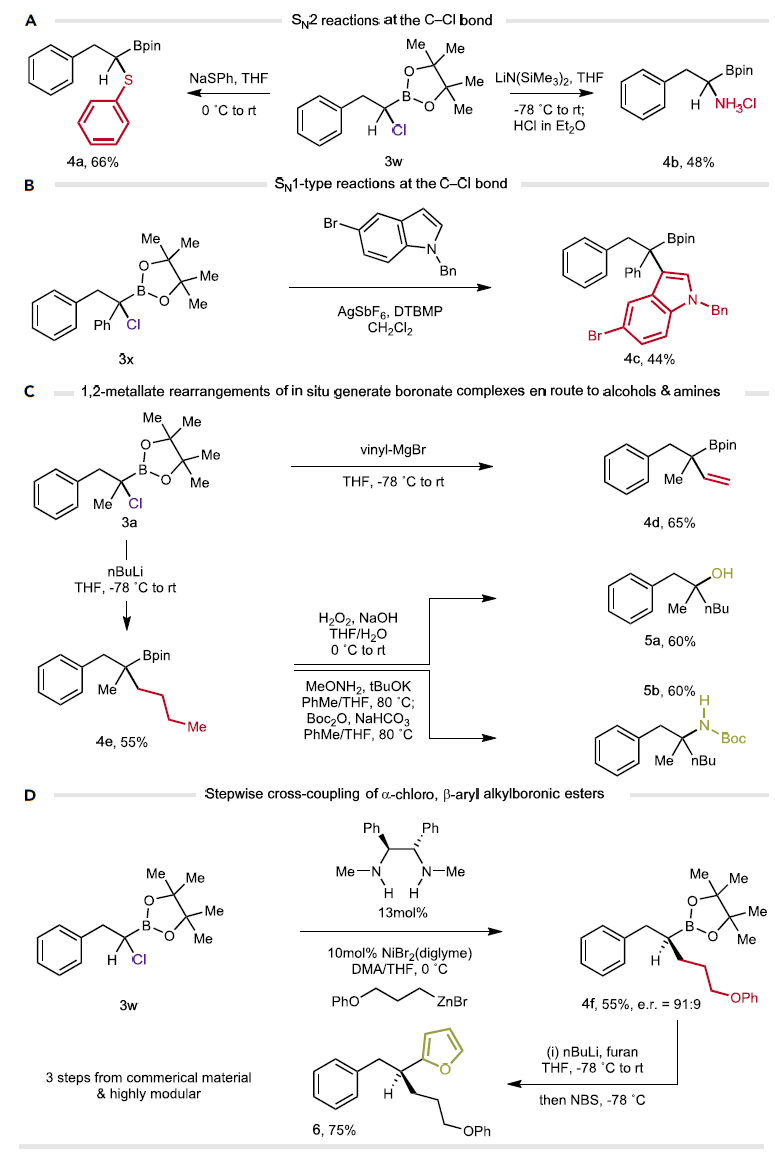
图4. α-CAB酯类产物的多样反应性探究
在拓展了一系列底物范围之后,作者还考察了α-氯代烷基硼酸酯与α-氯代,α’,α’’-双烷基硼酸酯类产物的多样反应性。例如,α-氯代烷基硼酸酯3w 的C–Cl键可以分别与硫醇盐、双三甲基硅基胺基锂等较强的亲核试剂发生SN2取代反应,生成产物4a与4b(图4A);大位阻的α-氯代烷基硼酸酯3x在AgSbF6的活化下,可以与中性的亲核试剂——吲哚衍生物发生SN1取代反应,生成三级取代的硼酸酯4c(图4B);此外,α-CAB 酯3a与烷基金属试剂也可以构建新的C–C键。例如,3a可以分别与乙烯基格氏试剂、正丁基锂试剂反应,生成全碳取代的硼酸酯4d-e(图4C)。根据已知方法,硼酸酯4e可以进一步被氧化成相应的三级醇5a和三级胺5b(图4C);另外,硼酸酯3w的亲电性C–Cl键和亲核性C–B键之间可以发生序列的交叉偶联反应并产生复杂产物6。这也进一步印证了α-氯代烷基硼酸酯类化合物的正交反应性。
综上,该研究团队发展了一种多组分构建α-CAB酯类化合物的新方法。该工作成功的关键是利用一种新型的可见光介导的共催化系统产生芳基自由基,并结合烯烃与氯化物,进一步生成稳定的α-CAB酯类化合物。该反应对二芳基碘鎓盐和乙烯基硼酸酯类底物表现出很好的兼容性。此外,作者还分别通过不同的活化模式,实现了α-CAB酯同一碳原子上的多样取代反应,进一步展示了α-CAB酯的正交反应性。因此,作者相信这种新型共催化模式介导的乙烯基硼酸酯的芳基氯化反应以及后续α-CAB酯的多样衍生化将会引起学术界以及工业界有机合成和药物化学领域的工作者们的研究兴趣。
原文(扫描或长按二维码,识别后直达原文页面,或点此查看原文):

Multicomponent synthesis of α-chloro alkylboronic esters via visible-light-mediated dual catalysis
Bo Li, Ala Bunescu, Matthew J. Gaunt
Chem, 2022, DOI: 10.1016/j.chempr.2022.10.010
(本稿件来自Cell Press)
如果篇首注明了授权来源,任何转载需获得来源方的许可!如果篇首未特别注明出处,本文版权属于 X-MOL ( x-mol.com ), 未经许可,谢绝转载!



















































 京公网安备 11010802027423号
京公网安备 11010802027423号